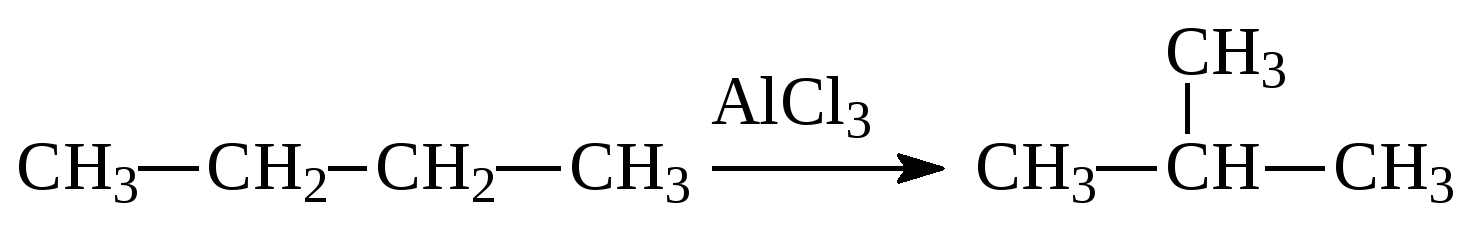Контрольная работа по химии (11 класс)
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение.
1. (2 балла). Характеристика реакции, уравнение которой 4Fe +6H2O +3O2 = 4Fe(OH)3:
А. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая. В. Соединения, ОВР, необратимая. Г. Обмена, не ОВР, необратимая.
2.(2 балла). Какая масса угля вступает в реакцию, термохимическое уравнение которой С + О2 = СО2 + +402кДж, если при этом выделяется 1608 кДж теплоты?
3. (2 балла).Характеристика реакции, уравнение которой AlCl3

А. Дегидрирования, гомогенная, каталитическая. Б. Изомеризации, гомогенная, каталитическая. В. Полимеризации, гетерогенная, каталитическая. Г. Присоединения, гетерогенная, каталитическая.

А. N. Б. H. В. H. Г. N.
5. (2 балла). При повышении температуры на 30оС (температурный коэффициент γ = 3) скорость реакции увеличится: А В 3 раза. Б. В 9 раз. В. В 27 раз. Г. В 81 раз.

А. Повышение температуры и давления. Б. Понижение температуры и давления. В. Понижение температуры и повышение давления. Г. Повышение температуры и понижение давления.
7. (2 балла). Щелочную среду имеет водный раствор соли, формула которой: А. AlCl3. Б. KNO3. В. K2CO3. Г. FeCl3.
8. ( 2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
А. SO32+, K+, H+, SO42-. Б. Mg2+, Na+, Cl-, NO3-. В. Na+, Al3+, OH-, SO42-. 
9. (2 балла). Краткое ионное уравнение Ba2+ + SO42- = BaSO4 отображает взаимодействие серной кислоты и вещества: А. Бария. Б. Гидроксида бария. В. Нитрата бария. Г. Оксида бария.
10. (2 балла). Гидролизу не подвергается: А. Белок. Б. Сульфат цинка. В. Целлюлоза. Г. Этилен.
11. (8 баллов). Установите соответствие. Левая часть уравнения реакции в молекулярном виде:
1. Fe + 2HCl = 2. FeO + 2HCl = 3. Fe(OH)2 + 2HCl = 4. Fe(OH)3 + 3HCl =
Правая часть краткого ионного уравнения:

ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). Составьте уравнения реакции взаимодействия магния с соляной кислотой. Дайте полную характеристику данной реакции по всем изученным признакам.
13. (6 баллов). Рассчитайте объём углекислого газа (н. у.), выделяющегося при взаимодействии 50г мрамора, содержащего 10% некарбонатных примесей, с избытком соляной кислоты.
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: 1 2 3


Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)

1.(2 балла). Характеристика реакции, уравнение которой 2КСCl3 = 2КС1 + ЗО2 :
A. Реакция замещения, ОВР, обратимая. Б. Реакция разложения, ОВР, необратимая.
B. Реакция разложения, не ОВР, необратимая. Г. Реакция обмена, не ОВР, необратимая.
2. (2 балла). Какое количество теплоты выделится при взаимодействии 5,6 л водорода(н. у) с избытком хлора (термохимическое уравнение: Н2 + С12 = 2НС1 + 92,3 кДж)?
А. 2,3 кДж. В. 46 кДж.
Б. 23 кДж. Г. 230 кДж.
3. (2 балла). Характеристика реакции, уравнение которой СН3—СН2—С/Н3 СН3 – CH = СН2 + H2
A. Реакция дегидрирования, гомогенная, каталитическая.
Б. Реакция гидратации, гомогенная, каталитическая.
B. Реакция гидрирования, гетерогенная, каталитическая.
Г. Реакция дегидратации, каталитическая, гомогенная.

А. С. Б. С. В. О. Г. О.
5. (2 балла). Для увеличения скорости химической реакции в 64 раза (температурный коэффициент γ = 2) надо повысить температуру:
А На ЗО° С. Б. На 40 °С. В. На50°С. Г. На 60 °С.
6. (2 балла). Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой

A. Повышение температуры и давления.
Б. Понижение температуры и давления.
B. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
7 (2 балла). Кислотную среду имеет раствор соли, формула которой: А. КСl. Б. ZnSO4. В. Na2CO3. Г. NaNO3.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. SO42-, Na+, ОН-, Ва2+. Б. Сu2+, К+, ОН-, С1-. B. .Н+, Na+, C1-, SO42-. Г. Н+, Са2+, NO3-, СО32-.

A. CuO. Б. CuS. B. CuCl. Г. СuС12.
10 (2 балла). Гидролизу подвергается:
А„ Ацетилен. Б. Нитрат калия. В. Целлюлоза. Г. Этанол.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1„ СаСО3 + 2НС1 = 3. Na2CO3 + СаС12 =
2. Na2CO3 + 2HC1 = 4. СаСО3 + Н2О + СО2 =



B. = Са2+ + CO2 + Н20.
ЧАСТЬ Б. Задания со свободным ответом
12 (6 баллов). Составьте уравнение реакции горения водорода. Дайте полную характеристику
данной химической реакции по всем изученным классификационным признакам.
13 (6 баллов). Какой объем ацетилена (н. у.) можно получить из 20 г технического карбида
кальция, содержащего 20% примесей?
14 (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить сле-
дующие превращения: 1 2 3


Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение

A. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая.
B. Соединения, ОВР, необратимая. Г. Обмена, не ОВР, необратимая.
2. (2 балла). Какое количество теплоты необходимо для синтеза 67,2 л оксида азота (II) (термохимическое уравнение N2 + О2 = 2NO — 90,4 кДж) ?
А. 45,2 кДж. Б. 135,6 кДж. В. 180,8 кДж. Г. 226 кДж.
3 (2 балла). Характеристика реакции, уравнение которой

A. Дегидрирования, гомогенная, каталитическая.
Б. Изомеризации, гомогенная, каталитическая.
B. Полимеризации, гетерогенная, каталитическая.
Г. Присоединения, гомогенная, каталитическая.
4 (2 балла). Окислитель в реакции, уравнение которой 2А1 + Fe2O3 = А12О3 + 2Fe + Q:
А. А1. Б. А1. В. Fe. Г. Fe.
5 (2 балла). При повышении температуры на 30 °С (температурный коэффициент γ = 2) скорость реакции увеличится:
А. В 2 раза. Б. В 4 раза. В. В 6 раз. Г. В 8 раз.

A. Повышение температуры и давления.
Б. Понижение температуры и давления.
B. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
7 (2 балла). Щелочную среду имеет водный раствор соли, формула которой:
А. А1С13. Б. NaNO3. В. Na2S. Г. ВаС12.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. К+, Cu2+, C1-, ОН-. Б. Na+, Ва2+, ОН-, С1-. B. Са2+, Н+, СО32- , NO3-. Г. Н+, К+, S2-, SO42- .

A. Fe2O3. Б. FeCl2. В. FeCl3. Г. FePO4.
10 (2 балла). Гидролизу не подвергается:
А. Стеарат натрия. Б. Сульфат натрия. В. Целлюлоза. Г. Этилэтаноат.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1. CuO + H2SO4 = 3. Сu(ОН)2 + H2SO4 =
2. 
Правая часть краткого ионного уравнения:
A.= Сu2+ + Н2О. Б. = 2Сu+ + Н2О. B.= Сu2+ + 2Н2О. Г. = Cu2++H2O +SO2 Д. = Cu2++H2O + CO2
ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). Составьте уравнение реакции взаимодействия растворов сульфата магния и хлорида бария. Дайте полную характеристику данной химической реакции по всем изученным классификационным признакам.
13. (6 баллов). Рассчитайте объем углекислого газа (н. у.), выделившегося при полном сгорании 5 л метана, содержащего 5% негорючих примесей.
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: 1 2 3


Для перехода 3 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 (2 балла). Характеристика реакции, уравнение которой 2А1 + Fe2O3 = 2Fe + А12О3:
A. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая.
B. Замещения, не ОВР, обратимая. Г. Обмена, не ОВР, необратимая.
2 (2 балла). Какой объем хлора вступает в реакцию, термохимическое уравнение которой
Н2 + С12 = 2НС1 + 92,3 кДж, если при этом выделяется 184,6 кДж теплоты?
А. 11,2 л. Б. 22,4 л. В. 33,6 л. Г. 44,8 л. H3PO4, t

А. Реакция гидратации, гомогенная, каталитическая.
Б. Реакция дегидратации, гомогенная, каталитическая.
В. Реакция гидрирования, гетерогенная, каталитическая.


A. N. Б. N. В. О. Г. О.
5 (2 балла). Для увеличения скорости химической реакции в 32 раза (температурный коэффициент γ = 2) надо повысить температуру:
А. На 20 °С. Б. На 30 °С. В. На 40 °С. Г. На 50 °С.
6 (2 балла). Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой


A. Повышение температуры и давления. B. Понижение температуры и повышение давления.
Б. Понижение температуры и давления. Г. Повышение температуры и понижение давления.
7.(2 балла). Кислотную среду имеет раствор соли, формула которой:
А. ВаС12. Б. FeCl2. В. Na2SO3. Г. KNO3.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. SO32-, К+, SO42-, Н+. Б. Al3+, Na+, ОН-, С1-. B. . К+, Fe2+, ОН-, SO42-. Г. К+, Ва2+, ОН-, NO3-.
9 (2 балла). Для осуществления реакции, ионное уравнение которой СО32- + 2Н+ = Н2О + СО2
можно использовать раствор серной кислоты и вещество, формула которого:
А. СаСО3. Б. NaHCO3. В. Na2CO3. Г. MgCO3.
10 (2 балла). Гидролизу подвергается:
А. Глюкоза. Б. Глицерин. В. Жир. Г. Уксусная кислота.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1. Zn + 2HC1 = 3. Zn(OH)2 + 2HC1 =
2. ZnO + 2НС1 = 4. ZnCl2 + 4NaOH =
Правая часть краткого ионного уравнения: А. = Zn2+ + 2Н2О. Б. = Zn2+ + Н2О.

ЧАСТЬ Б. Задания со свободным ответом
12 (6 баллов). Составьте уравнение реакции разложения гидроксида железа (III). Дайте пол-
ную характеристику данной химической реакции по всем изученным классификационным
признакам.
13 (6 баллов). Какой объем оксида серы (IV) (н. у.) можно получить из 800 кг технической
серы, содержащей 10% примесей?
14 (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить сле-
дующие превращения: 1 2 3


Для перехода 2 составьте электронный баланс, укажите окислитель и восстановитель.
Химические реакции
Контрольная работа по химии для 11 класса по теме «Химические реакции»
Просмотр содержимого документа
«Химические реакции»
Контрольная работа №2 «Химические реакции»
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
1) N 0 2) H 0 3) H +1 4) N –3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость увеличится
1) в 3 раза 2) в 9 раз 3) в 27 раз 4) в 81 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции CaO(т)+CO2(г)↔CaCO3(т)+Q, в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. Наиболее сильной кислотой из перечисленных является:
А9. Осадок образуется при взаимодействии хлорида калия с:
А10. Гидролизу не подвергается:
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
Контрольная работа за 1 полугодие по химии (11 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Характеристика реакции, уравнение которой 4 Fe + 6 H 2 O +3 O 2 →4 Fe ( OH ) 3 :
а) соединения, ОВР, обратимая, б) замещения, ОВР, необратимая,
в) соединения, ОВР, необратимая, г) обмена, не ОВР, необратимая.
2. (2 балла). Количество тепловой энергии, которое выделяется или поглощается в ходе химической реакции, называется:
а) тепловым эффектом, б) энергией активации,
в) теплотой образования, г) температурным коэффициентом.
3. (2 балла). Фактор, не влияющий на скорость химической реакции: а) давление, б) катализатор, в) концентрации реагирующих веществ, г) форма сосуда, в котором протекает реакция.
4. (2 балла). При повышении температуры на 10 градусов (температурный коэффициент 2) скорость химической реакции увеличится: а) в 2 раза, б) в 4 раза, в) в 8 раз, г) в 16 раз.
5. (2 балла). Максимальная скорость химической реакции при взаимодействии веществ, формулы которых: А) Zn (гранулы) и HCl , Б) Zn (пыль) и HCl , В) Pb и HCl , Г) Fe и HCl
6. (2 балла). Краткому ионному уравнению СН 3 СОО — + Н + → СН 3 СООН соответствует взаимодействие между:
а) ацетатом магния и водой, б) ацетатом аммония и гидроксидом натрия,
в) ацетатом натрия и кремниевой кислотой, г) ацетатом калия и азотной кислотой.
7 . (2 балла). Окислитель в реакции синтеза аммиака, уравнение которой N 2 + 3 H 2 → 2 NH 3 +Q:
а) N 0 , б) H 0 , в) H +1 , г) N -3 .
8. (2 балла).Порядковый номер элемента в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоёв в атоме. Г. Числом нейтронов в атоме.
9.(2 балла). Элемент Э с электронной формулой 1s 2 2s 2 2p 6 3s 2 3p 3 образует высший оксид, соответствующий формуле: А. Э 2 О. Б. Э 2 О 3 . В. ЭО 2 Г. Э 2 О 5 .
10.(2 балла).Формула вещества с ковалентной полярной связью: а) Cl 2 ; б) KCl ; в) NH 3, г) O 2
11.(8 баллов).Установите соответствие между уравнением окислительно- восстановитель ной реакции и изменением степени окисления серы в ней.
ЧАСТЬ Б. Задания со свободным ответом.
12.(6 баллов). Составьте уравнение реакции взаимодействия магния с соляной кислотой. Дайте полную характеристику данной реакции по всем изученным признакам.
13.(6 баллов). Рассчитайте количество теплоты (в кДж), которую нужно затратить для получения 56 литров (н.у.) углекислого газа по реакции, протекающей в соответствии с термохимическим уравнением CaCO 3(тв.) = CaO (тв.) + CO 2(газ) – 180кДж
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Fe → FeCl 3 → Fe ( OH ) 3 → Fe 2 О 3
Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Характеристика реакции, уравнение которой 2 KClO 3 = 2 KCl + 3 O 2 :
а) замещения, ОВР, обратимая, б) разложения, ОВР, необратимая,
в) разложения, не ОВР, необратимая, г) обмена, не ОВР, необратимая.
2. (2 балла). Неверным является утверждение, что при протекании химической реакции:
а) сохраняется суммарная масса веществ, б) сохраняются молекулы веществ,
в) сохраняются атомы веществ, г) сохраняется суммарная энергия.
3. (2 балла). Фактор, не влияющий на скорость химической реакции: а) давление, б) катализатор, в) способ получения реагентов, г) температура
4. (2 балла). Для увеличения скорости химической реакции в 32 раза (температурный коэффициент равен 2) надо повысить температуру: а) на 30 0 С, б) на40 0 С, в) на 50 0 С, г) на 60 0 С .
5. (2 балла). Максимальная скорость химической реакции при взаимодействии веществ, формулы которых: а) С 2 Н 5 ОН (Ж) и О 2 , б) С 2 Н 5 ОН (г) и О 2 , в) N 2 и О 2 , г) CuO и H 2 SO 4.
6. (2 балла). Краткому ионному уравнению Ba 2+ + SO 4 2- = BaSO 4 соответствует взаимодействие c ерной кислоты и вещества:
а) бария, б) гидроксида бария,
в) нитрата бария, г) оксида бария.
7 . (2 балла). Восстановитель в реакции, уравнение которой 2СО + О 2 → 2СО 2 +Q:
а) С +2 , б) С +4 , в) О 0 , г) О -2 .
8. ( 2 балла ). Номер периода в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоёв в атоме. Г. Числом электронов в атоме.
9. ( 2 балла ). Элемент Э с электронной формулой 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4 s 2 4p 1 образует высший оксид, соответствующий формуле: А. Э 2 О. Б. Э 2 О 3 . В. ЭО 2 Г. Э 2 О 5 .
10. (2 балла). Формула вещества с ионной связью: А. НCl. Б. KBr. В. P 4 Г. CH 3 OH.
11.(8 баллов).Установите соответствие между уравнением окислительно- восстановитель ной реакции и изменением степени окисления серы в ней.
ЧАСТЬ Б. Задания со свободным ответом.
12.(6 баллов). Составьте уравнение реакции горения водорода. Дайте полную характерис- тику данной химической реакции по всем изученным классификационным признакам.
13(6 баллов). Рассчитайте количество теплоты (в кДж), необходимое для разложения 1.7 г.
нитрата серебра по реакции, протекающей в соответствии с термохимическим уравнением
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Cu → CuSO 4 → CuCl 2 → Cu ( OH ) 2
Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Реакция уравнение которой СН 4 + Cl 2 → C Н 3 Cl + HCl является:
а) замещения, гомогенной, б) замещения, экзотермической,
в) замещения, гетерогенной, г) обмена, каталитической.
2 . (2 балла). Формула вещества, которое можно взять для приготовления раствора, содержащего ионы SO 4 2- : a ) BaSO 4, б) K 2 SO 4, в) K 2 S , г) Na 2 SO 4.
3. (2 балла). Фактор, влияющий на скорость химической реакции:
а) катализатор, б)концентрация реагирующих веществ, в) природа реагирующих веществ,
г) тип кристаллической решетки реагирующих веществ.
4 . (2 балла). При повышении температуры на 30 0 С (температурный коэффициент γ = 3) скорость реакции увеличиться:
а) в 3 раза, б) в 9 раз, в) в 27 раз, г) в 81 раз.
5. (2 балла). С наименьшей скоростью при комнатной температуре протекает реакция между:
а) Fe и H 2 SO 4 , б) Cu и O 2 , в) AgNO 3 и NaCl , г) C 2 H 5 OH и Na .
6. (2 балла). Краткому ионному уравнению СО 3 2- +2Н + → Н 2 О + СО 2 соответствует взаимодействие между: а) CaO и HCl . б) CaCO 3 и HNO 3. в) Na 2 CO 3 и HCl . г) MgCO 3, CO 2 и H 2 O
7. (2 балла). Окислитель в реакции синтеза аммиака, уравнение которой: N 2 + 3 H 2 ↔ 2 NH 3 + Q:
а) N 0 , б) H 0 , в) H +1 , г) N -3 .
8. (2 балла).Номер группы (для элементов главных подгрупп) в Периодической системе определяет:
А. Число протонов в атоме. Б. Число электронов в наружном слое атома.
В. Число электронных слоёв в атоме. Г. Число нейтронов в атоме.
9. (2 балла). Элемент Э с электронной формулой 1s 2 2s 2 2p 6 3 s 2 3p 6 3d 10 4s 2 4p 3 образует высший оксид, соответствующий формуле: А. ЭО. Б. Э 2 О 3 . В. Э 2 О 5 Г. ЭО 3 .
10. (2 балла). Формула вещества с ковалентной неполярной связью:
А . MgCl 2 . Б . HF. В . N 2 Г . Al.
11.(8 баллов).Установите соответствие между уравнением окислительно- восстановитель ной реакции и изменением степени окисления серы в ней.
ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). В схеме химической реакции NH 4 NO 3 → H 2 О + N 2 + O 2 расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель. Дайте характеристику данной реакции по всем изученным классификационным признакам.
13(6 баллов). Рассчитайте количество теплоты (в кДж), необходимое для получения 200 г.
оксида магния по реакции, протекающей в соответствии с термохимическим уравнением
2 Mg (тв) + SiO 2(тв) =2 MgO (тв) + Si (тв) + 372 кДж
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Fe → FeCl 2 → Fe ( OH ) 2 → Fe ( OH ) 3
Для перехода 3 составьте электронный баланс, укажите окислитель и восстановитель.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Характеристика реакции, уравнение которой 3Н 2 + N 2 ↔ 2 N Н 3 :
а) соединения, ОВР, обратимая, б) замещения. ОВР, необратимая,
в) соединения, ОВР, необратимая, г) обмена, ОВР, необратимая.
2. (2 балла). Формула вещества, которое можно взять для приготовления раствора, содержащего ионы водорода Н + : a ) H 2 SiO 3, б) NaH в) HNO 3 г) NH 3
3. (2 балла). Фактор, не влияющий на скорость химической реакции: а) катализатор,
б) концентрация реагирующих веществ, в) природа реагирующих веществ, г) размер пробирки.
4. (2 балла). Для увеличения скорости химической реакции в 27 раз (температурный коэффициент равен 3) надо повысить температуру: а) на 30 0 С, б) на40 0 С, в) на 50 0 С, г) на 60 0 С .
5. (2 балла). Максимальная скорость химической реакции при взаимодействии веществ, формулы которых: а) H 2 и О 2 , б) S и О 2 , в) N 2 и О 2 , г) С 5 Н 12 и O 2
6. (2 балла). Краткому ионному уравнению 2 H + + SiO 3 2- → H 2 SiO 3 ↓ соответствует взаимодействие между: а) SiO 2 и H 2 O , б) Na 2 SiO 3 и HCl в) H 2 SO 4 и SiO 2 , г) CaSiO 3 и H 2 SO 4 .
7. (2 балла). Восстановитель в реакции, уравнение которой 2 KNO 3→2 KNO 2+ O 2:
a ) N +3 , б) N +5 , в) O 0 , г) O -2 .
8.(2 балла).Общее число электронов в атоме элемента определяют, используя Периодическую систему, по номеру: А. Группы. Б. Периода. В. Ряда. Г. Порядковому.
9 . (2 балла). Элемент Э с электронной формулой 1s 2 2s 2 2p 6 3 s 1 образует высший оксид, соответствующий формуле: А. Э 2 О. Б. Э 2 О 3 . В. ЭО 2 Г. ЭО 3 .
10.(2 балла). Вещество c ковалентной полярной связью: А. Фтороводород. Б. Хлор.
В. Пероксид натрия. Г. Фторид натрия.
11.(8 баллов).Установите соответствие между c хемой химической реакции и изменением степени окисления восстановителя в этой реакции.
ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). В схеме химической реакции H 2 O + С → СО + H 2 расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель. Дайте характеристику данной реакции по всем изученным классификационным признакам.
13(6 баллов). Рассчитайте объём кислорода, который необходимо затратить для получения 2111 кДж теплоты в соответствии с термохимическим уравнением
14. (10 баллов).Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Cr → CrCl 3 → Cr ( OH ) 3 → Cr 2 O 3. Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
http://multiurok.ru/files/khimicheskie-reaktsii-1.html
http://infourok.ru/kontrolnaya-rabota-za-polugodie-po-himii-klass-3450739.html