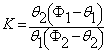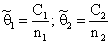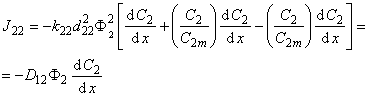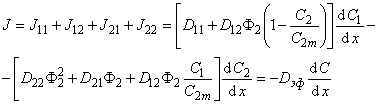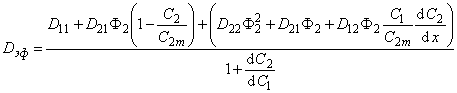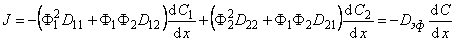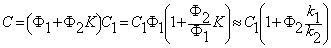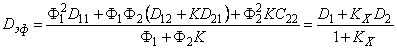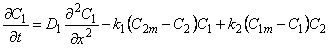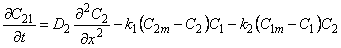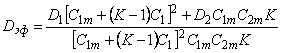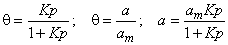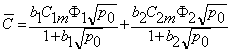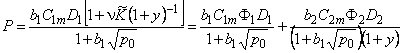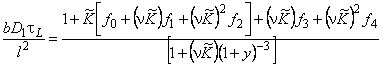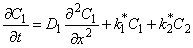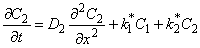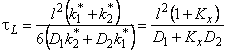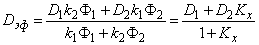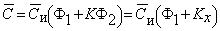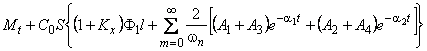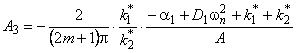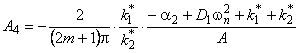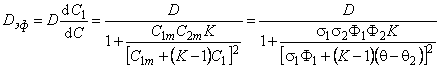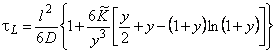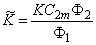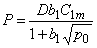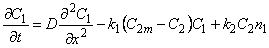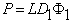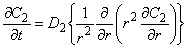Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
1 5 уравнений металл водород
АКАДЕМИЯ НАУК СССР
Программный комитет «Физика, химия и механика поверхности»
Институт физической химии АН СССР
ФИЗИКА, ХИМИЯ И МЕХАНИКА ПОВЕРХНОСТИ
ВЗАИМОДЕЙСТВИЕ ВОДОРОДА С МЕТАЛЛАМИ
Ответственный редактор
доктор физико-математических наук А. П. ЗАХАРОВ
Глава пятая
ФЕНОМЕНОЛОГИЧЕСКОЕ ОПИСАНИЕ ДИФФУЗИИ В ДЕФЕКТНЫХ СРЕДАХ
Введение
Хорошо известно, что водород, диффундирующий в кристаллической решетке металла, способен взаимодействовать с различного рода дефектами, содержащимися в реальных твердых телах [1]. Наличие подобных взаимодействий приводит к изменению значений определяемых экспериментально параметров растворения и диффузии, а также к появлению таких аномалий, как изменение формы кинетической кривой, зависимость эффективных коэффициентов диффузии от давления водорода, толщины образца, времени диффузионного эксперимента, изломы на аррениусовских зависимостях и т. п. Такие эффекты проявляются уже на чистых металлах, но особенно они заметны при введении примесей. Накопление водорода в дефектах металла вызывает значительное ухудшение эксплуатационных характеристик материала. В то же время, направленное введение ловушек является эффективным способом борьбы с водородной хрупкостью [2]. Поэтому изучение процессов взаимодействия водорода с несовершенствами структуры металла представляет большой практический интерес.
Реальные твердые тела никогда не обладают однородной структурой; обычно они содержат широкий набор дефектов как равновесных (вакансии, междоузлия), так и неравновесных (границы зерен, дислокации, включения инородных фаз и т. п.). Поэтому при создании даже простейшей теории диффузии в двухкомпонентной системе, содержащей лишь диффузионные пути и один тип дефектов, приходится учитывать плотность дефектов (точнее, распределение дефектов по толщине образца), энергетические характеристики (глубины потенциальных ям и высоты разделяющих их энергетических барьеров), геометрию и размеры дефектов, их пространственную ориентацию и т. п. В общем случае для описания гетерогенной структуры необходимо ввести функции распределения (по размерам кластеров дефектов, энергиям активации и т. п.). Кроме того, микроструктура существенным образом зависит от температуры эксперимента и может изменяться при внешних воздействиях (например, механической деформации) или в ходе твердофазных процессов (например, фазовых переходах). Очевидно, что диффузия в реальных материалах должна характеризоваться спектрами значений локальных коэффициентов диффузии и констант растворимости, зависящими от параметров взаимодействия водорода с конкретными типами неоднородности металла и от степени их доступности для диффузанта. Эти параметры, в свою «очередь, определяются размером и эффективным зарядом атома диффузанта. Важным обстоятельством является тот факт, что водород, растворяющийся в металле, существенным образом изменяет его микроструктуру.
Полное описание диффузии водорода в дефектных средах сводится к решению систем нелинейных дифференциальных уравнений с координатной, временной и концентрационной зависимостями параметров диффузии. Решение подобных задач представляет собой сложную проблему, и на практике ограничиваются построением простых математических моделей, учитывающих какие-либо характерные особенности структуры образца. Известны подходы, рассматривающие огибание диффузионным потоком отдельных препятствий; диффузию в микрогетерогенной среде, содержащей точечные дефекты; диффузию в дисперсных средах, составленных из включений определенных размеров и формы; диффузию по сети дефектов и др. В данной главе мы коротко рассмотрим некоторые из них.
1. Диффузия в микрогетерогенных средах
1.1. Константа равновесия
Рассмотрим диффузию водорода в среде, содержащей точечные неоднородности структуры, равномерно распределенные по объему материала. Водород может быть локализован в двух энергетических состояниях: в ненарушенной матрице металла (например, в междоузлиях) — состояние 1 или в дефектах (например, вакансиях) — состояние 2. Реакцию обмена атомами диффузанта между двумя типами потенциальных ям представим в виде
М(Н) + Д(0)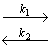
где М(Н) — атом водорода, расположенный в междоузлии; Д(0)—пустой дефект; Д(Н) — атом водорода в дефекте; М(0) — пустое междоузлие; k1 — константа скорости реакции перехода водорода из состояния 1 в состояние 2; k2 — константа скорости обратного перехода.
Введем обозначения: С1 и С2—концентрации водорода в состояниях 1 и 2 соответственно; n1 и n2 — концентрации соответствующих типов потенциальных ям; N1 и N2 — число состояний 1и 2 (N1 + N2 = N); q 1=C1/n; q 2=C2/n; q = q 1+ q 2; Ф1=N1/N; Ф2= N2/N (Ф1 + Ф2=1); d 4 и d 2 — емкости потенциальных ям типа 1 и 2 соответственно (т. е. число атомов, способных разместиться в яме конкретного типа); C1m= d 1n1 C2m= d 2n2 — максимальные емкости потенциальных ям типа 1 и 2.
Константа равновесия реакции (1)
К = С2(С1m – С1)/С1 (С2m — С2) = q 2 ( d 1Ф1— q 1)/ q 1 ( d 2Ф2 — q 2) =k1/k2
В частном случае, когда только один тип потенциальных ям (например, тип 2) обладает ограниченной емкостью (т. е. при c1 c1m= q 1n1):
K=C2 d 1/C1(C2m-C2).
Поскольку N1 @ N, то за константу равновесия можно принять [3, 4]
KM=K/ d 1n1=C2/C1(C2m—C2)=k1/k2 * .
Если оба типа потенциальных ям обладают неограниченной емкостью (т. е. при С1 q 2Ф1/ q 1Ф2=k1/k2 *
Кх = С2/С1 = k1/k2 * = KФ2Ф1
Замечание. Если ввести понятие относительной заселённости дефектов атомами водорода, 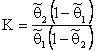
Константы, обозначенные символами К и Кx, безразмерны, КM имеет размерность, обратную концентрации.
1.2. Эффективный коэффициент диффузии
Рассмотрим феноменологическую теорию диффузии водорода в двухкомпонентной системе, представляющей собой дисперсию точечных дефектов в «идеальной» матрице. В такой системе возможны четыре типа диффузионных скачков (табл. 5.1).
Таблица 5.1. Обозначения, используемые при анализе диффузии в микрогетерогенных средах [5]
| Диффузионный скачок | Частота скачков | Величина скачка | Коэффициент диффузии | Частота колебаний | Энергия активации диффузии |
| M → M | k11 | d11 | D11 | v11 | E11 |
| М → Д | k12 | d12 | D12 | v12 | E12 |
| Д → М | k21 | D21 | D21 | V21 | E21 |
| Д → Д | k22 | D22 | D22 | V22 | E22 |
Пусть диффузионная среда представляет собой разбавленную дисперсию точечных дефектов ограниченной емкости [5]. Тогда в стационарном состоянии диффузии поток из одного междоузлия в другое (переход типа 1 → 1) J11 будет пропорционален вероятности скачка в данном направлении a 11 (для изотропной среды a =1/6), аналогично J21 пропорционален a 21. Для перехода типа 1 → 2 J12 определяется произведением вероятности нахождения дефекта в смежном положении с растворенным атомом водорода (комбинированная вероятность a 21Ф2) на вероятность того, что этот дефект окажется способным вместить прибывающий атом диффузанта (вероятность равна 1—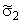
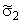
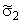
kll= n 11 a 11exp(—E11/T),
k 2 l= n 2 1 a 2 1exp(—E 2 1/T),
kl 2 = n 1 2 a 1 2 Ф2exp(—E1 2 /T),
k 22 = n 22 a 22 Ф2 2 exp(—E 22 /T),
Коэффициенты диффузии в заданном направлении равны:
D11 = d11 2 a 11 n 11 exp (- E11/RT),
D 2 1 = d 2 1 2 a 2 1 n 2 1 exp (- E 2 1/RT),
D1 2 = d1 2 2 a 1 2 Ф2 n 1 1 exp (- E1 2 /RT),
D 22 = d 22 2 a 22 Ф22 n 22 exp (- E 22 /RT),
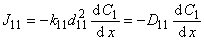
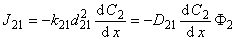

(5. 5 г)
Полный поток водорода в микрогетерогенной среде
Эффективный коэффициент диффузии
Из уравнения (5.2б) следует, что концентрация водорода в ловушках (в местоположениях типа 2) определяется выражением
С2=КMС2mС1/(1 + КMС1).
При С2 → С2m 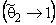
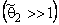
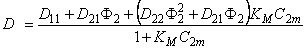
Пусть диффузионная среда представляет собой дисперсию точечных дефектов неограниченной емкости. Тогда поток в микрогетерогенной среде подобного типа
Средняя концентрация (растворимость) водорода в металле 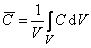
причем при наличии локального равновесия 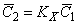
Эффективный коэффициент диффузии:
Из уравнения (5.9) следует, что Dэф сложным образом зависит от температуры и концентрации водорода, причем от концентрации зависит не только Dэф, но и составляющие его коэффициенты диффузии
D1=D11 + D12(1-С2/С2m)Ф2,
D2 = D22Ф22 + D21Ф2 + D12Ф2C1/C2m
При использовании выражения (5.9) следует учитывать, что во многих диффузионных методиках (особенно в методе проницаемости) существует значительный перепад концентраций по толщине образца. Ввиду сильной концентрационной зависимости D в подобных случаях приходится пользоваться интегральным коэффициентом диффузии:
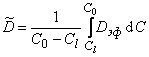
где С0 и Сl — концентрации водорода на входной и выходной сторонах мембраны соответственно.
В рассматриваемом нами случае
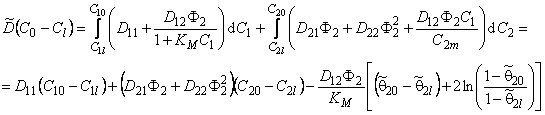
Анализ полученного выражения показывает, что при малых концентрациях 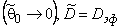
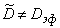
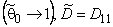
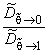
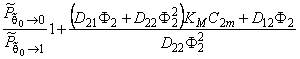
Выражение (5.16) на практике может быть использовано для оценки вклада D21, D22 и D12 в общий процесс переноса. Если эти вклады существенны, то константа проницаемости уменьшается по мере роста давления на входе в мембрану.
1.3. Миграция по нескольким взаимосвязанным каналам при ограниченной емкости всех каналов
Будем рассматривать диффузию по двум каналам, между которыми происходит обмен атомами диффузанта, формально описываемый кинетикой химической реакции 2-го порядка (т. е. будем полагать, что ограниченной емкостью обладают как диффузионные пути, так и ловушки). Данный подход может быть легко обобщен на случай диффузии по n каналам [6]. Для упрощения выкладок воспользуемся выражениями (13), но пренебрежем концентрационной зависимостью D1 и D2, т. е. будем считать D1 = D11Ф1 + D12 Ф2 и D2=D21Ф1 + D22Ф2 (см. уравнение (5.12)). Система дифференциальных уравнений, описывающая диффузию в среде подобного типа, имеет вид
При наличии локального равновесия можно по уравнению (2) ввести константу равновесия и, следовательно, эффективный коэффициент диффузии
Изотермы сорбции каждого вида определяются выражениями
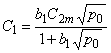
где b1 и b2 — параметры изотермы сорбции в состояниях 1 и 2 соответственно; р0 — парциальное давление водорода на входе в мембрану.
Замечание. В «классическом» случае недиссоциирующего газа изотерма Ленгмюра имеет вид:
Средняя концентрация водорода в металле
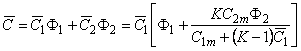
где 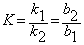
Время запаздывания в методе проницаемости (первый статистический момент от кривой «прорыва», m 1= t L) при обычных граничных условиях С(0, t)=C0, С(l, t)=0, C(x, 0)=0 определяется выражением
f0 = (6/y 3 )[y 2 /2+y-(l+y)ln(l+y)];
f1 = (6/y 3 )[y/2-3y/2(l+y)+ln(l+y)/(l+y)];
f2 = (6/y 3 )[y/6-1/2(1+y) + 1/2(1+y) 2 -1/6(1+у) 3 ];
f3 = (6/y 3 )[-3y/2+y/2(l+y) +(l+y)ln(l+y)];
f4 = (6/y 3 )[-1/2-1/2(l+y) 2 -ln(l+y)/y]
n = D2/D1; a = (K-l)/C1m; y= a C10 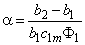
Из системы (5.17) и связанных с ней уравнений легко получить соответствующие выражения для многочисленных частных случаев.
При ограниченной емкости только одного канала (например, состояния 2) время запаздывания при проницаемости определяется уравнением (5.22), где 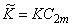
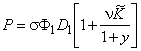
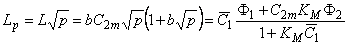
1.4. Многоканальная диффузия с обратимым обменом
Диффузия водорода по двум каналам, между которыми осуществляется обмен атомами диффузанта, формально описываемый кинетикой обратимой химической реакции 1-го порядка, обычно называют диссоциативной диффузией [7—9]. При условии неограниченной емкости как диффузионных путей, так и ловушек из уравнения (5.17) имеем
где D1 и D2 — коэффициенты диффузии по междоузлиям и вакансиям (или по ненарушенной решетке и сети дефектов) соответственно; k1 * = k1n2 — константа скорости перехода атома водорода из канала 1 в канал 2; k2 * = k2n1 — константа скорости обратного перехода.
В методе проницаемости зависимость потока водорода на выходе из мембраны от времени описывается формулой
J = J1 + J2,
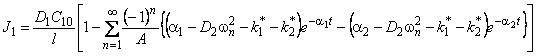
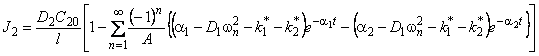
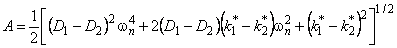
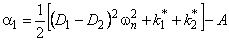
Отметим, что при D2=0 выражение (5.26) описывает кинетику водородопроницаемости среды, содержащей изолированные ловушки, при k2 * =0 — диффузию, сопровождающуюся необратимой химической реакцией 1-го порядка (постоянный захват). Если k1 * = k2 * =0, а D1 ¹ D2, то происходит параллельная диффузия по двум независимым каналам. Время запаздывания диффузии при проницаемости
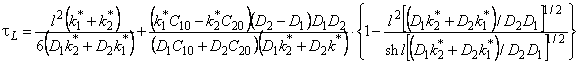
При наличии локального равновесия k1 * C1 = k2 * C2 и
Таким образом, по мере роста константы равновесия реакции обмена время запаздывания уменьшается, переходя от значения, характерного для фазы с низким коэффициентом диффузии, к значению, характерному для фазы с высоким коэффициентом диффузии. Отметим, что при малых значениях С20 невозможно обнаружить существование высокопроводящей фазы, тогда как присутствие медленного канала обнаруживается всегда. По-видимому, именно с этим обстоятельством связан тот факт, что экспериментально не всегда удается установить присутствие макродефектов, особенно в «быстрых» мембранах. Наблюдаемый эффект тем сильнее, чем меньше значение параметра k1.
При условии локального равновесия можно ввести понятие эффективного коэффицента диффузии
Очевидно, что в зависимости от отношения D1/D2 эффективный коэффициент диффузии может быть как меньше, так и больше коэффициента диффузии по идеальной решетке.
Температурная зависимость эффективного коэффициента диффузии описывается формулой
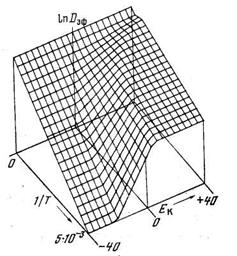
Рис. 5.1. Температурная зависимость эффективного коэффициента диффузии, рассчитанная в рамках модели диссоциативной диффузии при различных значениях энергии активации обратимого перехода из одного канала диффузии в другой
D10=10 -3 см2/с; ЕD1=10 ккал/моль;D20= =0,5 см 2 /с, ED2=4 ккал/моль, К0=10 -7
Средняя концентрация водорода в мембране
P=(D1+D2Kx)Ф1 s 1=D1 s 1Ф1=D2 s 2Ф2
В сорбционном методе количество водорода, поглощенное пластиной ко времени t, при наличии локального равновесия на входе описывается формулой [10, 11]
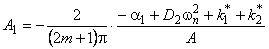
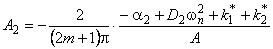
w n= (2m+1) p /l — толщина образца; S — площадь поверхности.
Поток водорода из пластины в ходе десорбции
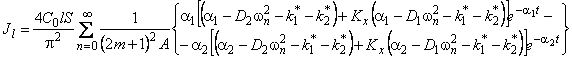
где C0 — начальная концентрация водорода в образце.
1.5. Диффузия с временным удержанием при ограниченной емкости как диффузионных путей, так и ловушек
Миграция водорода в среде, содержащей дисперсию точечных изолированных друг от друга дефектов (Dl = D, D2 = 0) при ограниченной емкости как диффузионных путей, так и дефектов (кинетика такого процесса формально описывается как диффузия при наличии обратимой химической реакции 2-го порядка), определяется системой уравнений
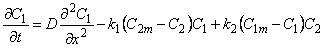
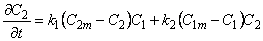
При наличии локального равновесия
где заселенность дефектов водородом найдем из уравнения (5.2), переписав его в виде
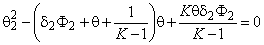
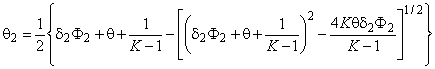
(5 . 37)
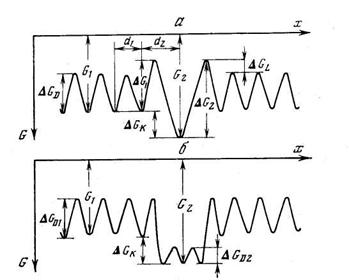
Из уравнения (5.37) следует, что в кристалле конечного размера число атомов водорода, оккупирующих один из двух типов потенциальных ям, при условии, что каждая яма способна вместить строго определенное количество атомов диффузанта, описывается распределением Ферми—Дирака. При низких температурах и низких концентрациях все атомы водорода сконденсированы на ловушках. По мере роста концентрации ловушки постепенно заполняются и после достижения условия q 2 = Ф2 заполняются только диффузионные пути (рис. 5.2, а). При увеличении температуры распределение Ферми—Дирака переходит в известное распределение Больцмана [12] (рис. 5.2, б). На рис. 5.3 представлена зависимость заселенности ловушек q 2 от концентрации водорода q (зависимость от Ф2 будет аналогичной) и от константы равновесия К (т. е. от температуры) при степени дефектности образца Ф2 = 0,1. Видно, что при высоких температурах (малых К) заселенность ловушек пропорциональна 0, а при низких температурах (больших К) q 2 — ступенчатая функция от концентрации.
а — низкие температуры (K=1000); б — высокие температуры (K=2)
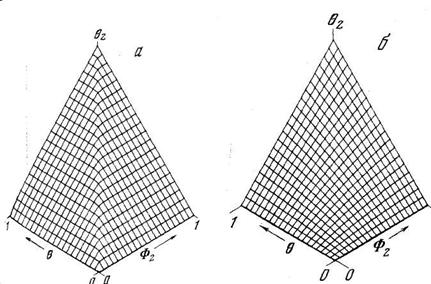
Уравнение (5.35) предсказывает концентрационную зависимость эффективного коэффициента диффузии водорода в дефектных средах, характеризующихся ограниченной емкостью ловушек и диффузионных путей. Так, при низких концентрациях ( q Ф2) основная часть атомов водорода сконденсирована на ловушках, Dэф мал и практически не зависит от концентрации; при q = Ф2 начинается перекачка атомов водорода в зону «проводимости» и Dэф возрастает по мере роста концентрации (рис. 5.4); при высоких концентрациях Dэф @ D и не зависит от концентрации. Чем ниже температура эксперимента, тем сильнее проявляется концентрационная зависимость коэффициента диффузии. Формально рассчитанная энергия активации диффузии также зависит от концентрации водорода.
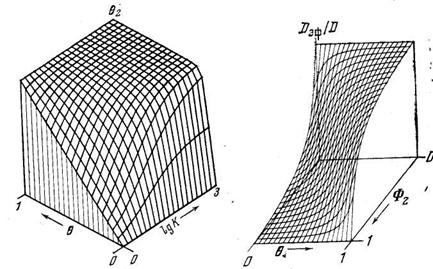
Рис. 5.4. Зависимость эффективного коэффициента диффузии в дефектной среде при ограниченной емкости ловушек от концентрации дефектов и общей концентрации водорода при К=10
Растворимость водорода в металле определяется уравнением (5.20). Время запаздывания при проницаемости в рамках данной модели определяется выражением [6]
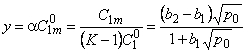
Коротко остановимся на рассмотрении диффузии водорода в дефектной среде подобного типа при отсутствии локального равновесия. Поскольку система (5.34) является нелинейной, то ее решение возможно только численными методами. Расчеты показывают, что диффузия при наличии химической реакции 2-го порядка приводит к возникновению выпуклых концентрационных профилей (рис. 5.5), причем, чем выше концентрация диффузанта, тем сильнее искажается его форма (при больших концентрациях фронт имеет форму ступеньки).
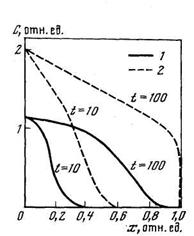
Относительная емкость ловушек s 2Ф2=1; К=100; D/l2=0,01 с -1 . 1 — Свх =1,2; 2 — Свх =2. Свх — концентрация диффузанта на входе в мембрану
s 2Ф2=1; K=100; D/l2=0,01 с -1 . 1 — «классическая» диффузия без захвата; 2 — Свх=1,2; 3—1.6; 4—1,8; 5 — 2,0; 6 — Свх =3,0. а — обыкновенный масштаб; б — функциональный масштаб
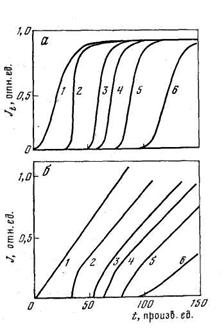
Наличие захвата изменяет форму кинетических кривых диффузии. На рис. 5.6, а приведены кривые проницаемости, рассчитанные при тех же значениях параметров диффузии и захвата, что и кривые на рис. 5.5. Видно, что по сравнению с «классической» диффузией появление водорода на выходной поверхности мембраны значительно запаздывает, а затем происходит быстрое достижение стационарного состояния. Особенности кинетики диффузии в дефектных средах хорошо заметны при построении кривых проницаемости в функциональном масштабе (рис. 5.6, б), в котором классическая диффузия имеет вид прямой, выходящей из начала координат. Расчеты показывают, что в рамках данной модели кривые «прорыва» и «откачки» в методе проницаемости, кривые сорбции и десорбции не совпадают друг с другом (сорбция опережает десорбцию). На форму кинетических кривых существенное влияние оказывает функция распределения дефектов по толщине мембраны [13].
Если ограниченной емкостью обладают только дефекты, то [14—17]
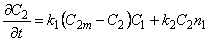
(5 . 41)
где 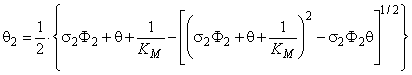
Растворимость водорода в дефектном металле описывается уравнением (5.24).
Время запаздывания при проницаемости определяется формулой (5.38) при условии, что 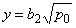
Константа проницаемости:
1.6. Диффузия с обратимым захватом
Рассмотрим диффузию водорода в твердом теле, содержащем дефекты (ловушки), взаимодействующие с диффундирующим веществом. Эти ловушки улавливают диффундирующие атомы и либо некоторое время препятствуют их диффузии (временное удержание), либо вообще выводят водород из миграционного процесса (постоянное удержание). При увеличении емкости изолированных друг от друга ловушек ( s 2 → ∞ ) (или при увеличении концентрации ловушек (n2 → ∞ ) что, по-видимому, физически менее реалистично) система (5.40) переходит в систему уравнений диффузии при наличии взаимодействия, формально описываемого кинетикой обратимой химической реакции 1-го порядка:
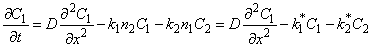
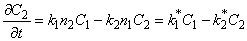
При наличии локального равновесия
Dэф = D/(l + KФ2/Ф1)= D/(l + Kx).
Эффективная растворимость определяется формулой (5.29).
Обратимый захват уменьшает величину стационарного потока водорода через мембрану в методе проницаемости (Pэф/P=Ф1), но увеличивает время запаздывания t L = l 2 (l + Kx/6D).
Как уже неоднократно отмечалось, наличие процессов взаимодействия водорода с дефектами приводит к сложной температурной зависимости Dэф и 
Коэффициент диффузии увеличивается с температурой по закону Аррениуса:
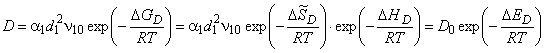
где D GD — свободная энергия миграции атома водорода по идеальной решетке металла; D G = D H—TSD; D H=pV+E — энтальпия активации диффузии; р — давление; V — объем; 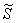
Поскольку ловушка обычно глубже диффузионного пути, то константа равновесия реакции захвата убывает с ростом температуры:
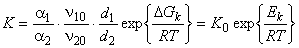
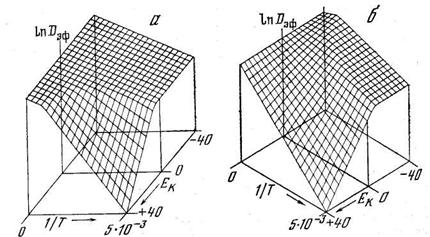
Поэтому даже при постоянном значении s 2Ф2 на графике зависимости ln Dэф—1/T появляется излом: в низкотемпературной области энергия активации выше (Еэф=ЕD+ЕK), чем в высокотемпературной (Еэф @ ЕD) (рис. 5.8, а), т. е. аномалии, связанные с захватом, убывают по мере роста температуры. Если Ф2 — возрастающая функция (роль ловушек играют термические вакансии):
Ф2 = Ф20ехр(-EF/RT),
где EF — энергия активации образования вакансии, то
KX= (Ф2/Ф1)K=KX0 ехр( D Н/RT),
Если ЕF>ЕK, то Dэф сначала будет увеличиваться по мере роста температуры, а затем уменьшаться. В результате на зависимости Dэф—1/Т будут наблюдаться максимумы (см. рис. 5.8б).
Рассмотрим теперь кинетику нестационарной диффузии водорода в металлах при наличии временного удержания диффузанта в ловушках. В методе проницаемости зависимость потока водорода через мембрану от времени описывается выражением
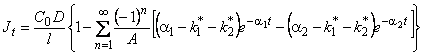 , , | (5.48) |
На рис. 5.9 приведены кривые проницаемости, рассчитанные по уравнению (5.48), для различных значений параметров k1 * , k2 * и К. Видно, что, как и в случае ограниченной емкости ловушек, происходит запаздывание проницаемости по сравнению с диффузией в идеальной среде. Кроме того, возможно появление кривых, крайне медленно стремящихся к стационарному значению (для его достижения иногда требуются сотни времен t L, тогда как для классической диффузии достаточно 2—3 t L).
Для характеристики влияния захвата на форму кинетической кривой диффузии воспользуемся методом моментов: k-й начальный момент рассчитаем по формуле 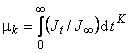
Из приведенных формул следует, что по мере увеличения константы захвата KX время запаздывания увеличивается, кривая уширяется и принимает более асимметричную форму (за счет появления длинного «хвоста»), t L зависит только от КX, но дисперсия и асимметрия зависят уже и от k1 * и от k2 * . Метод моментов дает простой способ расчета параметров D, KX, k1 * и k2 * ; определив m k из кинетической кривой проницаемости (например, путем измерения площади, заключенной между прямой J ∞ и кривой J(tk) и переходя к центральным моментам по обычным формулам математической статистики, найдем все интересующие нас величины.
В сорбционном методе количество водорода, поглощенное дефектной пластиной к моменту времени t, равно
 , , | (5.49) |
где w m = (2m +1) p /l. В десорбционном методе зависимость потока газовыделения от времени
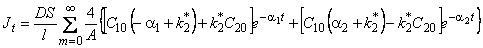 , , | (5.50) |
где w m = (2m+ 1) p /l; C10, C20 — начальные концентрации водорода в подвижной и неподвижной формах соответственно.
В методе термостимулированного газовыделения изучается кинетика выделения водорода из образца в режиме программированного (как правило, линейного) нагревания. Типичные термодесорбционные спектры для образцов с различным начальным заполнением ловушек приведены на рис. 5.10. Видно, что при С10 = 1 или С20=1 кривые выделения водорода при линейном нагревании, как и в случае классической диффузии, характеризуются асимметричным пиком с крутым задним фронтом. Однако температуры максимумов, а следовательно, и рассчитанные из экспериментальных данных энергии активации диффузии существенно различны. При промежуточных значениях С10 и С20 термодесорбционные спектры имеют бимодальную структуру.
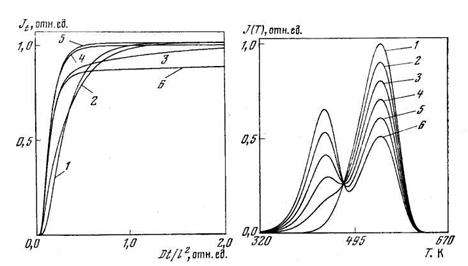
D/l 2 =l. K=1: J — k1 = k2= 100; 2 — 10; 3 — 1; 4 — 0,1; 5 — классическая диффузия; 6 — K=10; k1=l; k2=0,1
Рис. 5.10. Термостимулированное выделение водорода из пластины в ходе линейного нагревания в зависимости от начальной заселенности ловушек (модель временного удержания при неограниченной емкости ловушек) 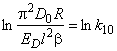
1 — С10=0, С20=1,0; 2 — 0,2, 0,8; 3 — 0,4; 0,6; 4 — 0,6, 0,4; 5 — 0,8, 0,2; 6— С10=1,0, С20=О
1.7. Диффузия при наличии постоянного захвата
Пусть атом водорода, мигрирующий через вещество в ходе случайного блуждания, необратимо захватывается дефектом и тем самым выводится из диффузионного процесса. Диффузия с постоянным удержанием в ловушках описывается решением дифференциального уравнения массопереноса с учетом необратимой химической реакции 1-го порядка:
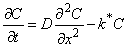 , , | (5.51) |
где k * — константа скорости захвата водорода дефектами.
В методе проницаемости зависимость потока водорода от времени [18] определяется выражением
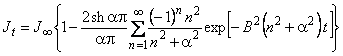 , , | (5.52) |
где B = p 2 D/l; 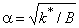
Стационарный поток водородопроницаемости равен
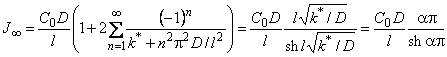 | (5.53) |
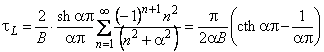 | (5.54) |
Анализ полученных выражений показывает, что по мере увеличения интенсивности взаимодействия водорода с дефектами (т. е. при возрастании константы скорости реакции k*) значения стационарного потока и времени запаздывания уменьшаются. Химическая реакция искажает и форму кинетической кривой проницаемости: если при малых временах перенос описывается классическим законом диффузии Фика, то после точки перегиба наблюдается более крутой подъем и кривая быстрее достигает стационарного значения (которое ниже классического). По мере роста k * симметрия кривой сначала увеличивается, а затем уменьшается, но в противоположную сторону.
В сорбционном методе активные ловушки, необратимо поглощающие водород, существенно влияют на кинетику сорбции водорода металлом, причем дефектная среда поглощает большее количество диффузанта, чем «идеальная». Более того, если в случае миграции, подчиняющейся классическим законам диффузии, количество водорода в образце при больших временах стремится к постоянному пределу М ∞ то при наличии ловушек постоянного удержания Mt = f(t) и при t →∞ линейно увеличивается во времени.
Кинетика сорбции описывается уравнением
 , , | (5 55) |
где u = p D(2m+1) 2 /l 2 .
В десорбционном методе зависимость потока водорода из дефектной пластины от времени имеет вид
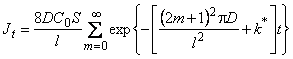 , , | (5.56) |
т. е. газовыделение из дефектного образца заканчивается быстрее, чем из идеального. Несовпадение кинетики сорбции и десорбции является одним из основных критериальных признаков наличия в металле ловушек водорода.
Если концентрация ловушек постоянного захвата сравнима с концентрацией водорода в металле, то имеет место механизм переноса, формально описываемый как диффузия при наличии необратимой химической реакции 2-го порядка (на практике модель, учитывающая ограниченную емкость ловушек, встречается при описании некоторых процессов гидридообразования в ходе диффузии). В этом случае профиль концентрации водорода становится выпуклым, причем в стационарном состоянии проницаемости количество водорода в металле будет превышать значение 0,5 от количества водорода, поглощенного той же мембраной в сорбционном методе (классическая теория предсказывает M( ∞ )прон = 0,5 M( ∞ )сорб, стремясь к M( ∞ )прон = M( ∞ )сорб при больших значениях константы скорости взаимодействия водорода с дефектами металла). При большой интенсивности захвата в мембране образуется ступенчатый фронт концентрации, граница которого перемещается по мембране в ходе диффузионного процесса: поток на выходе длительное время отсутствует, а затем сразу достигается стационарное состояние проницаемости.
2. Диффузия в диперсионных средах
Модель диффузии в дисперсионных средах учитывает влияние геометрической формы и размеров дефектов на процессы массопереноса. Под дефектами в широком смысле понимают любые неоднородности структуры металла: газовые пузырьки, включения инородных фаз, наполнители и т. п.
2.1. Кинетика диффузии
Пусть включения инородных фаз имеют размеры значительно меньшие, чем толщина образца, и диффузия в дефекты сферически симметрична. На границе дефекта существует локальное равновесие. Включение действует как сток, причем по мере заполнения ловушки ее эффективность падает. Система уравнений для диффузии в пластине толщиной l=2h, содержащей включения сферической формы радиуса r0, имеет вид [19]
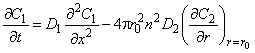 , , | (5.57) |
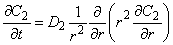 , , | (5.57б) |
| С2 = КС1, | (5.57в) |
где С1, С2 — концентрации водорода в матрице и во включении; D1, D2 — коэффициенты диффузии в дисперсионной среде и дисперсной фазе соответственно; К— локальная растворимость во включении (отношение константы растворимости водорода в «дефектной» области к константе растворимости в матрице); n2 — плотность включений.
Кинетика водородопроницаемости описывается формулой
 , , | (5.58) |
где x mn определяется решением уравнения
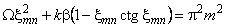 . . | (5.59) |
Выражение (5.58) имеет достаточно сложный вид: оно содержит двойную сумму, причем для определения декрементов затухания необходимо решить трансцендентное уравнение. Поэтому для обработки результатов большее распространение получил метод моментов. Например, в методе проницаемости
t L = m 1 = T/6, m 2 = 7T 2 /180 + TT2K * /45 (1 + К * ),
m 3 = 31T 3 /2520 + 7 T 2 Т2К * /450 (1 + K * ) + 2ТТ2 2 К * /315(1 +К * ),
где T=(1 + K * )l2/D1; T2=r0 2 /D2; K * = e k.
Зная толщину мембраны и измерив три первых момента от кинетической кривой проницаемости, можно найти параметры D1, К * и T2. Для раздельного определения радиуса включения r0 и коэффициента диффузии в нем D2 какую-то из этих величин необходимо получить в отдельных экспериментах. Отметим, что в методе проницаемости значение первого момента не зависит ни от размеров, ни от геометрии включения. В формуле для второго момента геометрический фактор формально появляется, но играет роль константы k2 в рассмотренной ранее модели диффузии с обратимым захватом. Поэтому по первым двум моментам рассматриваемую модель невозможно отличить от модели диффузии с временным удержанием. Лишь высшие моменты зависят от формы включения. Для расчета D1 и D2 по методу моментов приходится использовать высшие моменты, отягощенные большими ошибками, либо проводить измерения на образцах различной толщины.
Аналогичный способ применим и для описания водородопроницаемости мембран, содержащих включения различной формы. Например, если включения представляют собой пластины толщиной l = 2h (цилиндры или призмы с непроницаемой боковой поверхностью), то
m 1= T/6, m 2 = 7T 2 /180 + TТ2K * /9(1+K * ),
m 3 = 31T 3 /2520 + 7T 2 T2K * /90(1 + K * )+2TТ2 2 K * /15(1 + K * ).
Если включения представляют собой цилиндры радиуса г„ с непроницаемыми торцами, то
m 1= T/6, m 2 = 7T 2 /180 + TТ2K * / 24 (1+K * ),
m 3 = 31T 3 /2520 + 7T 2 T2K * / 24 0(1 + K * )+2TТ2 2 K * / 48 (1 + K * ).
Как следует из приведенных выражений, геометрическая форма включений играет роль, начиная со второго момента.
В сорбционном методе количество вещества, поглощенное пластиной, содержащей сферические включения, к моменту времени t равно
 | (5.60) |
Поток водорода из образца в десорбционном методе
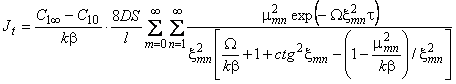 | (5.61) |
Начальные моменты для кривых сорбции (или десорбции) [20]
m 1= T/ 3 + T2K * /15(l + K * ),
m 2 = 4 2 /15 + 4TT2K * /45(1 + K * )+4T2 2 K * /315(1 + K * ).
Из приведенных формул видно, что сорбционный и десорбционный методы более чувствительны к геометрической форме включения, чем метод проницаемости: параметры геометрической формы входят уже в формулы для первого момента.
2.2. Обтекание диффузионным потоком отдельных препятствий
До сих пор мы предполагали, что дефекты в ходе сорбции и проницаемости функционируют как стоки, улавливающие водород (рассмотренная выше модель справедлива только при условии D2 D1) и уменьшающие эффективный коэффициент диффузии. Между тем очевидно, что при D2 D1 (как это справедливо, например, для микропор) включения инородных фаз могут действовать не только как ловушки, но и как пути диффузии, увеличивающие скорость переноса через мембрану (за счет уменьшения эффективной толщины образца). Поэтому возникает необходимость разработки общей теории диффузии в дисперсионных средах. С этой целью сначала рассчитаем концентрационные профили водорода, возникающие при обтекании стационарным диффузионным потоком препятствий различной формы.
Пусть круглый бесконечный цилиндр (например, дислокация) радиуса r0 с коэффициентом диффузии D2 и константой растворимости L2 находится в бесконечной однородной среде с коэффициентом диффузии D1 и константой растворимости L1, через которую проходит стационарный диффузионный поток с плотностью потока J (ось цилиндра направлена перпендикулярно потоку). Решение будем искать в цилиндрической системе координат (r, j , z), записав уравнение Лапласа в виде
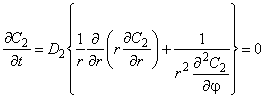
Используем условия на границе включения: С2 = KС1|r=rо, j =war (K=L2/L1) и D1(dC1/dr) = D2(dC2/dr) —и условия для вмещающей среды: С=-(Jr/D)cos j =Си (в бесконечности поле однородно) и С(0)= ∞ , где Си — концентрация водорода в «идеальной» среде с коэффициентом диффузии D1. Распределение концентрации в пространстве вне цилиндра: C1 = Cи(x) +C2 * (r), внутри цилиндра: С2 = Си(х) +С2 * (r), где С1 * и С2 * определяют искажающее действие включения.
Возмущение концентрации вне цилиндра
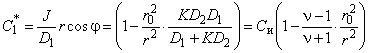 , , | (5.62а) |
Возмущение концентрации внутри цилиндра
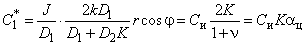 | (5.62б) |
Если включение инородной фазы непроницаемо, то С1 = Си(1+r0 2 /r 2 ).
Из последнего выражения следует, что цилиндрическое включение сказывается (с точностью до 5%) на распределении концентрации до расстояния, в 2,25 раза превышающего его диаметр.
Аналогично для включения в форме шара уравнение
с граничными условиями на включении: C2 = KC1|r=r0;
Соответствующие возмущения концентраций
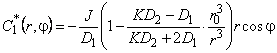 | (5.63а) |
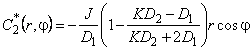 | (5.63б) |
В методе проницаемости стационарное распределение концентрации водорода по толщине мембраны, содержащей отдельное включение в форме шара, центр которого располагается на глубине h от входной поверхности мембраны, определяется формулами
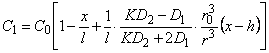 , , | (5.64а) |
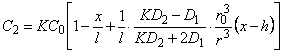 | (5.64б) |
где r= (x 2 + y 2 + z 2 + h 2 —2hx) 1\2
Эти выражения используются при обработке результатов экспериментов по изучению диффузии трития в металлах, полученных методом продольного среза и техникой авторадиографии.
2.3. Эффективный коэффициент диффузии в среде дисперсионного типа
Введем понятие эффективного коэффициента диффузии в среде, представляющей собой дисперсию включений определенной формы в непрерывной матрице металла. Пусть размеры неоднородностей структуры значительно меньше толщины образца. На первом этапе рассмотрим разбавленные суспензии со случайным распределением дефектов, а затем перейдем к концентрированным и упорядоченным композитным материалам [21].
Для определенности сначала будем полагать, что включения имеют сферическую форму (радиус r0). При наличии локального равновесия на входе во включение стационарный поток через мембрану, содержащую дисперсию включений, определяется первым законом Фика, записанным в виде
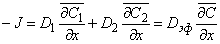 | (5.65) |
Тогда эффективный коэффициент диффузии
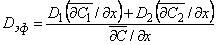 | (5.66) |
с учетом уравнения (5.63б) имеем (см., например, [21])
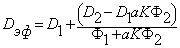 | (5.67) |
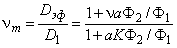 | (5.68) |
Полученные выражения описывают диффузию в дисперсионных средах, содержащих включения различной формы. Действительно, a = 3/(2+ n ) для сфер, a = 2/(l+ n ) для цилиндров (перпендикулярных потоку); при параллельной диффузии аК=1 и n m=l+vФ2/Ф1; при последовательной диффузии (слойка) n m = n /( n Ф1 + Ф2); при диффузии с обратимым захватом в ловушках n m=l/(l+ZKФ2/Ф1), где Z — координационное число, зависящее от типа кристаллической решетки; при диссоциативной диффузии (а=1) n m=(1+ n Ф2/Ф1)/(1+KФ2/Ф1).
Если включения имеют форму сфероидов с осями а0, b0, с0, (сфероиды распределены и ориентированы случайным образом),. то
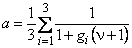 | (5.69) |
где 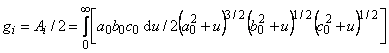
| ga0+gb0+gc0=l. | (5.70) |
Из выражения (5.70) можно получить все приведенные выше формулы для различных типов гетерогенных сред. Для практических целей удобно использовать табл. 5.2.
Введение функции a(v) позволило нам в рамках единого подхода обобщить различные случаи диффузии в гетерогенных средах: параллельную диффузию по независимым каналам, диффузию с захватом в ловушках, диссоциативную диффузию, диффузию в среде, содержащей отдельные включения или дисперсию включений различной формы и ориентации, последовательную диффузию в слоистой среде и др. При соответствующем выборе функции а( n ) можно найти эффективный коэффициент диффузии в неоднородной среде любого типа.
Таблица 5.2. Значения параметров геометрической формы в уравнении (5.70)
| Ai | Шар | Игла (вдоль потока) | Пластина (перпендик. потоку) | Цилиндр (перпендик. потоку) | Сфероид*) (a0, b0=c0) |
| А1 | 2/3 | 1 | 0 | 1 | Al ‘ |
| А2 | 2/3 | 1 | 0 | 1 | A2 ‘ |
| А3 | 2/3 | 0 | 2 | 1 | Al ‘ |
*) A1‘=[( W —1/2 sin 2 W /sin 3 W ] cos W , где cos W = a0/b0, а0 b0
A2‘=(l/sin 2 W *) – 1/2 (cos 2 W * /sin 3 W * ) ln [(l+sin W * )/(l — sin W * )], где cos W * = b0/a0, а0 >D1 .
Если D1D2 (т. е. включение непроницаемо), то
тде а= 1,5 для сферических включений, а = 2 для цилиндрических, а = ∞ для пластин (слойка) и т. п. Для случая D1>>D2 (если К не слишком велико) известны асимптоты: n m @ l-1,5КФ2/Ф1 для сфер, n m @ l-2КФ2/Ф1 для цилиндров, n m @ l-КФ2/Ф1 для игл, направленных вдоль потока (диссоциативная диффузия) и др.
Если D1>>D2 (поры) и К не слишком мало, асимптотой для сферических микропор будет n m @ l+3КФ2/Ф1.
Приведенный выше подход можно легко обобщить на случай диффузии водорода в n-компонентной среде, каждая фаза которой характеризуется объемной долей Фi, коэффициентом диффузии Di, константой растворимости Li и параметром геометрической формы ai. Тогда
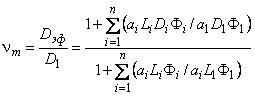 | (5span lang=»en-us»>. 71) |
где индекс 1 относится к компоненту, образующему сплошную фазу (т. е. фазу со значением ai=l).
Анализ приведенных выражений показывает, что при постоянной объемной концентрации включений инородных фаз эффективный коэффициент диффузии водорода не зависит от размеров включений и почти не зависит от их формы, когда разность между D1 и D2 не очень велика.
До сих пор мы рассматривали разбавленные суспензии (Ф2 a = 0,523 для простой кубической упаковки (формула (5.72) справедлива до Ф2
/6 @ 0,52); a = 0,129 для ОЦК-упаковки и a = 0,0752 для ГЦК-упаковки.
Аналогично для кубической решетки, составленной из цилиндров, параллельных друг другу и расположенных перпендикулярно к направлению потока
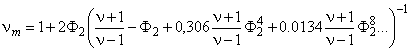 , , | (5.73) |
В общем случае решение задачи диффузии в «концентрированной» дисперсии (состоящей из кластеров случайным образом: распределенных включений произвольных формы и размера) представляет собой серьезную проблему. При больших значениях Ф2 уже нельзя полагать, что среда характеризуется коэффициентом диффузии D1 = Dи и средней концентрацией 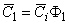
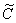
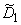
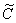
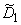
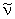
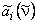
Если ввести 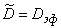
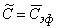
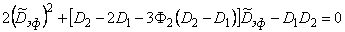 , , | (5.74) |
 | (5.74а) |
Аналогичное выражение получается и из теории перколяции.
Если среда представляет собой чередующиеся сферы с D1 и D2 то эффективный коэффициент диффузии определяется решением уравнения
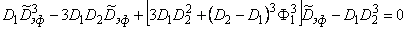 | (5.75) |
(В формулах (5.74), (5.75) мы полагали K=1.)
Отметим, что все подходы при D2 D1 дают совпадающие значения Dэф, но при D2>D1 (поры) введение различных приближений (и рассмотрение различных типов микроструктуры) приводит к существенным расхождениям в значениях Dэф. Особенно это заметно при переходе от одной непрерывной фазы к другой. Выражение (5.74а) можно рекомендовать для описания диффузии в сплавах, так как оно применимо для всего интервала значений Ф2: 0 ≤ Ф2 ≤ 1.
3. Следствия теории диффузии в дефектных средах и их экспериментальная проверка
Математический аппарат диффузии в дефектных средах позволяет установить ряд критериальных признаков данного класса моделей и сравнить их с имеющимися экспериментальными данными по диффузии водорода в металлах.
Проведенный выше анализ предсказывает высокую чувствительность растворимости и диффузии водорода к структурным неоднородностям материала. При этом параметры газопереноса должны отражать не столько свойства самого металла, сколько особенности микроструктуры, возникшие в ходе термической или механической обработки образца. Это обстоятельство, в свою очередь, может привести к сильному разбросу результатов измерений. Действительно, между данными различных авторов о поведении водорода даже в чистых металлах обнаруживаются существенные расхождения, далеко превосходящие ошибки экспериментальных исследований [1, 2, 22], особенно при пониженных температурах, где и ожидалось повышение активности ловушек.
Накопление газообразных примесей — одно из основных свойств ловушек — должно приводить к возникновению локальных неоднородностей в распределении водорода в дефектном металле. Прямые эксперименты, проведенные методом авторадиографии с использованием радиоактивного изотопа — трития — на металлах с различной атомной структурой (титан, никель, ниобий [23] и алюминий [24]), а также в сплавах на основе железа, никеля и особенно титана, подтвердили наличие тесной связи между тонкой структурой металла и картиной распределения водорода, атомы которого сегрегируют на дислокациях и субграницах зерен. В алюминии и некоторых других металлах водород концентрируется на границах зерен. Следует отметить, что не во всех металлах дефекты действуют как ловушки. Например, в таких металлах, как медь и палладий, скоплений водорода не наблюдалось.
Наличие процессов взаимодействия водорода с несовершенствами структуры металла, как правило (если не происходит облегченной диффузии по самим дефектам), приводит к уменьшению коэффициента диффузии. Эти следствия теории неоднократно подтверждались на практике (см., например, работы [1, 2, 14—16], в которых концентрацию ловушек изменяли с помощью термического отжига, зонной плавки, механической обработки, деформации, ионной бомбардировки, введением примесей замещения и т. п.).
Из теоретических предпосылок ожидали, что отношение количества водорода, находящегося в пластине при стационарном состоянии проницаемости Mпрон, к количеству водорода, находящемуся в том же образце при равномерном двустороннем насыщении Мсорб, должно находиться в интервале 0,5 ≤ Mпрон/ Мсорб ≤ 0,85 в зависимости от величины С0, т. е. от парциального давления водорода. Эксперименты подтвердили эти предсказания [1].
Из феноменологической теории диффузии в дефектных средах следует, что если емкость диффузионных путей и ловушек неограниченна, то эффективные коэффициенты переноса не зависят от концентрации (т. е. от парциального давления на входе в образец) водорода. При ограниченной емкости ловушек (и/или диффузионных путей) эффективный коэффициент диффузии и константа растворимости зависят от концентрации водорода, причем эти зависимости близки к ступенчатой функции. В ряде работ подтверждена теоретически предсказанная асимметрия кривых сорбции и десорбции, а также кривых «прорыва» и «откачки» в методе проницаемости: скорость насыщения металлического образца водородом, как правило, выше скорости дегазации [13].
Часто полагают, что природу взаимодействия между атомами примеси и решеткой твердого тела лучше всего исследовать в области малых концентраций растворенного вещества, так как в этом случае можно пренебречь взаимодействием между атомами диффузанта. Однако если концентрация водорода настолько низка, что сравнима с концентрацией ловушек, то термодинамические измерения будут отражать не особенности взаимодействия примесных атомов с решеткой твердого тела, а особенности взаимодействия водорода с дефектами. Наиболее явно это проявляется в области низких температур, так как доля атомов растворенного вещества, взаимодействующих с дефектами решетки, увеличивается по мере уменьшения температуры.
Если растворимость примеси уменьшается с температурой, то предельная концентрация, начиная с которой термодинамическое поведение водорода определяется взаимодействием с дефектами, а не с решеткой, достигается еще скорее. В работе [25] продемонстрировано хорошее согласие этого следствия теории с экспериментом: если диффузия водорода в палладии (измеренная электрохимическим вариантом метода проницаемости) не зависит от концентрации водорода, то в деформированном на холоду на 50% палладии в интервале концентраций q =10 -4 ÷ 10 -5 (т. е. в условиях, когда q@ Ф2) происходит резкое падение коэффициента диффузии.
Одним из следствий модели диффузии в дефектных средах является предсказание существования, помимо «ловушек», сильно уменьшающих Dэф, «антиловушек», способных увеличивать Dэф. Экспериментальную проверку этого утверждения проводили на примере диффузии водорода в палладии, легированном различными примесями замещения [26, 27]. Обнаружено, что если примеси Nb, Y и Ti сильно тормозят диффузию, то примеси Fe, Со, Mn, Сг и Ni не слишком значительно уменьшают скорость переноса. Еще слабее сказывается введение примеси Сu Dэф уменьшается при концентрации Сu 13 ат.%) и Ag (Ag практически не влияет на диффузию водорода в палладии вплоть до 25 ат.%). Аu начиная с 3 ат.% несколько увеличивает Dэф. Так как в меди, серебре и золоте энтальпия растворения много меньше (отрицательна), чем в чистом палладии, то благородные металлы в палладии играют роль «антиловушек».
В ряде случаев теория предсказывает отклонение формы кинетической кривой от «классической»: возможно появление эффектов «задержки» и эффектов достижения «псевдостационарных» или «псевдоравновесных» значений. Ожидается дрейф эффективного коэффициента диффузии во времени (при ранних временах Dэф мал, но затем постепенно увеличивается). Существуют экспериментальные подтверждения подобных эффектов [28]. Феноменологическое рассмотрение в рамках обсуждаемого класса моделей процесса десорбции позволяет объяснить тот факт, что в десорбционных экспериментах неоднократно наблюдалось падение потока газовыделения до фонового значения, несмотря на наличие в образце значительного количества водорода. Остаточный водород находится в ловушках и не принимает участия в диффузии. Лишь при повышении температуры ловушки начинают опустошаться, водород переходит в подвижную форму и выделяется из образца. При выходе на новую температурную ступеньку на кривой газовыделения наблюдается «пик-эффект», за которым следует медленное уменьшение скорости дегазации.
Вклад процессов захвата в общий процесс переноса зависит от толщины образца. При малых толщинах вероятность встречи атома водорода с ловушкой мала, аномалии, связанные с захватом, исчезают и кинетика диффузии определяется параметром Dэф = D (в этом состоит основное отличие данной модели от модели нелинейных граничных условий 3-го рода, когда отклонение от законов Фика усиливается как раз при малых толщинах); при очень больших толщинах кинетика диффузии описывается классическим уравнением, но с Dэф = D/ (1 + Кх); при промежуточных толщинах локальное равновесие установиться не успевает и форма кинетической кривой зависит от параметров k1 и k2.
Теория диффузии с захватом предсказывает возникновение изломов на аррениусовских зависимостях параметров диффузии, причем если число ловушек с ростом температуры не возрастает, то энергия активации, рассчитанная по низкотемпературному участку, будет выше полученной из высокотемпературных данных. Это положение получило экспериментальное подтверждение: значения коэффициентов диффузии во многих металлах при низких температурах намного ниже полученных экстраполяцией на эти температуры величин, измеренных при высоких температурах. Энергия активации процесса диффузии водорода в железе и сталях при низких температурах в 3—4 раза больше, чем при высоких.
Следует отметить, что не только наличие ловушек может приводить к появлению изломов на аррениусовских зависимостях. Такие же эффекты предсказывает модель диффузии, построенная с учетом физико-химических эффектов на границе раздела водород—металл, поскольку сопротивление поверхности образца, как и захват в ловушках, усиливается при низких температурах. Разграничение двух моделей удается провести путем сравнения данных по проницаемости из газовой фазы с данными по проницаемости, полученными электрохимическим методом. Так, в работе [29], проведенной на сверхчистом, хорошо отожженном в водороде a -железе, обнаружено четкое проявление граничных условий 3-го рода: высокотемпературный прямолинейный участок на аррениусовской зависимости коэффициента диффузии в случае электрохимического варианта (в котором процессы на поверхности мембраны не играют существенной роли) сохраняется до значительно более низких температур, чем в случае диффузии из газовой фазы. Однако характерный излом наблюдается и на кривых, свободных от сопротивления границы. Тем самым доказано, что даже в тщательно приготовленных образцах чистых металлов (особенно в железе) захват в ловушки все же имеет место и способен оказать влияние на процесс диффузии водорода.
В методе термодесорбционной спектроскопии кривые газовыделения могут иметь вид одиночного пика, параметры которого характеризуют свойства подвижной (если С10=1) или неподвижной ( при С20 = 1) фазы. Однако в общем случае кривые проявляют бимодальную форму: положение первого пика определяется энергией активации диффузии, положение второго — энергией выделения из ловушек. Если в твердом теле имеются ловушки различных типов или если на процессы дегазации накладываются твердофазные превращения (сопровождающиеся отжигом и возникновением дефектов), спектры термодесорбции принимают весьма сложную форму. Очевидно, что из обработки экспериментальных данных можно найти спектр заселенности дефектов.
Для расчета параметров спектра дефектов необходимо перед началом экспериментов по термически стимулированному газовыделению добиться полного заполнения водородом всех дефектов. Если дефекты образуют кластеры, способные вместить несколько атомов водорода (т. е. они могут образовывать комплексы типа HnVm), и если в металле существуют различные типы комплексов, то это неизбежно должно оказать влияние на структуру термодесорбционного спектра. Подобные эффекты экспериментально, наблюдались при изучении выделения дейтерия из молибдена [30].
Таким образом, к настоящему времени основные положения теории диффузии водорода в дефектных средах и ее следствия получили экспериментальные подтверждения. Очевидно, что адекватное описание кинетики и термодинамики переноса в реальных металлах может быть получено только с учетом процессов взаимодействия с несовершенствами структуры металла.
С другой стороны, явление диффузии может быть использовано как эффективный метод дефектоскопии металлов, поскольку позволяет определить плотность дефектов (и ее изменение при различного рода воздействиях), энергетические характеристики, размеры, емкость и заселенность их водородом. Направленные эксперименты по использованию водорода для дефектоскопии металлов следует проводить при низких температурах и малых концентрациях диффузанта.
ЛИТЕРАТУРА
Гельд П. В., Рябов Р. A., Кодес Е. С. //Водород и несовершенства структуры металла. М.: Металлургия. 1979. 221 с.
Верт Ч.//Водород в металлах. Т. 2. Прикладные аспекты/Под ред. Г. Алефельда, И. Фелькля. М.: Мир, 1981. С. 362—390.
Hurst D. G. CRRP-1124 //Atomic Energy of Canada, LTd, Chalk River; Ontario. 1962. Nov.
Gaus HJ //ZtsdiT. Naturforsch. A. 1965. Bd. 20. S. 1298—1308.
Водород (H) и его химические реакции
Водород — простое вещество H2 (диводород, дипротий, легкий водород).
Краткая характеристика водорода:
- Неметалл.
- Бесцветный газ, трудно поддающийся сжижению.
- Плохо растворяется в воде.
- Лучше растворяется в органических растворителях.
- Хемосорбируется металлами: железом, никелем, платиной, палладием.
- Сильный восстановитель.
- Взаимодействует (при высоких температурах) с неметаллами, металлами, оксидами металлов.
- Наибольшей восстановительной способностью обладает атомный водород H 0 , получаемый при термическом разложении H2.
- Изотопы водорода:
- 1 H — протий
- 2 H — дейтерий (D)
- 3 H — тритий (Т)
- Относительная молекулярная масса = 2,016
- Относительная плотность твердого водорода (t=-260°C) = 0,08667
- Относительная плотность жидкого водорода (t=-253°C) = 0,07108
- Избыточное давление (н.у.) = 0,08988 г/л
- tплавления = -259,19°C
- tкипения = -252,87°C
- Объемный коэффициент растворимости водорода:
- (t=0°C) = 2,15;
- (t=20°C) = 1,82;
- (t=60°C) = 1,60;
1. Термическое разложение водорода (t=2000-3500°C):
H2 ↔ 2H 0
2. Взаимодействие водорода с неметаллами:
3. Взаимодействие водорода со сложными веществами:
4. Участие водорода в окислительно-восстановительных реакциях:
Водородные соединения
D2 — дидейтерий:
- Тяжелый водород.
- Бесцветный газ, трудно поддаваемый сжижению.
- Дидейтерия содержится в природной водороде 0,012-0,016% (по массе).
- В газовой смеси дидейтерия и протия изотопный обмен протекает при высоких температурах.
- Плохорастворим в обычной и тяжелой воде.
- С обычной водой изотопный обмен незначителен.
- Химические свойства аналогичны легкому водороду, но дидейтерий обладает меньшей реакционной способностью.
- Относительная молекулярная масса = 4,028
- Относительная плотность жидкого дидейтерия (t=-253°C) = 0,17
- tплавления = -254,5°C
- tкипения = -249,49°C
T2 — дитритий:
- Сверхтяжелый водород.
- Бесцветный радиоактивный газ.
- Период полураспада 12,34 года.
- Химические свойства аналогичны H2.
- В природе дитритий образуется в результате бомбардировки нейтронами космического излучения ядер 14 N, следы дитрития обнаружены в природных водах.
- Получают дитритий в ядерном реакторе бомбардировкой лития медленными нейтронами.
- Относительная молекулярная масса = 6,032
- tплавления = -252,52°C
- tкипения = -248,12°C
HD — дейтериоводород:
- Бесцветный газ.
- Не растворяется в воде.
- Химические свойства аналогичны H2.
- Относительная молекулярная масса = 3,022
- Относительная плотность твердого дейтериоводорода (t=-257°C) = 0,146
- Избыточное давление (н.у.) = 0,135 г/л
- tплавления = -256,5°C
- tкипения = -251,02°C
Оксиды водорода
H2O — вода:
- Бесцветная жидкость.
- По изотопному составу кислорода вода состоит из H2 16 O с примесями H2 18 O и H2 17 O
- По изотопному составу водорода вода состоит из 1 H2O с примесью HDO.
- Жидкая вода подвергается протолизу (H3O + и OH — ):
- H3O + (катион оксония) является самой сильной кислотой в водном растворе;
- OH — (гидроксид-ион) является самым сильным основанием в водном растворе;
- Вода — самый слабый сопряженный протолит.
- Со многими веществами вода образует кристаллогидраты.
- Вода является химически активным веществом.
- Вода является универсальным жидким растворителем неорганических соединений.
- Относительная молекулярная масса воды = 18,02
- Относительная плотность твердой воды (льда) (t=0°C) = 0,917
- Относительная плотность жидкой воды:
- (t=0°C) = 0,999841
- (t=20°C) = 0,998203
- (t=25°C) = 0,997044
- (t=50°C) = 0,97180
- (t=100°C) = 0,95835
- плотность (н.у.) = 0,8652 г/л
- tплавления = 0°C
- tкипения = 100°C
- Ионное произведение воды (25°C) = 1,008·10 -14
1. Термическое разложение воды:
2H2O ↔ 2H2+O2 (выше 1000°C)
D2O — оксид дейтерия:
- Тяжелая вода.
- Бесцветная гигроскопичная жидкость.
- Вязкость выше, чем у воды.
- Смешивается с обычной водой в неограниченных количествах.
- При изотопном обмене образуется полутяжелая вода HDO.
- Растворяющая способность ниже, чем у обычной воды.
- Химические свойства оксида дейтерия аналогичны химическим свойствам воды, но все реакции протекают медленнее.
- Тяжелая вода присутствует в природной воде (массовое отношение к обычной воде 1:5500).
- Оксид дейтерия получают многократным электролизом природной воды, при котором тяжелая вода накапливается в остатке электролита.
- Относительная молекулярная масса тяжелой воды = 20,03
- Относительная плотность жидкой тяжелой воды (t=11,6°C) = 1,1071
- Относительная плотность жидкой тяжелой воды (t=25°C) = 1,1042
- tплавления = 3,813°C
- tкипения = 101,43°C
T2O — оксид трития:
- Сверхтяжелая вода.
- Бесцветная жидкость.
- Вязкость выше, а растворяющая способность ниже, чем у обычной и тяжелой воды.
- Смешивается с обычной и тяжелой водой в неограниченных количествах.
- Изотопный обмен с обычной и тяжелой водой приводит к образованию HTO, DTO.
- Химические свойства сверхтяжелой воды аналогичны химическим свойствам воды, но все реакции протекают еще медленнее, чем в тяжелой воде.
- Следы оксида трития находят в природной воде и атмосфере.
- Получают сверхтяжелую воду пропусканием трития над раскаленным оксидом меди CuO.
- Относительная молекулярная масса сверхтяжелой воды = 22,03
- tплавления = 4,5°C
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://profbeckman.narod.ru/HMet.htm
http://prosto-o-slognom.ru/chimia_spravochnik/1_vodorod_H.html