10 идеальный газ основное уравнение mkt идеального газа
Идеальный газ — это просто!
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало.
Понятие «идеальный газ» вводится для математического описания поведения газов.
Реальные разреженные газы ведут себя как идеальный газ!
Свойства идеального газа:
— взаимодействие между молекулами пренебрежительно мало
— расстояние между молекулами много больше размеров молекул
— молекулы — это упругие шары
— отталкивание молекул возможно только при соударении
— движение молекул — по законам Ньютона
— давление газа на стенки сосуда — за счет ударов молекул газа
Скорость молекул газа
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул.
Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
где
n — число молекул в газе
v — модули скоростей отдельных молекул в газе
В теории газов часто используется понятие кинетической энергии молекул.
Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
где
р — давление газа на стенки сосуда(Па)
n — концентрация молекул, т.е. число молекул в единице объема ( 1/м 3 )


ρ — плотность газа (кг/м 3 )

Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
Дополнительные расчетные формулы по теме
Формула для расчета концентрации молекул:
где
N — число молекул газа
V — объем газа (м 3 )
Формула для расчета плотности газа:
где
mo — масса молекулы (кг)
n — концентрация молекул (1/м 3 )
Молекулярная физика. Термодинамика — Класс!ная физика
Идеальный газ
О чем эта статья:
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Твердое
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около положения равновесия в кристаллической решетке
Жидкое
сохраняет объем и текучесть
близко друг к другу
молекулы малоподвижны, при нагревании скорость движения увеличивается
Газообразное
занимает весь предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Расстояние между молекулами значительно больше размеров молекул.
Молекулы газа очень малы и представляют собой упругие шары.
Силы притяжения между молекулами пренебрежимо малы.
Молекулы взаимодействуют только при соударениях.
Молекулы движутся хаотично.
Молекулы движутся по законам Ньютона.
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость
vср. кв. — средняя квадратичная скорость [м/с]
v1, v2, vn — скорости разных молекул [м/с]
N — количество молекул [—]
Попробуйте курсы подготовки к ЕГЭ по физике с опытным преподавателем в онлайн-школе Skysmart!
Давление идеального газа
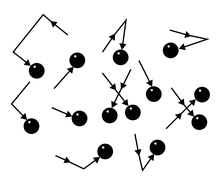
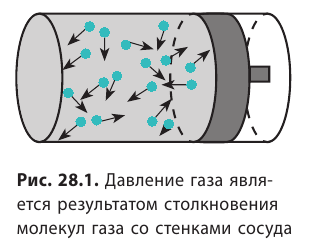
Молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
F — сила [Н]
S — площадь [м 2 ]
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
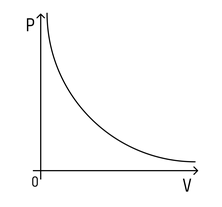
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
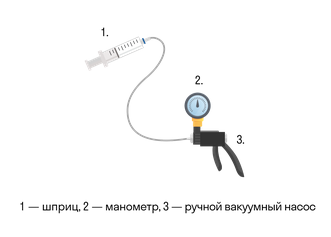
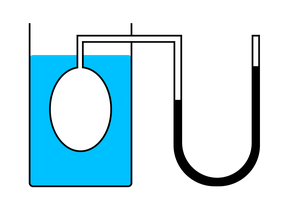
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
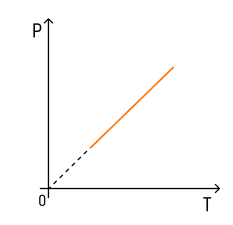
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Все вещества образованы из мельчайших частиц — молекул, которые состоят из атомов.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, которые имеют электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ
p = nkT
p — давление газа [Па]
n — концентрация [м −3 ]
T — температура газа [К]
m 0 — масса одной молекулы [кг]
v — средняя квадратичная скорость [м/с]
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v 2 , а вместо v — и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия
Ек = mv 2 /2
Ек — кинетическая энергия [Дж]
m — масса тела [кг]
v — скорость [м/с]
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы
Ек — средняя кинетическая энергия поступательного движения молекулы [Дж]
m0 — масса молекулы [кг]
v — скорость молекулы [м/с]
Из этой формулы можно выразить m0v 2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ
p — давление газа [Па]
n — концентрация [м −3 ]
E — средняя кинетическая энергия поступательного движения молекулы [Дж]
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Уравнение МКТ идеального газа — основные понятия, формулы и определение с примерами
Содержание:
Фазовые состояния вещества:
В МКТ различают три фазовых (агрегатных) состояния вещества: жидкое, кристаллическое, газообразное (существует и четвертое состояние — плазма, и оно самое распространенное во Вселенной, ведь именно в состоянии плазмы находится вещество в звездах). Изменение фазового состояния называют фазовым переходом. Рассмотрим разные фазовые состояния вещества и выясним особенности движения и взаимодействия молекул вещества в разных состояниях.
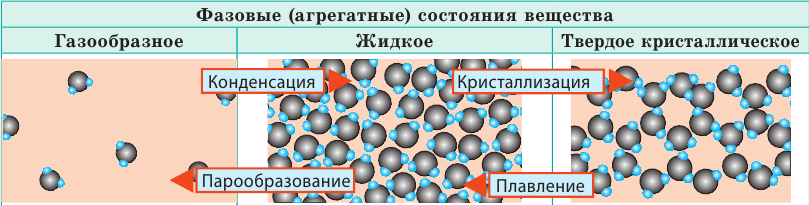 | ||
| Слово «газ» происходит от греческого слова chaos («хаос»). Молекулы газов расположены беспорядочно и на расстояниях, которые в десятки раз больше размеров самих молекул. На таких расстояниях молекулы практически не взаимодействуют друг с другом. Непрерывно сталкиваясь, молекулы газов разлетаются во все стороны, пока не встретят какое-либо препятствие, например стенки сосуда. Именно поэтому газы не имеют формы и занимают весь предоставленный объем. Большими расстояниями между молекулами объясняется и тот факт, что газы легко сжимаются. | Молекулы жидкости в целом расположены хаотично, однако в расположении ближайших молекул сохраняется определенный (ближний) порядок. Среднее расстояние между молекулами примерно равно размерам молекул, и межмолекулярные силы удерживают их около положения равновесия. Каждая молекула жидкости некоторое время (порядка 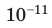 | В веществе, находящемся в твердом кристаллическом состоянии, молекулы расположены в определенном порядке (образуют кристаллическую решетку) на расстояниях, примерно равных размерам самих молекул, поэтому силы межмолекулярного взаимодействия удерживают их около положения равновесия. В отличие от жидкостей, перескакивания молекул в твердых телах происходят очень редко — каждая молекула сохраняет положение равновесия достаточно долго, а ее движение сводится к колебаниям около этого положения. Поэтому твердые тела сохраняют и объем, и форму; как и жидкость, их очень трудно сжать. |
Молекулы некоторых твердых тел в целом расположены беспорядочно. Такое состояние вещества называют аморфным. Вещества в аморфном состоянии напоминают очень вязкие жидкости. Так, если положить в сосуд кусочки смолы (аморфное вещество), со временем смола сольется и примет форму сосуда.
В отличие от кристаллических, аморфные вещества не имеют определенной температуры плавления, а переходят в жидкое состояние постепенно размягчаясь. Аморфное состояние веществ неустойчиво — постепенно происходит кристаллизация. Так, стекло имеет аморфную структуру, но со временем в нем образуются помутнения — кристаллики кварца. Сахар — это молекулярный кристалл. Если его расплавить и охладить, получим леденец — аморфное состояние сахара. Но через некоторое время в леденце начнут расти кристаллики сахара. Именно по этой причине засахаривается варенье.
- Молекулы, атомы, ионы находятся в непрерывном хаотическом движении. Именно движением частиц вещества можно объяснить такие явления, как броуновское движение (видимое в микроскоп хаотическое перемещение малых макрочастиц, взвешенных в жидкости или газе) и диффузия (взаимное проникновение соприкасающихся веществ друг в друга).
- Частицы вещества взаимодействуют друг с другом. Основная причина межмолекулярного взаимодействия — электрическое притяжение и отталкивание заряженных частиц, образующих атом. На расстояниях, которые больше размеров молекул, молекулы притягиваются друг к другу; на расстояниях, которые незначительно меньше размера молекул, — отталкиваются.
- Вещество может находиться в твердом, жидком и газообразном фазовых (агрегатных) состояниях в зависимости от того, как расположены, как двигаются и как взаимодействуют его частицы.
Основное уравнение МКТ идеального газа
Каждое макроскопическое тело состоит из огромного количества молекул. МКТ рассматривает строение и свойства макроскопических тел, а также процессы, происходящие в этих телах, с точки зрения их молекулярной структуры. Поведение макроскопических тел описывается рядом физических величин — микроскопическими и макроскопическими параметрами. Выясним, что это за параметры и как они связаны.
Микроскопические и макроскопические параметры
Рассмотрим систему, состоящую из очень большого количества атомов или молекул. Такой системой, например, может быть какой-либо газ. В любой момент времени каждая микрочастица газа обладает энергией, движется с некоторой скоростью, имеет массу.
Физические величины, характеризующие свойства и поведение отдельных микрочастиц вещества, называют микроскопическими параметрами.
Некоторые микроскопические параметры могут изменяться без внешнего воздействия на систему. Например, скорости движения молекул газа непрерывно изменяются в результате их столкновений друг с другом.
В то же время газ данной массы занимает некоторый объем, создает давление, имеет температуру. Значения этих физических величин определяются совокупностью множества молекул — например, мы не можем говорить о давлении, температуре или плотности одной молекулы.
Физические величины, характеризующие свойства и поведение макроскопических тел без учета их молекулярного строения, называют макроскопическими параметрами.
Макроскопические параметры могут изменяться только за счет внешних воздействий на систему или за счет теплообмена. Так, чтобы увеличить давление газа, газ нужно нагреть (передать определенное количество теплоты) или сжать (то есть совершить работу).
Какой газ называют идеальным
Количественные закономерности, связывающие макроскопические и микроскопические параметры тел, достаточно сложны. Рассмотрим самый простой случай — достаточно разреженные газы (такими, например, являются обычные газы при нормальных условиях). В разреженных газах расстояние между молекулами во много раз превышает размеры самих молекул, поэтому эти молекулы можно считать материальными точками, а их взаимодействием, за исключением моментов соударения, можно пренебречь. Кроме того, свойства разреженных газов практически не зависят от их молекулярного состава, а столкновения молекул такого газа приближаются к упругим. Таким образом, вместо реальных газов можно рассматривать их физическую модель — идеальный газ.
Идеальный газ — это физическая модель газа, молекулы которого принимают за материальные точки, не взаимодействующие друг с другом на расстоянии и упруго взаимодействующие в моменты столкновений.
Основное уравнение МКТ идеального газа
Начнем с такого микроскопического параметра, как скорость движения молекул. Обратим внимание на то, что бессмысленно рассматривать движение каждой отдельной молекулы и устанавливать скорость ее движения в данный момент времени, да это и невозможно: число молекул огромно, и за секунду каждая молекула изменяет скорость своего движения миллиарды раз. Поэтому физики используют средние значения скоростей молекул. Важнейшим в МКТ является понятие средний квадрат скорости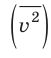
где N — число молекул; 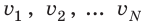
Квадратный корень из среднего квадрата скорости называют средней квадратичной скоростью движения молекул (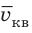
Понятно, что средний квадрат скорости (а следовательно, и среднюю квадратичную скорость) невозможно определить с помощью прямых измерений. Однако эта величина связана с определенными макроскопическими (измеряемыми) параметрами газа, например с давлением.
Напомним, что давление газа обусловлено ударами его молекул (рис. 28.1). Находясь в непрерывном хаотическом движении, молекулы газа сталкиваются со стенками сосуда и поверхностью любого тела в газе, действуя на них с некоторой силой. Суммарная сила воздействия частиц на единицу площади поверхности и есть давление газа: 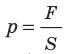
Уравнение зависимости давления p идеального газа от массы 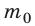
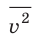
Здесь n — концентрация молекул газа — физическая величина, равная числу молекул в единице объема газа:
Средняя кинетическая энергия поступательного движения молекул идеального газа (кинетическая энергия поступательного движения, в среднем приходящаяся на одну молекулу) равна: 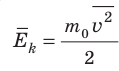
Пример решения задачи
Определите плотность идеального газа, находящегося под давлением 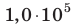
Решение:
В задаче нужно найти макроскопический параметр — плотность газа. Для решения задачи воспользуемся основным уравнением МКТ идеального газа:
Поскольку ρ = 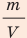
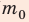
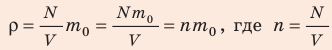
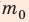
Отсюда 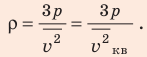
Проверим единицу, найдем значение искомой величины:
Анализ результата. Плотности газов при нормальных условиях колеблются от 0,09 до 1,5 кг/м3, то есть получен реальный результат.
Ответ: ρ = 1, 2 кг/м3.
- Физические величины, характеризующие свойства и поведение отдельных микрочастиц вещества, называют микроскопическими параметрами. Физические величины, характеризующие свойства и поведение макроскопических тел без учета их молекулярного строения, называют макроскопическими параметрами.
- Идеальный газ — это физическая модель газа, молекулы которого принимают за материальные точки, не взаимодействующие друг с другом на расстоянии и упруго взаимодействующие в момент столкновения.
- Основное уравнение МКТ идеального газа связывает макроскопический параметр (давление) с микроскопическими параметрами (массой и средним квадратом скорости движения молекул):
. Это уравнение можно записать в виде:
.
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Уравнение состояния идеального газа
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Движение тел под воздействием нескольких сил
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://skysmart.ru/articles/physics/idealnyj-gaz
http://www.evkova.org/uravnenie-mkt-idealnogo-gaza






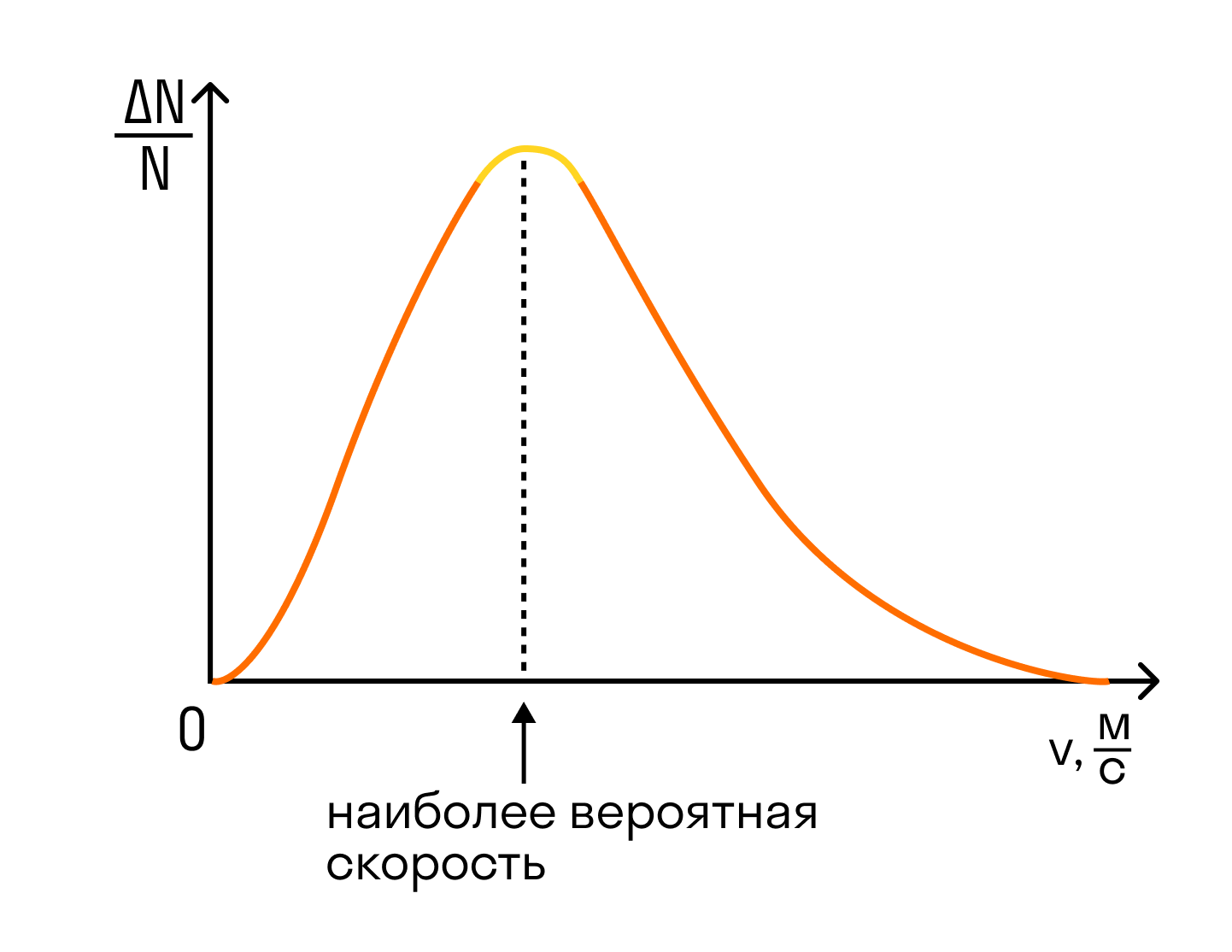
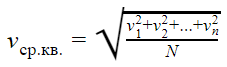


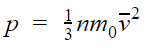
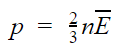
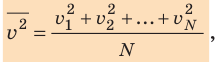
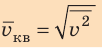
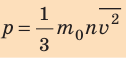
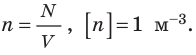
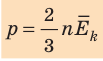
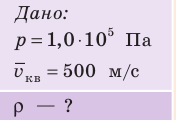


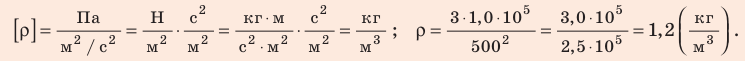
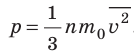 . Это уравнение можно записать в виде:
. Это уравнение можно записать в виде: 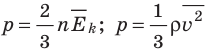 .
.