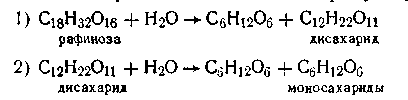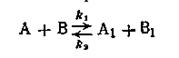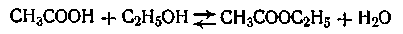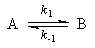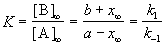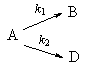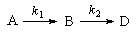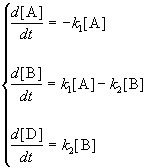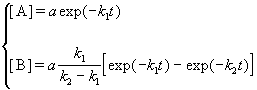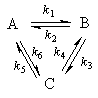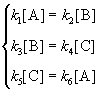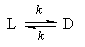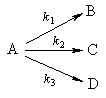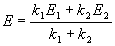Реакции второго порядка.
К реакциям второго порядка относятся реакции соединения типа A + B→C, реакции обмена A + B = C + D, а также реакции разложения и др. Скорость реакции второго порядка определяется уравнением
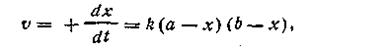 | 2.13 |
где k — константа скорости реакции; а — число молей вещества А в начале реакции; b — число молей вещества В в начале реакции; х—число прореагировавших молей.
Здесь возможны два случая. Первый случай — это когда какое-то количество вещества А вступает в реакцию с эквивалентным количеством вещества В, т. е. когда а = b. И второй случай более сложный — это когда а ≠ b. Рассмотрим оба эти случая.
Первый случай (а= b).Поскольку исходные концентрации реагирующих веществ равны между собой, уравнение (2.13) примет вид
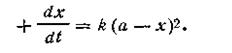 | 2.14 |
Разделяя переменные и производя интегрирование, получим
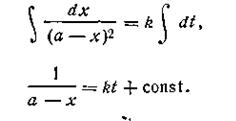 | 2.15 |
При t = 0 x = 0, откуда const =1/а. После подстановки этой величины в уравнение (2.15) получим
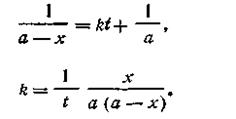 | 2.16 |
Размерность константы скорости реакции второго порядка t -1 C -1 . Поэтому в отличие от константы скорости первого порядка численное значение k зависит от того, в каких единицах выражены t и С. Если последняя выражена в кмоль/м 3 , а время в с, то k имеет размерность [с -1 ·(кмоль/м 3 ) -1 ].
Для реакций второго порядка большую роль играет число столкновений, которые происходят в единицу времени между молекулами реагирующих веществ. Число столкновений, в свою очередь, пропорционально числу молекул в единице объема, т. е. концентрации. Таким образом, константа скорости, а следовательно, и скорость реакции второго порядка зависят от разбавления раствора.
Второй случай (а ≠ b). Если для реакции взяты неэквивалентные количества реагирующих веществ, скорость реакции выразится так:
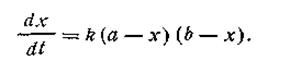 | 2.17 |
После разделения переменных получим это уравнение в другом виде:
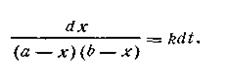 | 2.18 |
Выражение, стоящее в левой части уравнения (2.18), можно представить как
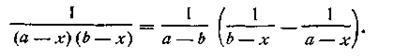 | 2.19 |
Поcле подстановки этого выражения в уравнение (2.13) получим
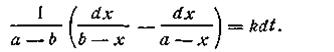 | 2.20 |
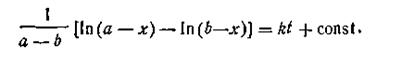 | 2.21 |
Поскольку при t = 0 х = 0, постоянная интегрирования
 | 2.22 |
Подставляя это выражение в уравнение (2.16), найдем
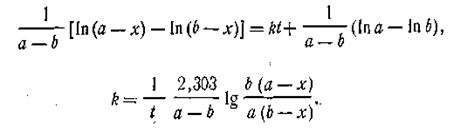 | 2.23 |
Это и есть кинетическое уравнение реакции второго порядка. Примером подобной реакции может служить омыление эфиров щелочами:
Кинетика реакций второго порядка была детально изучена С. Г. Крапивиным еще в 1915 г.
Реакции третьего порядка встречаются очень редко и потому не имеет смысла рассматривать математический вывод их кинетического уравнения.
Существуют экспериментальные способы определения порядка реакции, основные из них:
подстановки в кинетическое уравнение реакций,
определение полупериода реакций,
Сложные реакции.
Сложными называются реакции, общее кинетическое уравнение которых в отличие от кинетического уравнения простых реакций содержит несколько констант скоростей. К сложным реакциям относятся обратимые, параллельные, последовательные, сопряженные, цепные и другие реакции. Теория всех этих реакций основана на положении, что при протекании в системе одновременно нескольких реакций каждая из них проходит самостоятельно и к каждой из них в отдельности применимы уравнения кинетики простых реакций.
Параллельными реакциями называются реакции вида
т. е. при которых одни и те же исходные вещества, одновременно реагируя, образуют разные продукты. Примером подобного типа реакций является реакция разложения бертолетовой соли КСlO3, которая может идти в двух направлениях:
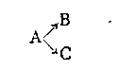
Примером последовательных реакций может служить гидролиз рафинозы трисахарида, который происходит через стадии образования дисахарида, а последний образует уже моносахариды:
Расчет кинетики последовательных реакций в общем виде очень сложен и здесь не рассматривается. Отметим только, что если одна из ступеней обладает значительно меньшей скоростью, чем остальные, то общая скорость реакции определяется скоростью именно этой ступени.
Сопряженными реакциями называются реакции, которые протекают по следующей схеме:
Реакция 1 может протекать самостоятельно, в то время как реакция 2 проходит при наличии реакции 1. Так, сульфат железа окисляется пероксидом водорода независимо от присутствия йодистого водорода. Последний же в чистом виде пероксидом водорода не окисляется, но при окислении сульфата железа окисляется одновременно с ним.
Обратимыми называются такие реакции, скорость которых равна разности между скоростями прямой и обратной реакции:
Примером обратимой реакции, может служить реакция образования сложного эфира
В этом случае скорость прямой реакции с течением времени убывает, а скорость обратной реакции возрастает до тех пор, пока обе скорости не выравняются и не наступит так называемое состояние динамического равновесия. Константа равновесия данной реакции равна отношению констант скоростей прямой и обратной реакции.
Наряду с рассмотренными выше реакциями, механизм которых сравнительно прост, существуют также реакции, в которых взаимодействие осуществляется более сложным путем. Примером подобных реакций являются цепные реакции, которые имеют исключительно большое значение в химической технологии, так как на них основаны такие процессы, как полимеризация, крекинг нефти, деление атомного ядра.
К цепным реакциям относится большая группа реакций, протекающих путем образования цепи следующих друг за другом реакций, в которых участвуют активные частицы с ненасыщенными свободными валентностями — так называемые свободные радикалы. Свободные радикалы образуются за счет дополнительного поглощения энергии при разрыве связей в молекуле, при электрическом разряде, при поглощении электромагнитных колебаний, а также за счет других внешних источников энергии.
Сущность цепного механизма реакции заключается в том, что активная молекула, реагируя, порождает новую активную молекулу или реакционноспособную частицу (валентно-ненасыщенные свободные атомы или радикалы). Процесс исчезновения и регенерации каждой активной частицы в дальнейшем циклически повторяется много раз и создает цепь превращений, совершающихся частью последовательно, а частью параллельно.
Впервые определение цепного механизма реакций через образование активных центров было дано Н. А. Шиловым (1904). Чрезвычайно большой вклад в дело изучения цепных реакций внес Н. Н. Семенов, которому за эти исследования была присуждена Нобелевская премия.
В настоящее время цепные реакции изучены настолько хорошо, что стало осуществимо регулирование скорости этих реакций. Добавляя вещество, легко вступающее во взаимодействие с активными центрами, можно значительно увеличить число обрывов цепей и тем самым затормозить (или же прекратить вовсе) цепную реакцию.
Например, добавление всего лишь 0,01% NС1з (треххлористого азота) к смеси водорода и хлора (Н2 и С2), которые реагируют по типу цепных нарастающих реакций, уменьшает скорость образования хлористого водорода в десятки тысяч раз.
Некоторые добавки увеличивают скорость цепных реакций. Так, добавление сравнительно малых количеств N0 в значительной степени ускоряет цепные реакции окисления углеводородов. При этом удается значительно понизить температуру процесса окисления, что очень важно, так как сохраняются от сгорания ценные промежуточные продукты — уксусный и муравьиный альдегиды.
На цепных химических реакциях основаны многие технологические процессы — синтез спиртов, кетонов, формалина, уксусной кислоты.
В последнее время исследования показали, что некоторые биологические процессы также протекают по типу цепных реакций, в частности процессы биологического окисления.
2a b c кинетическое уравнение
При изучении кинетики сложных реакций, включающих несколько элементарных стадий, используют принцип независимости химических реакций:
Если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций.
Основные типы сложных реакций мы рассмотрим на примере реакций первого порядка.
1. Обратимые реакции первого порядка:
Закон действующих масс записывается следующим образом:
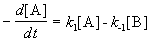
Если начальные концентрации веществ A и B обозначить, соответственно, a и b и ввести степень превращения x ([A] = a — x, [B] = b + x), то кинетическое уравнение приобретает вид:
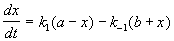
Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия:
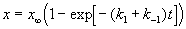
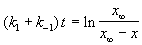
где x 
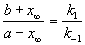
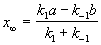
При t 

2. Параллельные реакции первого порядка:
Кинетическое уравнение записывается с учетом принципа независимости:
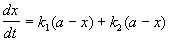
Решение этого уравнения записывается так же, как и для одной реакции первого порядка:
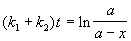
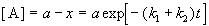
Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий:
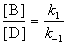
3. Последовательные реакции первого порядка:
Пусть в начальный момент времени есть только вещество A. Применим к этой системе закон действующих масс и принцип независимости химических реакций:
Решение этой системы дает концентрации веществ:
Концентрация промежуточного вещества достигает максимума при
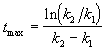
Величина этого максимума определяется отношением констант k2 / k1. Если оно велико, т.е. k2 >> k1, то промежуточный продукт не успевает накапливаться и его концентрация в любой момент времени мала. В этом случае для анализа кинетических уравнений можно использовать приближенный метод квазистационарных концентраций ( 6).
Пример 5-1. Для обратимой реакции первого порядка
Kравн = 8, а k1 = 0.4 с -1 . Вычислите время, при котором концентрации веществ A и B станут равными, если начальная концентрация вещества B равна 0.
Решение. Из константы равновесия находим константу скорости обратной реакции:
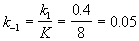
По условию, мы должны найти время, за которое прореагирует ровно половина вещества A. Для этого надо подставить значение x(t) = a/2 в решение кинетического уравнения для обратимых реакций (5.1) и (5.2):
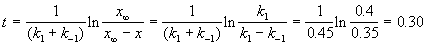
Пример 5-2. В параллельных реакциях первого порядка
выход вещества B равен 63%, а время превращения A на 1/3 равно 7 минутам. Найдите k1 и k2.
Решение. Кинетическое уравнение (5.3) для разложения вещества в параллельных реакциях имеет вид уравнения первого порядка, в которое вместо одной константы скорости входит сумма констант скорости отдельных стадий. Следовательно, по аналогии с реакциями первого порядка, по времени превращения A на 1/3 (x(t) = a/3) можно определить сумму констант k1 + k2:
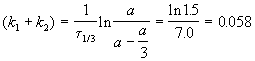
Выход вещества В равен 63%, а вещества D — 37%. Отношение этих выходов равно отношению конечных концентраций веществ B и D, следовательно оно равно отношению соответствующих констант скорости:
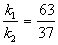
Решая это уравнение совместно с предыдущим, находим: k1 = 0.037 мин -1 , k2 = 0.021 мин -1 .
Пример 5-3. Имеется следующее равновесие:
Как связаны между собой константы k1 — k6?
Решение основано на принципе детального равновесия:
Если сложная система находится в равновесии, то в каждой из элементарных стадий также соблюдается равновесие.
Это означает, что во всех трех процессах: A 


Перемножив почленно эти три равенства и поделив левую и правую части на произведение равновесных концентраций [A] . [B]. [C], находим искомое соотношение между константами скорости:
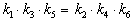
5-1. Нарисуйте графики зависимости концентраций веществ A и B от времени в обратимой реакции A 
5-5. Превращение роданида аммония NH4SCN в тиомочевину (NH4)2CS — обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакций, используя следующие экспериментальные данные:
t, мин
Доля прореагировавшего NH4SCN, %
5-6. Один из методов оценки возраста биологических объектов основан на измерении содержания в них оптических изомеров аминокислот. В живых организмах отношение концентраций D- и L-изомеров постоянно ([D]0 / [L]0 = a). В мертвых организмах происходит рацемизация:
Чему равен возраст биологического объекта, в котором [D] / [L] = b? Решите задачу в общем виде и для образца, содержащего аспарагиновую кислоту (k = 1.48 . 10 -5 лет -1 , a = 0.07, b = 0.27).(ответ)
5-7. В параллельных реакциях первого порядка
выход вещества B равен 53%, а время превращения A на 1/3 равно 40 c. Найдите k1 и k2.(ответ)
5-8. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 5 мин после начала реакции были равны: [B] = 3.2 моль/л, [C] = 1.8 моль/л, [D] = 4.0 моль/л. Определите константы скорости k1 — k3, если период полураспада вещества А равен 10 мин.(ответ)
5-9. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 10 мин после начала реакции были равны: [B] = 1.6 моль/л, [C] = 3.6 моль/л, [D] = 7.8 моль/л. Определите константы скорости k1 — k3, если период полураспада вещества А равен 8 мин.(ответ)
5-10. Покажите, что при двух параллельных реакциях
энергия активации суммарной реакции разложения A связана с энергиями активации отдельных стадий следующим образом:
*5-11. В системе идут две параллельные газофазные реакции: А + B 

5-12. На одном графике нарисуйте зависимости концентрации вещества B от времени в системе последовательных реакций A 

| [предыдущий раздел] | [содержание] | [следующий раздел] |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Алгоритм решения задач по теме «Скорость химических реакций»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Алгоритм решения задач по теме «Скорость химической реакции»
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
По правилу Вант-Гоффа
По условию задачи требуется определить υ/υ 0 :
υ/υ 0 =2 (70-30)/10 = 2 4 = 16
Запишите кинетическое уравнение для следующих уравнений реакций:
Согласно закону действующих масс, который действует для газов и жидкостей:
Как изменится скорость реакции:
при увеличении давления в системе в 4 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию кислорода
С(О 2 ) = а, концентрация серы — твёрдого вещества не учитывается.
При повышении давления в 4 раза, объём уменьшается в 4 раза, следовательно концентрация газа кислорода увеличится в 4 раза и кинетическое уравнение примет вид:
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 4а / к 1 а = 4
Следовательно, при повышении давления в 4 раза, скорость данной реакции увеличится в 4 раза.
Как изменится скорость реакции:
при увеличении давления в системе в 2 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию SO 2
С(SО 2 ) = а, концентрация кислорода C(O 2 ) = b.
При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO 2 увеличится в 2 раза и кинетическое уравнение примет вид:
υ ‘ = к 1 (2а) 2 ·2b = к 1 4а 2 ·2b= к 1 8а 2 ·b
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 8а 2 ·b / к 1 а 2 ·b =8
Следовательно, при повышении давления в 2 раза, скорость данной реакции увеличится в 8 раз.
При температуре 10 ºС реакция протекает за 5 мин, при 20ºС – за 1 мин. Рассчитайте температурный коэффициент скорости реакции.
1) При условии, что концентрация вещества (С), вступившего в реакцию, постоянна:
При температуре 10 ºС скорость реакции равна υ 0 =∆ C /∆τ 0 ,
При температуре 30 ºС скорость реакции равна υ =∆ C /∆τ,
υ =∆ C /60, ∆ C = 60 υ . Следовательно, 300 υ 0 =60 υ , а υ/ υ 0 =300/60=5.
2) По правилу Вант Гоффа: υ = υ 0 γ ∆ t /10 , υ/ υ 0 = γ ∆ t /10
3) Согласно рассуждениям (1) и (2), получим γ (20-10)/10 = γ=5
Работа № 143 (лабораторная). Выделение крахмала, белка, жира из семян.
Оборудование: мука, семена подсолнечника, вода в химическом стакане, кусочек марли, раствор иода, стакан с водой и крахмалом, пипетка.
1.Возьмите немного пшеничной муки, добавьте в нее воды и сделайте небольшой комочек теста.
2.Заверните комочек теста в марлю и промойте его в стакане с водой. Как изменилась вода в стакане?
3. Капните 1—2 капли раствора иода в стакан с водой и крахмалом. Как изменилась окраска содержимого стакана?
4.Капните 1—2 капли раствора иода в стакан с водой, в котором промывали комочек теста в марле. Как изменилась окраска содержимого в стакане? Чем это можно объяснить?
5.Разверните марлю, в которой было тесто. Вы увидите на марле тягучую клейкую массу — клейковину, или растительный белок.
6.Возьмите семя подсолнечника и заверните его в листок белой бумаги. Надавите на семя тупым концом карандаша. Разверните листок бумаги и посмотрите, чем пропиталась бумага.
7.Перечертите схему и заполните ее.
Органические вещества семени
Работа № 143 (лабораторная). Выделение крахмала, белка, жира из семян.
Оборудование: мука, семена подсолнечника, вода в химическом стакане, кусочек марли, раствор иода, стакан с водой и крахмалом, пипетка.
1.Возьмите немного пшеничной муки, добавьте в нее воды и сделайте небольшой комочек теста.
2.Заверните комочек теста в марлю и промойте его в стакане с водой. Как изменилась вода в стакане?
3. Капните 1—2 капли раствора иода в стакан с водой и крахмалом. Как изменилась окраска содержимого стакана?
4.Капните 1—2 капли раствора иода в стакан с водой, в котором промывали комочек теста в марле. Как изменилась окраска содержимого в стакане? Чем это можно объяснить?
5.Разверните марлю, в которой было тесто. Вы увидите на марле тягучую клейкую массу — клейковину, или растительный белок.
6.Возьмите семя подсолнечника и заверните его в листок белой бумаги. Надавите на семя тупым концом карандаша. Разверните листок бумаги и посмотрите, чем пропиталась бумага.
7.Перечертите схему и заполните ее.
Органические вещества семени
Классификация органических соединений по функциональным группам.
Основы номенклатуры органических соединений.
Изомерия в органической химии: углеродного скелета, положения кратной связи.
Изомерия положения функциональных групп. Межклассовая и пространственная изомерия.
Решение заданий по определению и написанию изомеров. Решение расчетных задач на вывод формул органических
Решение расчетных задач на вывод формул органических по процентному составу вещества.
Контрольная работа №1 по теме «Строение и классификация орг. в-в»
Тема 3. Химические реакции в органической химии (4 часа)
Типы химических реакций в органической химии: замещения и присоединения.
Реакции отщепления и изомеризации
Решение задач и упражнений по теме «Химические реакции»
Практическая работа №1 «Качественный анализ органических соединений»
Тема 4. Углеводороды (16 часов)
Природные источники углеводородов. Нефть, природный газ, каменный уголь.
Алканы: строение, номенклатура, изомерия, получение, физические свойства
Химические свойства алканов.
Алкены: строение, номенклатура, изомерия, получение, физические свойства.
Химические свойства алкенов.
Практическая работа №2 «Получение этилена и опыты с ним»
Алкины: строение, номенклатура, изимерия, получение, физические свойства
Химические свойства алкинов.
Алкадиены: строение, номенклатура, изомерия, получение, физические свойства
Химические свойства алкадиенов. Каучуки. Резина.
Циклоалканы: строение, номенклатура, изомерия, получение, физические свойства.
Ароматические углеводорода (Арены). Строение молекулы бензола. Физические свойства и получение.
Химические свойства бензола.
Генетическая связь между классами углеводородов.
Выполнение заданий по составлению изомеров, уравнений реакций.
Контрольная работа №2 по теме «Углеводороды»
Тема 5. Спирты и фенолы (7 часов)
Спирты: состав, классификация, изомерия.
Химические свойства одноатомных спиртов
Взаимное влияние атомов на примере молекулы фенола.
Решение расчетных задач по определению мол. формулы по продуктам сгорания.
Тема 6. Альдегиды и кетоны (6 часов)
Альдегиды: классификация, изомерия, номенклатура. Строение молекулы, физ. свойства».
Химические свойства альдегидов.
Генетическая связь между органическими веществами.
Решение расчетных и экспериментальных задач
Контрольная работа №3 по теме «Альдегиды и кетоны»
Практическая работа №4 «Спирты. Фенолы. Альдегиды. Кетоны»
Тема 7. Карбоновые кислоты. Сложные эфиры (7 часов).
Карбоновые кислоты: строение, классификация.
Химические свойства карбоновых кислот (по карбоксильной группе)
Химические свойства карбоновых кислот (по радикалу).
Контрольная работа №4 по теме «Карбоновые кислоты и их производные»
Практическая работа №5 «Карбоновые кислоты»
Тема 8. Углеводы (5 часов)
Углеводы, их состав и классификация.
Решение экспериментальных задач. Генетическая связь между классами орг. в-в»
Практическая работа №6 «Углеводы»
Тема 9. Азотсодержащие соединения (8 часов)
Амины: строение, классификация, номенклатура, получение.
Аминокислоты: состав и строение молекул, номенклатура, получение.
Белки как биополимеры. Биологическая роль белков.
Химические свойства белков.
Контрольная работа №5 « Азотсодержащие соединения»
Практическая работа № 7 « Амины. Аминокислоты, Белки»
Практическая работа № 8 «Идентификация органических соединений»
Тема 9. Биологически активные вещества (3 часа)
Закрепить знания об органических и неорганических веществах, входящих в состав клеток и тканей организма, полученные в ходе изучения курса биологии и химии.
Развивать у учащихся умения анализировать, сравнивать, делать обобщения и выводы.
Развивать навыки проведения химического эксперимента.
Тип занятия: практическая работа.
Практическая работа рассчитана на 2 спаренных урока по 45 минут.
1. Персональный компьютер (или ноутбук) для преподавателя
2. Мультимедийный проектор
6. Держатели для пробирок
7. Стаканы химические
1. Пероксид водорода – 3% H 2 O 2
3. Разбавленная серная кислота – 2н H 2 SO 4
4. Соляная кислота – 2н HCl
5. Крахмальный клейстер
6. Спиртовая настойка йода 5%
7. Гидрофосфат натрия – 2н Na 2 HPO 4
8. Хлорид аммония – 0,5н NH 4 Cl
9. Гидроксид аммония – 10% NH 4 OH
10. Хлорид магния – 0,5н MgCl 2
Биологический материал (исследуемые образцы растительного и животного происхождения):
1. Сырой картофель
2. Вареный картофель
5. Скорлупа куриного яйца
1. Организационная часть.
Преподаватель объявляет тему занятия, раскрывает ее связь с другими темами курса.
2. Контроль исходного уровня знаний.
Проводится в виде фронтального опроса, сопровождаемого мультимедийной презентацией:
— Какие макроэлементы входят в состав клетки?
— Какие макроэлементы являются главными компонентами всех органических соединений? Какой процент они составляют от массы клетки?
— В состав каких органических молекул входят сера и фосфор?
— Какие функции выполняют в клетке ионы калия, натрия и хлора?
— Какую роль в организме играет кальций?
— Какова роль железа в организме?
— Какую функцию в организме выполняет гемоглобин?
— Почему угарный газ в отличие от углекислого вызывает отравление организма?
— Какова роль магния в клетках животных?
— Какие вещества называются ферментами? Какое строение имеют ферменты?
— Какую роль магний играет в клетках растений?
— Что такое хлорофилл? В каких органоидах он содержится? В каких процессах обмена веществ участвует?
— Какие элементы относятся к микроэлементам? Какую роль они играют в организме?
— Какие вещества называются гормонами?
— Какое неорганическое вещество содержится в клетке в наибольшем количестве?
— В каких органах и тканях содержание воды наименьшее, а в каких наибольшее?
— Какую роль вода играет в клетке и живом организме в целом?
— Какой процесс называется гидролизом?
— Какие вещества пищи при попадании в организм подвергаются гидролизу?
— В каком состоянии в клетке могут находиться соли?
— Какой процесс называется диссоциацией? Какие вещества подвергаются диссоциации?
— Распределите приведенные вещества по классам: CO, Na 2 HPO 4 , HCl, KHCO 3 , CO 2 , NaH 2 PO 4 , CaCl 2 , CH 3 COOH, NH 4 OH.
— Какие ионы образуются в клетке при диссоциации солей NaCl, CaCl 2 , KHСO 3 ? К какому классу относится последняя соль? Назовите ее.
— Как применяются в медицине NaCl и CaCl 2 ?
— Приведите примеры нерастворимых солей, входящих в состав клетки.
— Какова реакция среды в клетке? Какие ионы поддерживают постоянную слабощелочную реакцию среды в клетке?
— Какая реакция среды в желудке? Какое вещество ее создает? Для чего?
— Какой рН желудочного сока? При каких значениях рН функционирует пепсин желудочного сока?
Если учащийся не может ответить на вопрос, он переходит к следующему ученику. В результате опрошенными оказываются практически все учащиеся.
Далее учащимся предлагается устно выполнить несколько заданий, текст которых высвечивается на слайдах мультимедийной презентации:
1. Установите соответствие:
Ответы: А – 2, Б – 1, В – 4, Г – 2, Д – 4
2. Установите соответствие:
Ответы: А – 4, Б – 3, В – 5, Г – 2, Д – 1
3. Вставьте пропущенные слова:
Жиры – это . вещества клетки, представляющие собой сложные эфиры . и . Жиры относятся к группе . По агрегатному состоянию растительные жиры обычно . а животные — . однако встречаются исключения, например, . имеет животное происхождение, но по агрегатному состоянию . В организме жиры выполняют множество функций. Например, . — жиры входят в состав биологических мембран. Кроме того, жиры препятствуют потере тепла организмом вследствие своей низкой . Верблюдам запас жира позволяет долгое время обходиться без жидкости, так как при . жиров выделяется большое количество воды. Утки смазывают свое оперение секретом, содержащим жиры, в результате их перья приобретают . свойства. В семенах подсолнечника большое количество жиров служит в качестве . для развития зародыша.
Ответы: органические; глицерина; высших жирных карбоновых кислот; липидов; жидкие; твердые; рыбий жир; жидкий; строительную; теплопроводности; окислении; водоотталкивающие; запаса питательных веществ.
4. В приведенном перечне веществ и понятий укажите лишнее:
а). Пепсин, амилаза, мальтоза, липаза.
— Мальтоза, так как это углевод, а все остальные вещества – белки.
б). Вазопрессин, инсулин, глюкагон, тестостерон.
— Тестостерон, так как это гормон, имеющий липидную природу, а все остальные вещества – гормоны белковой природы.
в). Лактоза, гликоген, мальтоза, сахароза.
— Гликоген, так как это – полисахарид, а все остальные углеводы – дисахариды.
г). Миоглобин, тромбин, гемоглобин, натрий-калиевый насос.
— Тромбин, так как он выполняет защитную функцию, а остальные белки транспортную.
д). Фруктоза, рибоза, глюкоза, галактоза.
— Рибоза, так как это пентоза, а все остальные углеводы – гексозы.
е). РНК, АКТГ, ДНК, АТФ.
— АКТГ, так как остальные вещества имеют нуклеотидную природу, а АКТГ – белок.
ж). Кератин, коллаген, эластин, иммуноглобулин.
— Иммуноглобулин, так как это белок, выполняющий защитную функцию, а остальные – строительную.
Другое объяснение: так как иммуноглобулин – это глобулярный белок, а остальные вещества – фибриллярные белки.
з). Фенилкетонурия, галактоземия, болезнь Тея-Сакса, синдром Дауна.
— Синдром Дауна, так как это заболевание вызвано хромосомной мутацией, а все остальные заболевания являются нарушениями обмена веществ.
и). Аденин, урацил, цитозин, тимин.
— Урацил, так как это азотистое основание, которое не входит в состав ДНК.
Другое вариант: тимин, так как это азотистое основание не входит в состав РНК.
5. Назовите химические вещества, входящие в состав клеточной мембраны, обозначенные на рисунке цифрами, и поясните их функцию.
1 – белки (транспортная, рецепторная, каталитическая функция);
2 – фосфолипиды (составляют основу мембраны);
3 – углеводы (обеспечивают узнавание клетки клеткой).
3. Выполнение практической работы.
Учащиеся выполняют работу парами в соответствии с методическими указаниями и заносят результаты в практическую тетрадь. Перед началом работы преподаватель проводит инструктаж по технике безопасности.
Опыт 1. Химические свойства карбоната кальция и его значение для живых организмов.
а). В пробирку поместите 1г скорлупы куриного яйца, добавьте 3 мл соляной кислоты. Запишите наблюдения, составьте уравнение химической реакции.
Основу скорлупы куриных яиц составляет карбонат натрия. При взаимодействии его с кислотой происходит растворение соли и выделение газа:
CaCO 3 + 2HCl —> CaCl 2 + CO 2 
б ). Демонстрационный опыт: поместите сырое куриное яйцо в раствор соляной кислоты на 30 минут. Какие изменения наблюдаете? Сделайте вывод о составе оболочки яйцеклетки курицы и влиянии неорганических солей на ее свойства.
Под действием соляной кислоты оболочка яйцеклетки курицы становится мягкой. Так как основу скорлупы куриного яйца составляет карбонат кальция, можно сделать вывод, что именно он обуславливает твердость скорлупы и обеспечивает ее защитную функцию для клетки.
Опыт 2. Химические свойства фосфата кальция и его значение для живых организмов.
а). В пробирку поместите 0,1г фосфата кальция, добавьте 2 мл серной кислоты. Запишите наблюдения, составьте уравнение химической реакции.
Фосфат кальция составляет основу костной ткани. В результате реакции происходит растворение фосфата кальция в кислоте:
б ). Демонстрационный опыт: поместите куриную кость в раствор соляной кислоты на 6 — 8 часов. Какие изменения наблюдаете? Сделайте вывод о составе костной ткани и влиянии неорганических солей на свойства костей. (Опыт закладывается заранее, учащимся на занятии только демонстрируются полученные результаты).
В состав костей входят неорганические и органические вещества. Неорганические вещества костей представлены в первую очередь нерастворимыми солями (Ca 3 (PO 4 ) 2 и CaCO 3 ). Карбонат кальция придает костям прочность. Органические вещества придают костной ткани эластичность. Под действием соляной кислоты происходит растворение карбоната кальция, в результате чего костная ткань теряет твердость и кость становится гибкой.
Опыт 3. Качественная реакция на фосфат-ион.
В пробирку налейте 2 капли раствора гидрофосфата натрия, добавьте 2 капли раствора хлорида аммония и 2 капли раствора гидроксида аммония, а затем 2 капли раствора хлорида магния. Запишите наблюдения, составьте уравнение химической реакции.
В результате реакции выпадает белый осадок фосфата магния аммония:
Na 2 HPO 4 + MgCl 2 + NH 4 OH —> MgNH 4 PO 4 
Опыт 4. Взаимодействие пероксида водорода с белками клетки.
В четыре пробирки поместите соответственно сырой и вареный картофель, сырое и вареное мясо. В каждую пробирку добавьте по 3 мл пероксида водорода. Какие изменения наблюдаете? Сделайте вывод о влиянии термической обработки на структуру и функции белка каталазы.
В тканях животных и растений содержится фермент каталаза, который катализирует реакцию разложения пероксида водорода:
H 2 O 2 —> O 2 
За счет действия каталазы при добавлении пероксида водорода к сырым мясу и картофелю наблюдается выделение газа.
По своей химической природе все ферменты являются белками. При термической обработке происходит денатурация белков, вследствие чего каталаза теряет свои свойства и разложение пероксида водорода в клетках вареного картофеля и мяса не идет.
Опыт 5. Качественная реакция на крахмал. Обнаружение крахмала в клетках картофеля.
а). В пробирку налейте 1 мл крахмала и добавьте 1 каплю йода. Запишите наблюдения, составьте схему химической реакции. Затем нагрейте пробирку. Какие изменения наблюдаете? Сохраняются ли эти изменения после охлаждения пробирки. Сделайте вывод о влиянии нагревания на смещение равновесия в реакции крахмала с йодом.
В результате реакции образуется соединение сине-фиолетового цвета:
I 2 + крахмал — сине-фиолетовое окрашивание
При нагревании пробирки происходит исчезновение окраски, а при охлаждении вновь ее появление, что указывает на обратимость реакции взаимодействия крахмала с йодом.
б). Возьмите ломтик сырого картофеля и капните на него 1 каплю йода. Какие изменения наблюдаете? Сделайте вывод о химическом составе клеток картофеля.
Под действием йода происходит появление сине-фиолетового окрашивания, что указывает на содержание в клетках клубня картофеля крахмала, который запасается там в виде крахмальных зерен.
Преподаватель в процессе беседы выясняет, какие у учащихся были трудности в ходе выполнения практической работы, предлагает им оценить эффективность своей работы на занятии и достигнутые результаты.
Проводится в форме ситуационных задач.
1. Известно, что кислотные дожди оказывают негативное воздействие на растения и животных, вызывая повреждения их тканей. Предположите, с чем связано негативное действие кислотных дождей на яйца птиц. Составьте уравнения соответствующих реакций, принимая во внимание, что кислотные дожди вызываются наличием в атмосфере оксида серы (IV) и оксида азота (IV).
При взаимодействии оксида серы (IV) и оксида азота (IV) с водой образуются кислоты:
Твердость скорлупы птичьих яиц обусловлена наличием в ней карбоната кальция, который растворяется в кислой среде с выделением углекислого газа:
CaCO 3 + 2HNO 3 —> Ca(NO 3 ) 2 + CO 2 
Таким образом, после воздействия кислотных дождей скорлупа яйца размягчается и не обеспечивает больше надлежащей защиты развивающемуся зародышу.
2. Известно, что тяжелые металлы вызывают нарушения в работе нервной системы, печени, почек и других органов. Объясните с точки зрения химического состава клетки, в чем состоит негативное воздействие на нее тяжелых металлов.
Тяжелые металлы вызывают необратимое осаждение белков, в результате чего белки перестают выполнять свои функции в клетке.
3. Основу препаратов “Мезим”, “Креон”, “Панзинорм” составляет панкреатин, представляющий собой экстракт содержимого поджелудочной железы. В состав панкреатина входят липаза, амилаза, трипсин, химотрипсин. Предположите, какое действие будет оказывать на организм данный препарат.
Препараты “Мезим”, “Креон”, “Панзинорм” нормализуют процессы пищеварения, так как в их состав входят ферменты, расщепляющие органические вещества пищи.
4. Для лечения повышенного артериального давления применяются препараты, относящиеся к фармакологической группе “блокаторы медленных кальциевых каналов”. Яркими представителями данной группы являются: “Кордафлекс”, “Кальцигард”, “Амлодипин”. Предположите, на чем основано действие препаратов данной группы на организм.
Препараты данной фармакологической группы уменьшают поступление ионов кальция в клетку. Ионы кальция влияют на сокращение гладкой и поперечнополосатой мускулатуры, в том числе сердечной мышцы, и как следствие, на артериальное давление.
5. Для уменьшения кислотности желудочного сока при гастрите и язвенной болезни желудка применяются препараты антацидной фармакологической группы, например, “Альмагель”, “Маалокс”, “Гастал”. В состав этих препаратов входят гидроксиды алюминия и магния, а также карбонат магния. Объясните, на чем основано действие этих препаратов на организм, составьте уравнения соответствующих реакций.
Препараты антацидной группы нейтрализуют соляную кислоту в желудке, снижая тем самым уровень кислотности.
MgCO 3 + 2HCl —> MgCl 2 + CO 2 
6. Подведение итогов.
Преподаватель выставляет оценки за занятие, комментирует полученные результаты. Учащиеся сдают тетради с оформленными результатами работы.
http://www.chem.msu.su/rus/teaching/eremin/5.html
http://infourok.ru/algoritm-resheniya-zadach-po-teme-skorost-himicheskih-reakciy-3719021.html