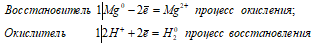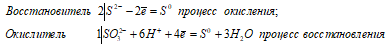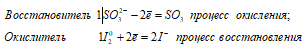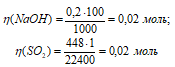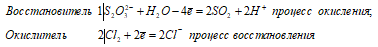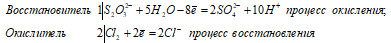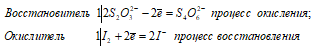Характеристика окислительно-восстановительных свойств сернистой кислоты
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
Mg 0 + 2H + = Mg 2+ + H2 0
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
2S 2- + SO3 2 — + 6H + ↔ 3S 0 + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
Находим количество NaOH и SO2:
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na 2SO 3) = M( Na 2SO 3) . n( Na 2SO 3) = 126 . 0,01 = 1,26 г.
Ответ: m( Na 2SO 3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
S2O3 2- + 2Cl2 0 + H2O ↔ 2SO 2 ↑ + 4Cl — + 2H +
Na 2 S 2 O 3 + 2Cl 2 + H 2 O ↔ 2NaCl + 2SO 2 ↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
S2O3 2- + 4Cl2 0 + 5H2O ↔ 2SO4 2- + 8C l- + 10H +
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ + 2H 2 SO 4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2 Na 2 S 2 O 3 + I 2 ↔ Na 2 S 4 O 6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H 2 S 4 O 6 .
Помогите пжлстсоставьте полные и сокращенные ионные уравнения реакций взаимодействия so2 и h2so3 с водой, основными оксидами, основаниями, растворимыми солями?
Химия | 5 — 9 классы
составьте полные и сокращенные ионные уравнения реакций взаимодействия so2 и h2so3 с водой, основными оксидами, основаниями, растворимыми солями.
SO2 + H2O = H2SO3
SO2 + H2O = 2H[ + ] + SO3[2 — ]
SO2 + CaO = CaSO3
SO2 + 2NaOH = Na2SO3 + H2O
So2 + 2Na[ + ] + 2OH[ — ] = 2Na[ + ] + SO3[2 — ] + H2O
SO2 + 2OH[ — ] = SO3[2 — ] + H2O
H2SO3 + MgO = MgSO3 + H2O
H2SO3 + MgCl2 = MgSO3 + 2Hcl
2H[ + ] + sO3[2 — ] + Mg[2 + ] + 2Cl[ — ] = MgSO3 + 2H[ + ] + 2Cl[ — ]
Mg[2 + ] + So3[2 — ] = MgSO3
H2SO3 + 2NaOH = Na2SO3 + 2H2O
2H[ + ] + SO3[2 — ] + 2Na[ + ] + 2OH[ — ] = 2Na[ + ] + SO3[2 — ] + 2H2O
2H[ + ] + 2OH[ — ] = 2H2O.
Составте полное и сокращеное ионное уравнение реакций взаимодействия SO2 и aH2SO3 с водой, основными оксидами, основаниями, растворами солями?
Составте полное и сокращеное ионное уравнение реакций взаимодействия SO2 и aH2SO3 с водой, основными оксидами, основаниями, растворами солями.
Назовите продукты этих реакций.
1. Основание образется при взаимодействии с водой оксида, формула которого : 1)Fe2P3 3)CaO 2)CuO 4)FeO Ответ : ?
1. Основание образется при взаимодействии с водой оксида, формула которого : 1)Fe2P3 3)CaO 2)CuO 4)FeO Ответ : .
Запишите уравнение реакции 2.
С Гидроксидом натрия реагирует : 1)CaO 3)SiO2 2)N2O 4)P2O5 Ответ : .
3. Составьте уравнения возможных реакций.
1)Молекулярное уравнение : Полное ионное уравнение : Сокращенное ионное уравнение : 2)Молекулярное уранение : Полное ионное уравнение : Сокращенное уравнение : 4.
С соляной кислотой реагирует : 1)Оксид железа(III) 3)Оксид кремния (IV) 2)Оксид серы(VI) 4)Оксид меди(II) Ответ : .
5. Составьте уравнения возможных реакций : 1)Молекулярное уранение : Полное ионное уравнение : Сокращенное ионное уравнение : 2)Молекулярное уранение : Полное ионное уранение : Сокращенное ионное уранение : 6.
Запишите по одному уравнению реакций соединения и разложения для получения : 1)Оксида меди (II) 2)Оксида кремния(IV).
Допишите уравнение реакции и составьте полное и сокращенное ионное уравнение?
Допишите уравнение реакции и составьте полное и сокращенное ионное уравнение.
Помогите пожалуйста?
Гидроксид лития LiOH имеет основный характер и является основание — щелочью.
Взаимодействует ( напишите уравнения возможных реакций в молекулярной, полной и сокращенной ионной формах) :
б) с солью, если «стрелочка вверх»
в) с солью, если «стрелочка вниз»
г) с кислотным оксидом.
Составить уравнение реакций : кислотный оксид + основной оксид : соль + соль : основание + соль?
Составить уравнение реакций : кислотный оксид + основной оксид : соль + соль : основание + соль.
Составьте уравнение реакции в молекулярном виде к реакциям обмена составьте полное и сокращенное ионное уравнение?
Составьте уравнение реакции в молекулярном виде к реакциям обмена составьте полное и сокращенное ионное уравнение.
Помогите пожалуйста сделать полное ионое и неполное ионое уравнение Типичные реакции основных оксидов 1 Основный оксид + кислота = соль + вода (реакция обмена) 3Na2O + 2H3PO4 = 2Na3PO4 = 3H2O 2 Основн?
Помогите пожалуйста сделать полное ионое и неполное ионое уравнение Типичные реакции основных оксидов 1 Основный оксид + кислота = соль + вода (реакция обмена) 3Na2O + 2H3PO4 = 2Na3PO4 = 3H2O 2 Основный оксид + Кислотный оксид = соль (реакция соединения) CaO + N2O5 = Ca(NO3)2 3 Основный оксид + ВОДА = ЩЕЛОЧИ (реакция соединения) К2О + Н2О = 2КОН Типичные реакции кислотных оксидов 1 Кислотные оксиды + основания = соль + вода (реакция обмена) SO2 + 2NaOH = Na2SO3 + H2O 2 Кислотный оксид + Основный оксид = соль (реакция соединения) K2O + SO3 = K2SO4 3 Кислотный оксид + ВОДА = ЩЕЛОЧИ (реакция соединения) N2O5 + H2O = 2HNO3 пожалуйста очень срочно.
Решите молекулярные полные и сокращенные ионные уравнения взаимодействия орфографичний кислоты с оксидом кальция?
Решите молекулярные полные и сокращенные ионные уравнения взаимодействия орфографичний кислоты с оксидом кальция.
Основный оксид + кислотный оксид = соль (2 примера) ; кислотный оксид (растворимый) + вода = кислота ; кислотный оксид + основание = соль + вода?
Основный оксид + кислотный оксид = соль (2 примера) ; кислотный оксид (растворимый) + вода = кислота ; кислотный оксид + основание = соль + вода.
ДОПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ И СОСТАВЬТЕ ПОЛНОЕ И СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ : KOH + CuCI =?
ДОПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ И СОСТАВЬТЕ ПОЛНОЕ И СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ : KOH + CuCI =.
Вы находитесь на странице вопроса Помогите пжлстсоставьте полные и сокращенные ионные уравнения реакций взаимодействия so2 и h2so3 с водой, основными оксидами, основаниями, растворимыми солями? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 — 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
Щелочноземельный металл. Валентность II Значит формула сульфата щелочноземельного металла будет MeSO4 формула для нахождения массовой доли элемента будет : W = nAr / Mr n — число атомов элементов в молекуле Ar — атомная масса элемента Mr — молекуляр..
Формула МеSO4 Пусть масса соединения 100г Тогда масса серы — 100 * 0. 266 = 26. 6 г Моль серы = 26. 6 / 32 = 0. 83 моль Моль О = 0. 83 * 4 = 3. 32 моль Масса О = 3. 32 * 16 = 53. 12 г Масса металла = 100 — 53. 12 — 26. 6 = 20. 28 г Моль ме..
Cl2 + 2H2O + SO2→ 2HCl + H2SO4. CL2(0) + 2e = 2CL( — ) 1 окислитель процесс восстановления S( + 4) — 2e = S( + 6) 1 восстановитель процесс окисления.
2cu + o2 = 2cuo или 2h2 + o2 = 2h2o 4li + o2 = 2li2o 4al + 3o2 = 2al2o3 минимально возможная сумма коэффициентов 3 два реагента и один продукт например c + o2 = co2 или s + o2 = so2 конечно сумма коэффициентов может быть четной например na2o + h2o = ..
Cl₂ Br₂ I₂ F₂ Вроде бльше нет Всегда пишутся отдельно так, если ввещ — ве, например Ca²⁺Cl₂⁻ то здесь двойка из — за степени окисления кальция.
1. m(в — ва) = m(р — ра) * n = 450 * 20% = 90 грамм m(H2O) = m(р — ра) — m(в — ва) = 450 — 90 = 360 грамм 2. 90 + 30 = 120грамм (в — ва(2)) 360 + 120 = 480грамм (раствора(2)) n = m(в — ва(2)) / m(раствора(2)) = (120 / 480) * 100% = 25%.
Ответ 3 Fe3(PO4)2 Mr = 3Fe + 2P + 😯 = 168 + 62 + 16 * 8 = 358 w (3Fe) = m элемента / m вещества = 168 / 358 = 0. 47 = 47% w(2P) = 0. 17 = 17% w(8O) = 0. 36 = 36%.
Азотная кислота — HNO3 Серная кислота — H2SO4.
ZnCl2 + Na2S = ZnS + 2NaCl.
1. C4H8 + H2 = C4H10 Бутен + водород = бутан 2. C4H10 + Cl2 = C4H9Cl + HCl Бутан + хлор = хлорбутан + хлороводород 3. 2C4H9Cl + 2Na = C8H18 + 2NaCl Хлорбутан + натрий = октан + хлорид натрия 4. C8H18 + 12. 5O2 = 8CO2 + 9H2O Октан + кислород = угл..
Сернистая кислота: строение и химические свойства
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
HSO3 – ↔ SO3 2– + H +
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
3. Сернистая кислота взаимодействует с сильными основаниями и их оксидами.
Например , сернистая кислота реагирует с гидроксидами натрия и калия:
4. Наиболее ярко выражены восстановительные свойства сернистой кислоты. При взаимодействии с окислителями степень окисления серы повышается.
Например , сернистая кислота обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистую:
Озон также окисляет сернистую кислоту:
Качественная реакция на сернистую кислоту – обесцвечивание раствора перманганата калия:
5. В присутствии сильных восстановителей сернистая кислота может проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистая кислота восстанавливается до молекулярной серы:
http://himia.my-dict.ru/q/4074850_pomogite-pzlstsostavte-polnye-i-sokrasennye-ionnye/
http://chemege.ru/sernistaya-kislota/