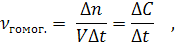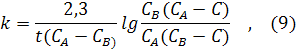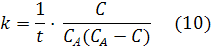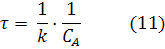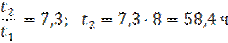Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df6812cda797169 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Методические рекомендации к теме
Раздел химии, изучающий скорости и механизмы протекания реакций, называется химической кинетикой. Главными вопросами этой темы являются закон действия масс и химическое равновесие. Hеобходимо знать, что понимают под скоростью гомогенной и гетерогенной реакции, от каких факторов она зависит, что такое химическое равновесие, когда оно наступает в обратимых реакциях, уметь применять принцип Ле Шателье к различным обратимым процессам. Учение о скорости химической реакции и о химическом равновесии имеет огромное практическое значение, так как позволяет управлять химическими процессами на производстве. При рассмотрении вопроса о скорости реакций необходимо различать гомогенные и гетерогенные реакции. Гомогенная реакция протекает во всем объеме системы, а гетерогенная реакция протекает на поверхности твердого вещества (фазы). Поэтому определения скорости гомогенной и гетерогенной реакций различны. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы:
где vгомог. – скорость гомогенной реакции, моль/л; n – количество вещества, моль; V – объем системы, л; t – время; С – концентрация, моль/л.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
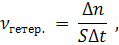
Скорость химической реакции зависит от следующих факторов: 1. Природа реагентов. Здесь большую роль играет характер химических связей в соединениях, строение их молекул. Например, выделение водорода цинком из раствора соляной кислоты происходит значительно быстрее, чем из раствора уксусной кислоты (СН3СООН), так как полярность связи H — Cl больше, чем для связи О — Н в молекуле СН3СООН. 2. Концентрация реагирующих веществ. Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс: скорость элементарной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед формулами веществ в уравнении реакции. Для реакции 2NO + O2 = 2NO2 кинетическое уравнение согласно закону действующих масс имеет вид: v = k C 2 (NO) · C(O2) , где v — скорость реакции; С(NO) и C(О2) — концентрации оксида азота (II) и кислорода, моль/л; k – константа скорости данной реакции. В случае гетерогенных реакций,Гетерогенные реакции протекают на границе (поверхности) раздела фаз, например между веществами, находящимися в жидкой и твердой фазах. имеющих большое значение в технике (горение твердого топлива, коррозия металлов и т.д.), скорость процесса возрастает при увеличении поверхности контакта фаз. Для этого используют измельчение твердой фазы. В кинетическом уравнении для гетерогенной реакции концентрация твердой фазы не учитывается. Например, для горения углерода C(т) + O2(г) → CO2(г) выражение закона действующих масс выглядит следующим образом: v = k · С(O2). Разумеется, характеристики твердого веществаПод характеристиками твердого вещества здесь понимаются его химическая природа (состав), форма и размеры частиц, дефекты кристаллической структуры и т.д. влияют на скорость реакции, но это влияние отражается величиной константы скорости k. Сумма показателей степеней в кинетическом уравнении называется порядком реакции. Так для реакции А = Д + В кинетическое уравнение имеет вид: ν = — ΔС/Δ t = k ∙ CA, где k – константа скорости, СA – концентрация исходного вещества A. Так как показатель степени С равен единице, то данная реакция является реакцией первого порядка (мономолекулярная). Прологарифмировав данное уравнение, получают зависимость константы скорости от времени реакции:
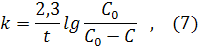
где СA и СВ –начальные концентрации или количества веществ А и В; С–прореагировавшее количество; (СА – С) и (СВ – С) – конечные концентрации, t – время реакции. Если СA = СВ , то
Период полупревращения (для случая равных начальных концентраций):
Следует помнить, что молекулярность и порядок реакции совпадают для элементарных реакций, проводимых при близких концентрациях исходных веществ. 3. Температура реакции. Зависимость скорости реакции от температуры передается уравнением Вант-Гоффа
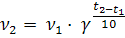
где v1 и v2 — скорости реакции при температурах t1 и t2 cоответственно; γ — температурный коэффициент скорости реакции (для многих реакций γ = 2. 4). Это правило говорит о том, что скорость реакций возрастает в 2 — 4 раза при увеличении температуры на 10 °С. Для более точных расчетов кинетических параметров реакций в зависимости от температуры используют уравнение Аррениуса:
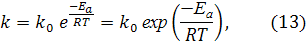
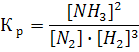
где [NH3], [N2] и [H2] − равновесные концентрации аммиака, азота и водорода соответственно; Кр – константа равновесия. Константа равновесия – это постоянная величина, показывающая во сколько раз скорость прямой реакции больше скорости обратной реакции. Если Кр >1 в системе протекает прямая реакция, если Кр . lg[1/(1-С)]; 0,5/2,3 = −lg(1-С); С = 0,39 моль/л; 3) Для реакции, протекающей по второму порядку, согласно уравнению (10): 0,5 = 1/1 . [С/1(1-C)]; 0,5 = C/(1-C); C= 0,33моль/л. Расчеты показали, чем выше порядок, тем меньше степень превращения, тем медленнее идет реакция. 
Задача 5. 
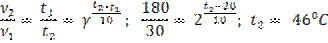
Задача 6. 
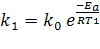
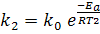
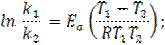
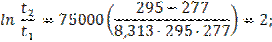
Задача 7. 
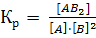
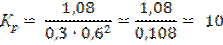
| Концентрации | Вещества, участвующие в реакции | ||
| А | В | АВ2 | |
| Исходные (было) Сисх | ? | ? | — |
| Израсходованные (вступило в реакцию) Сизрасх | 0,108моль/л | 0,216 моль/л | — |
| Равновесные (осталось) [ ] | 0,3 моль/л | 0,6 моль/л | 0,108 моль/л |
Из таблицы ясно, рассчитать исходные концентрации реагентов необходимо сложить израсходованные и равновесные концентрации: Сисх(A) = Сизрасх(A) + [A] = 0,108 + 0,3 = 0,408 моль/л Сисх(В) = Сизрасх(В) + [В] = 0,216 + 0,6 = 0,816 моль/л Необходимо помнить, что в расчетах по уравнению реакции можно рассчитыватьиспользовать израсходованные концентрации реагентов и равновесные продуктов, т.е. выделенный сектор таблицы.
Задача 8. 

2) Составляем таблицу и вносим в нее данные
| Концентрации | Вещества, участвующие в реакции | ||
| NO | O2 | NO2 | |
| Исходные (было) Сисх | 4,2 моль/л | 2,25 моль/л | — |
| Израсходованные (вступило в реакцию) Сизрасх | ? | 0,45 моль/л | — |
| Равновесные (осталось) [ ] | ? | ? | ? |
По уравнению реакции рассчитываем израсходованную концентрацию NO и равновесную продукта NO2: n (NО) = 2 n(O2) = 2 · 0,45 = 0,9 моль; n (NО2) = 2 n(O2) = 2 · 0,45 = 0,9 моль Следовательно, Сизрасх (NО) = 0,9 моль/л; [NО2] = 0,9 моль/л. 4) Равновесные концентрации реагентов рассчитаем как разницу между исходными и израсходованными концентрациями: [NО] = Сисх(NО) — Сизрасх(NО) = 4,2 – 0,9 = 3,3 моль/л; [О2] = Сисх(О2) — Сизрасх(О2) = 2,25 – 0,45 = 1,8 моль/л.
4.4 Практическое занятие № 3 «Скорость реакции и методы ее регулирования. Закон действующих масс»
Цель: разобраться в закономерностях влияния концентрации реагирующих веществ и температуры на скорость реакции, отработка навыков расчетов скорости химических реакций при изменении температуры, концентрации реагирующих веществ, энергии активации реакций. Вопросы для обсуждения: 1. Что изучает химическая кинетика? Какие процессы называются гомогенными и гетерогенными? 2. Что понимают под средней скоростью гомогенной и гетерогенной реакций? 3. Является ли скорость реакции величиной постоянной для данного процесса? Можно ли по данным величинам скоростей реакций (при одинаковых условиях) судить о быстроте того или иного процесса? От каких факторов зависит скорость химической реакции? 4. Дайте формулировку закона действующих масс. Приведите его математическое выражение на примере реакции окисления оксида серы (IV) в оксид серы (VI). Что такое константа скорости реакции? Что она характеризует? От каких внешних факторов зависит? 5. Сравните понятия «молекулярность» и «порядок» реакции. Выразить математически скорость следующих химических реакций, определить молекулярность и суммарный порядок каждой реакции: 1) СаО (тв) + СО2 (г) ®СаСО3 (тв) 2) 2NO + O2®2NO2 6. Какие реакции называются реакциями первого порядка. Каким уравнением они описываются? Что такое период полураспада? 7. Математическое выражение закона Вант-Гоффа. Физический смысл температурного коэффициента. 8. В чем сущность теории Аррениуса, описывающей влияние температуры на скорость реакции? Что такое энергия активации? Зависимость между энергией активации и скоростью химической реакции. 9. Что такое катализатор? В чем суть его действия для гомогенного катализа? В чем заключается селективность катализатора? 10. В чем особенность гетерогенного катализа? Примеры. Упражнения и задачи для закрепления материала и отработки навыков: 1. Во сколько раз следует увеличить давление газовой смеси, чтобы скорость тримолекулярной реакции 2 NO(г)+О2(г) = = 2 NO2(г) увеличилась в 1000 раз? 2. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, — 29,7 года. Через какое время количество этого изотопа составит менее 10% исходного? 3. Во сколько раз необходимо увеличить концентрацию вещества А, чтобы при уменьшении концентрации вещества В в четыре раза скорость реакции 2 А (г) + В (г) = С (г) не изменилась? 4. Вычислите температурный коэффициент скорости реакции, если константа скорости ее при 100 о С составляет 2,5∙10 -6 , а при 150 о С – 2 . 10 -4 . 5. Во сколько раз увеличится скорость атмосферной коррозии металлической конструкции при повышении температуры воздуха с 20 до 30 0 С, если температурный коэффициент равен 2? 6. Какой должна быть энергия активации, чтобы скорость реакции увеличивалась в три раза при возрастании температуры с 300 К до 500 К?
4.5 Тесты для самоконтроля Тест 1 1. Укажите гомогенную систему: 1) СаСО3 ® СаО + СО2 2) СО2 + С = 2СО 3) 2СО + О2 ® 2СО2 4) С + О2 = СО2 2. Укажите правильное кинетическое уравнение для системы: 2Fe + 3Cl2® 2FeCl3 1) ν = k [Fe] 2 [Cl2] 3 2) ν = k [3Cl2] 3) ν = k [2Cr] [3Cl2] 4) ν = k [Cl2] 3 3. Если реакция при 25 0 С заканчивается за 16 секунд, а при 55 0 С за 2 сек, то температурный коэффициент скорости реакции равен 1) 2 2) 0,5 3) 2,67 4) 8 4. Увеличение скорости реакции под действием катализатора происходит в результате… 1) уменьшения концентрации реагентов 2) увеличения температуры3) уменьшения энергии активации 4) увеличения концентрации реагентов 5. При увеличении концентрации кислорода в 3 раза скорость реакции
4NH3 + 3O2 ↔ 2N2 + 6H2O при условии ее элементарности увеличится в ____ раз 1) 27 2) 9 3) 81 4) 18 6. Скорость химической реакции характеризует: 1) изменение количеств веществ за единицу времени в единице объёма или единице площади; 2) время, за которое заканчивается химическая реакция; 3) число структурных единиц вещества, вступивших в химическую реакцию; 4) движение молекул или ионов реагирующих веществ относительно друг друга. 7. Системы, в которых существуют поверхности раздела, отделяющие друг от друга части системы, различающиеся по свойствам, называются .…. 1) гетерогенными 2) гомогенными 3) изолированными 4) открытыми 8. Скорость какой реакции не зависит от концентрации реагирующих веществ 1) 2НCl → H2 + Cl2 2) CuO + C → Cu + CO 3) CO2 + C → 2CO 4) 2Cu + O2 → 2CuO 9. Для смещения равновесия в системе 2NOCl(г) ↔ 2NO(г)_+ 2Cl2(г), ΔH > 0, в сторону исходного вещества необходимо 1) ввести катализатор 2) уменьшить давление 3) уменьшить температуру 4) увеличить температуру 10. Выберите верное соотношение между энергиями активации двух реакций, если константа скорости одной реакции (k1) больше константы скорости другой реакции (k2) 1) E1 > E2 2) E1 0 до 50 0 С скорость реакции 1) уменьшится в 2 раза 2) уменьшится в 4 раза 3) увеличится в 8 раз 4) увеличится в 6 раз 2. При уменьшении объема в 2 раза скорость химической реакции 2СO + O2 = 2СO2 1) увеличится в 8 раз 2) увеличится в 2 раза 3) уменьшится в 2 раза 4) уменьшится в 8 раз 3. Если образец магния растворяется в серной кислоте при 35 0 С за 12 мин, а при 55 0 С за 3 минуты, то температурный коэффициент равен 1) 2,5 2) 3 3)2 4) 4 4. Системы, внутри которых нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам, называются .…. 1) гетерогенными 2) гомогенными 3) изолированными 4) открытыми 5. Сумма показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентраций, называется .…. 1) молекулярностью 2) остепененностью 3) порядком 4) атомностью 6. Введение катализатора в реакционную систему 1) уменьшает скорость реакции 2) увеличивает энергию активации реакции 3) снижает энергию активации реакции 4) смещает химическое равновесие 7. Константа скорости реакции зависит от 1) изменения давления 2) изменения объема реакционного сосуда 3) изменения концентрации реагирующих веществ 4) изменения температуры 8. Увеличение скорости реакции с повышением температуры связано 1) с увеличением кинетической энергии молекул 2) с возрастанием числа активных молекул 3) с ростом числа столкновений 9. Скорость реакции N2 + 3H2 → 2NH3 возрастает при 1) увеличении концентрации азота 2) уменьшении концентрации азота 3) увеличении концентрации аммиака 4) понижении температуры 10. При повышении температуры в системе PCl5(г) → PCl3(г) + Cl2(г), ΔН>0, равновесие 1) не сместится 2) сместится в сторону исходных веществ 3) сместится неоднозначно 4) сместится в сторону продуктов
4.6 Лабораторная работа №2 «Смещение химического равновесия»Цель работы: практически изучить влияние различных факторов на направление смещения химического равновесия. Оборудование и реактивы: микрошпатель, склянки с растворами реактивов, штатив с набором конических пробирок. Реактивы: растворы хлорида железа (III) FeCl3, роданида калия КSCN , кристаллические хлорид железа (III), роданид калия, хлорид калия КCl, ацетат натрия СH3СООNа, хлорид аммония NH4Cl, растворы йода, крахмала, хромата калия K2CrO4, дихроматa калия К2Сг2О7, гидроксида калия КОН, серной кислоты Н2SО4, уксусной кислоты СН3СООН, гидроксида аммония NН4OH, индикаторы: метилоранж и фенолфталеин. Выполнение работы. Опыт 1. Смещение химического равновесия при изменениях концентраций участвующих в реакции веществ. Возьмите четыре пробирки. В одну из них налейте приблизительно одну треть пробирки раствора хлорида железа (III) и добавьте равный объем раствора роданида калия. Раствор перемешайте. Получите равномерно окрашенный в красноватый цвет исходный раствор роданида железа (III). Разлейте полученный раствор приблизительно поровну по всем четырем пробиркам, одну пробирку сохраните в качестве контрольной для сравнения. В растворе протекает обратимая реакцияFeCl3 + 3KSCN ↔ Fe(SCN)3 + 3KCl красный Роданид железа (III) придает раствору красную окраску, по изменению интенсивности окраски раствора можно судить о направлении смещения химического равновесия при изменении концентрации какого — либо из веществ. Во вторую пробирку добавьте микрошпателем кристаллик FeCl3, в третью — кристаллик KSCN, в четвертую — несколько кристалликов КС1. Отметьте изменение интенсивности окраски в каждом случае, сравнивая с раствором в контрольной пробирке. Заполните таблицу 3. Напишите выражение константы равновесия данного обратимого процесса. Объясните смещение равновесия при изменении концентрации реагирующих веществ, применив принцип Ле Шателье.
Таблица — 3.Смещение химического равновесия при изменениях концентраций веществ
| Номер пробирки | Добавленное вещество | Положение вещества в уравнении реакции (справа-слева) | Изменение интенсивности окраски | Направление смещения равновесия |
| Контроль | ||||
| FeCl3 | ||||
| KSCN | ||||
| КС1 |
Опыт 2. Влияние изменения температуры на смещение химического равновесия. Налейте приблизительно ½ пробирки раствора крахмала, добавьте две капли раствора йода. Наблюдайте появление синей окраски. После перемешивания отлейте половину раствора в другую пробирку. Нагрейте одну из них в пламени спиртовки, не доводя до кипения. Наблюдайте изменение окраски раствора. Затем охладите эту же пробирку. Снова наблюдается появление синей окраски. При взаимодействии крахмала с йодом образуется сложное соединение синего цвета (йод — крахмал). Эта реакция экзотермическая, ее можно представить следующей схемой: Йод + Крахмал ↔ Йод — Крахмал – Q Объясните изменение окраски и смещение равновесия при нагревании, охлаждении, исходя из принципа Ле Шателье. Опыт 3. Смещение химического равновесия при изменении реакции среды. Взять 2 пробирки. В 1-ю пробирку прилить 4 капли бихромата калия, во 2-ю – 4 капли хромата калия. Обратите внимание на исходную окраску каждого раствора. В 1-ю пробирку добавьте 2 капли гидроксида калия, во 2-ю – 2 капли раствора серной кислоты. Как изменяется цвет растворов? Сделайте вывод о смещении равновесия на основании уравнения реакции 2 CrO4 2- + 2H + « Cr2O7 2- + H2O желтый оранжевый Составьте молекулярные уравнения реакций, происходящих в первой и второй пробирках. Опыт 4. Изучение смещения химического равновесия в растворах индикаторов под действием реакции среды В пробирку налить 2 мл дистиллированной воды и добавить 1 – 2 капли метилоранжа. Отметить окраску раствора. Отлить раствор в 2 пробирки и добавить в первую 2 капли гидроксида калия, во вторую 2 капли соляной кислоты, а третью оставить для сравнения окраски. То же самое проделать с индикатором фенолфталеином. Результаты наблюдений занести в таблицу 4. Таблица 4 – Смещение равновесия в растворе индикатора
| № опыта | Добавляемый реактив | Цвет индикатора | Ион, смещающий равновесие |
| метилоранж | фенолфталеин | ||
| КОН | |||
| Н2SO4 | |||
| Н2О |
Рассмотрите равновесие типа «красный ↔ желтый» для метилоранжа, «бесцветный ↔ малиновый» для фенолфталеина. Анализируя таблицу, сделайте вывод, какие ионы влияют на смещение равновесия с изменением цвета индикатора? Какова возможная природа индикаторов? Опыт 5. Изучение смещения равновесия в растворах слабых электролитов под действием одноименного иона. В две пробирки налить по 3 капли разбавленного раствора уксусной кислоты и по одной капле раствора индикатора — метилоранжа.В одну из пробирок внести микрошпателем несколько кристаллов ацетата натрия и хорошо перемешать. Вторую пробирку оставить для сравнения. В две пробирки налить по 3 капли разбавленного раствора гидроксида аммония и по одной капле раствора индикатора – фенолфталеина. В одну из пробирок внести микрошпателем несколько кристаллов хлорида аммония и хорошо перемешать. Вторую пробирку оставить для сравнения. Составьте уравнения диссоциации уксусной кислоты и гидроксида аммония и дайте объяснение наблюдаемым явлениям на основании принципа Ле Шателье. Составьте выражения для констант диссоциации СН3СООН и NH4OH. В заключение работы сделайте общий вывод о влиянии изученных факторов на направление смещения химического равновесия. Задание к защите: Для предложенной преподавателем реакции рассмотреть влияние различных факторов на направление смещения химического равновесия: 1) температуры, 2) давления, 3) изменения концентрации продуктов и реагентов, 4) указать условия, при которых можно добиться большего выхода продуктов реакции, 5) Составить выражение для константы равновесия. Варианты заданий: 1) H2(г) + Сl2(г) « 2HCl(г) + Q 2) 2CO(г) + O2(г) ↔ 2СО2(г) + Q 3) N2(г) + O2(г) ↔ 2NO(г) — Q 4) 2H2(г) + О2(г) ↔ 2Н2О(г) + Q 5) СаСО3(к) ↔ СаО(к) + СО2(г) – Q 6) С(графит) + СО2(г) ↔ 2СО(г) – Q 7) N2(г) + 3Н2(г) ↔ 2NН3(г) + Q 8) 2РН3(г) + 4О2(г) ↔ Р2О5(к) + 3Н2О(г) 9) А2(г) + 2В2(г) ↔ 2АВ2(г) + Q 10) 2ВС2(г) ↔ В2(г) + 2С2(г) — Q
Тема 5. «Растворы. Концентрация растворов»
5.1 Содержание программы Понятие дисперсных систем и растворов. Растворимость веществ. Физико-химическая теория растворов. Сольваты, гидраты. Способы выражения состава растворов.
Уровень теоретической и практической подготовки Студент должен знать классификацию дисперсных систем, усвоить понятия «сольватация» и «гидратация», основные способы выражения количественного состава растворов. Студент должен уметь выполнять расчеты: навесок (объемов) для получения раствора заданной концентрации или заданного объема; концентраций по известному количеству компонентов; по переводу одних способов выражения концентраций в другие. Студент должен владеть навыками взвешивания веществ на технических весах и работы с лабораторным оборудованием, техникой измерения объемов жидкостей с необходимой точностью, измерения плотности растворов ареометром.
Химическая кинетика. Химическое равновесие
4. Напишите кинетические уравнения следующих реакций:
б) 2NOCl(г) = 2NO(г) + Cl2(г)
Объясните причину несовпадения молекулярности и порядка реакции.
Решение.
Кинетические уравнения отражают взаимосвязь между концентрациями исходных веществ, находящихся в одной фазе, и скоростью реакции. Теоретической основой для написания кинетических уравнений является закон действующих масс (ЗДМ), согласно которому скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях, равных их стехиометрическим коэффициентам. В соответствии с ЗДМ кинетические уравнения рассматриваемых реакций выглядят следующим образом:
V=k*C(O2), где V – скорость реакции, k – константа скорости реакции, C(O2) – концентрация кислорода, моль/л
V=k*C(NOCl) 2 , где V – скорость реакции, k – константа скорости реакции, C(NOCl) – концентрация NOCl, моль/л
V=k*C(C12H22O11)*C(H2O), где V – скорость реакции, k – константа скорости гидролиза сахарозы C12H22O11, C(C12H22O11) – концентрация сахарозы в водном растворе ,моль/л, С (Н2О) –концентрация воды, моль/л.
V=k*C(NO) 2 *C(H2), где V – скорость реакции, k – константа скорости, C(NO) – концентрацияNO,моль/л, С (Н2) –концентрация водорода, моль/л.
1.Причина несовпадения молекулярности и порядка реакции
Молекулярность реакции определяется числом частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) реакции и превращающихся в продукты.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Основными причинами несовпадения молекулярности и порядка реакции могут являться: простое несовпадение ( поскольку молекулярность- характеризует механизм, а порядок — кинетику реакции),
наличие избытка одного из исходных веществ, гетерогенность реакции, ее ступенчатый характер.
5. Установите, как изменится скорость химической реакции
а) уменьшить объем реакционной смеси в 2 раза;
б) уменьшить давление в 2 раза;
в) увеличить концентрации исходных веществ в 2 раза.
Решение.
Составим кинетическое уравнение реакции:
2.После уменьшения объема реакционной смеси в 2 раза концентрации реагентов увеличатся тоже в два раза. Тогда кинетическое уравнение примет вид:
Как видно из расчетов, после уменьшения объема реакционной смеси в 2 раза скорость реакции возрастет в 8 раз.
Уменьшение давления в 2 раза приведет к соответствующему уменьшению концентраций реагентов. Кинетическое уравнение примет вид:
Из расчетов следует, что после уменьшения давления реакционной смеси в 2 раза скорость реакции уменьшится в 8 раз.
Увеличение концентраций исходных веществ в 2 раза приведет к эффекту, аналогичному при соответствующем уменьшении объема системы:
Т.о, после увеличения концентраций исходных веществ в 2 раза скорость реакции возрастет в 8 раз
6. Объясните, как влияет повышение температуры, давления и концентрации исходных веществ на экзотермическую реакцию синтеза аммиака из простых веществ.
Запишем уравнение реакции синтеза аммиака из простых веществ:
N2 (г)+3H2(г)=2NH3(г) 
Данная реакция является обратимой, гомогенной (все реагенты – газы,), протекает с уменьшением объема (в реакцию вступает 4 объема исходных газов-реагентов, получается 2 объема газообразного продукта).
Повышение температуры, давления и концентрации исходных веществ будет влиять на рассматриваемую реакцию в соответствии с законом Ле-Шателье:
Если на систему, находящуюся в химическом равновесии, подействовать извне, то равновесие сместится в сторону реакции, компенсирующей внешнее воздействие.
Повышение температуры будет смещать равновесие в сторону обратной эндотермической реакции, протекающей с поглощением тепла.
Повышение давления будет смещать равновесие в сторону прямой реакции, протекающей с уменьшением объема реакционной смеси, т.е., с уменьшением давления.
1. Повышение концентраций исходных веществ(азота и водорода) будет смещать равновесие в сторону прямой реакции, ведущей к уменьшению этих концентраций.
6.Таким образом, из рассмотренных факторов повышение давления и концентраций исходных веществ будет благоприятно влиять на экзотермическую реакцию синтеза аммиака из простых веществ, способствовать увеличению ее выхода. Напротив, повышение температуры будет способствовать уменьшению выхода прямой реакции.
7. В биологическом полимере (белке) имеет место следующее превращение:
нативное состояние ↔ денатурированное состояние,
Причем при повышении температуры равновесие сдвигается вправо.
Сделайте вывод об энтальпии реакции (принцип Ле-Шателье).
Решение.
1.Принцип Ле-Шателье гласит: Если на систему, находящуюся в химическом равновесии, подействовать извне, то равновесие сместится в сторону реакции, компенсирующей внешнее воздействие.
2. В соответствии с этим принципом при повышении температуры равновесие сдвигается в сторону эндотермической реакции, протекающей с поглощением тепла, т.е., с увеличением энтальпии реакции.
3. Поскольку, согласно условию, при повышении температуры равновесие сдвигается вправо , то прямая реакция (идущая вправо) – эндотермическая:
нативное состояние ↔ денатурированное состояние, 
Растворы
8. Раствор содержит 20 г глюкозы в 100 г воды.
Вычислите давление насыщенного пара растворителя над раствором при температуре 15 о С, если давление пара чистой воды при этой же температуре равно 23,75 мм рт. ст.
Рассчитайте молярную долю растворителя.
Решение
Рассчитаем молярные доли растворенного вещества и растворителя:
1.1.

Где 

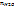

Тогда 
1.2.Молярную долю растворителя, 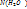

тогда 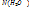
Согласно закону Рауля, давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя:

где 


9. Водный раствор одноатомного спирта, содержащий 0,874 г вещества в 100 мл воды, замерзает при температуре -0,354 о С.
Рассчитайте относительную молекулярную массу спирта и установите его формулу.
Решение.
1. Согласно закону Рауля понижение температуры кристаллизации раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества:
ΔТзам.= Тзам (растворителя)- Тзам (раствора)=KСm (1)
где Сm– моляльная концентрация раствора; К – криоскопическая постоянная. Для воды К=1,86° .
В соответствии с условием задачи ΔТзам.=0 о С-(-0,354 о С)=0,354 о С.
2. Из выражения (1) найдем моляльную концентрацию растворенного вещества:
Сm= ΔТзам/К=0,354/1,86=0,19 моль/кг
3.Согласно определению для моляльной концентрации:

Отсюда 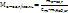
3. Общая формула предельных одноатомных спиртов –СnH2n+1OH. ., тогда молярную массу спирта можно выразить следующим образом:
М(R-OH)=14n+18=46, 14n=28, n =2. Следовательно, формула спирта – С2H5OH- этанол.
10. Осмотическое давление раствора объемом 250 мл, в котором содержится 20 г гемоглобина, равно 2855 Па (при 4 о Сили 277 К).
Установите молярную массу гемоглобина.
Решение.
1. Согласно закону Вант-Гоффа осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества:
Из выражения (1) найдем величину См:
См= Росм/(1000*R*T)=2855/(1000*8,314*277)=0,00124 моль/л
2. Согласно определению молярная концентрация находится по формуле(2):
, отсюда 
11.Водный раствор NaOH кипит при температуре 102,65 о С. Кажущаяся степень ионизации электролита равна 70%.
Определите массу NaOH, растворённую в 100 г воды.
Решение
1.Согласно закону Рауля повышение температуры кипения раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1):
ΔТкип. = i*Кэ*Сm, ( 1)
где i – поправочный изотонический коэффициент, Кэ – эбуллиоскопическая постоянная растворителя; для воды Кэ =0,52°; Сm –моляльная концентрация раствора; ΔТкип. = Ткип р-ра – Ткип.р-рителя. Согласно условию задачи ΔТкип=2,65°
Найдем величину i:
где α- кажущаяся степень ионизации электролита, согласно условию равна 0,7
n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Т.О., для гидроксида натрия n=2. Тогда :
Из выражения (1) найдем величину Сm :
Сm= ΔТкип/( i*Кэ)=2,65/(1,7*0,52)=3 моль/кг
Масса NaOH, растворённая в 100 г воды, определяется по формуле (2):
m(NaOH)= Сm*M(NaOH)*100/1000 (2),
где M(NaOH)=40 г/моль.
Подставляя результаты расчетов в формулу (2), получаем:
11. Раствор, содержащий 2,1 г КОН в 250 мл воды, замерзает при -0,514 о С.
Рассчитайте изотонический коэффициент и кажущуюся степень диссоциации.
Решение
Согласно закону Рауля понижение температуры замерзания раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1):
где i – поправочный изотонический коэффициент; К – криоскопическая постоянная растворителя; для воды К =1,86°; Сm –моляльная концентрация раствора; ΔТзам. = Тзам.р-рителя –Тзам. р-ра . Согласно условию задачи ΔТзам=0,514°
Найдем величину Сm. Согласно определению для моляльной концентрации:

2.Из выражения (1) найдем величину изотонического коэффициента:
I = ΔТзам./( К*Сm)= 0,514/(1,86*0,15)=1,84
3.Изотонический коэффициент и кажущаяся степень диссоциации связаны соотношением (2):
где α- кажущаяся степень ионизации электролита, n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Для гидроксида калия n=2.
Выразим величину α:
12. Осмотическое давление 0,5 М раствора карбоната калия равно 2726 кПа при 0 о С.
Вычислите кажущуюся степень диссоциации K2CO3 в растворе.
Решение
1.Согласно закону Вант-Гоффа для электролитов осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества:
где i – изотонический коэффициент
Найдем величину i:
Изотонический коэффициент связан с кажущейся степенью ионизации соотношением :
где α- кажущаяся степень ионизации электролита,
n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Для карбоната калия n=3.
Выразим величину α:
Буферные системы
13. В состав крови входит буферная система, состоящая из двух анионов.
Приведите формулы её составных частей.
Назовите эту буферную систему.
Классифицируйте её по составу и природе компонентов.
Укажите зону буферного действия.
Напишите уравнения реакций, отражающих механизм действия (ионная форма).
Ответ
1. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая. Из этих систем только фосфатная состоит из двух анионов: Н2РО4 – (донор протонов) и НРО4 2– (акцептор протонов). Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных.
2. Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4.
3. Зона буферного действия буферной пары (Н2РО4 – –НРО4 2– )находится в интервале от 6,2 до 8,2.
4. Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО4 2– с образованием Н2РО4 – :
а также ионов ОН – с ионами Н2РО4 – :
14. Аммиачная буферная система состоит из двух составных частей.
Классифицируйте её по составу и природе компонентов.
Укажите интервал значений рН, внутри которого эта система обладает буферной емкостью.
Напишите уравнения реакций, отражающих механизм её действия (ионная форма).
Объясните, почему аммиачная буферная система не входит в состав крови.
Решение
1.Состав и природа компонентов:
А)NН4ОН (NН3 х Н2О)-гидроксид аммония, слабый электролит
Б) NН4С1 – соль, хлорид аммония, сильный электролит.
Гидроксид аммония — слабый электролит, в растворе частично диссоциирует на ионы:
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы:
и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции.
Интервал значений рН, внутри которого рассматриваемая система обладает буферной емкостью,рассчитывается по формуле:

где Кв – константа диссоциации NН4ОН=1,8*10 -5 , С0-концентрация основания, Сс-концентрация соли.
рН=14-4,74+lg(C0/Cc)=9,26+lg(C0/Cc). В зависимости от соотношения C0/Cc интервал значений рН составляет 8,26-10,26.
Способность аммиачного буфера поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора:
При добавлении щелочи ионы ОН — будут связывать ионы NН4 + , образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора:
Аммиачная буферная система не входит в состав крови, поскольку интервал значений рН, внутри которого она будет обладать буферной емкостью, находится в щелочной области (рН больше 8). Нормальное значение рН плазмы крови составляет 7,40 ± 0,05, т.е ниже области буферирования.
15. В 200 мл фосфатного буферного раствора содержится 0,8 моль кислотного компонента (Н2РО4 — ) и 1,6 моль солевого компонента (НРО4 2– ).
Установите рН буферного раствора.
Объясните, входит ли рассчитанное значение рН в ЗБД (рН: 6,2 – 8,2).
Ки (Н2РО4 — ) = 6,2×10 -8 моль/л; lg 2 = 0,3; lg 6,2 = 0,79.
Классифицируйте буферную систему по составу и природе компонентов.
Решение.
Подставим данные задачи в формулу для расчета рН фосфатного буфера:
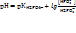
Рассчитанное значение рН входит в зону буферного действия( ЗБД) рН: 6,2 – 8,2
Фосфатная буферная система является кислотно-основной буферной системой, образованной анионами двух кислых солей
16. Концентрация ионов водорода в крови больного равняется 2,46∙10 -8 моль/л.
Рассчитайте рН крови (lg 2,46 = 0,39).
Назовите состояние, возникающее при данном нарушении КОС.
Укажите, чем характеризуется это состояние с точки зрения протолитического гомеостаза.
2. При данном нарушении КОС (рН> 7,4) возникает алкалоз
3. Под протолитическим гомеостазом принято понимать относительное постоянство соотношения кислота-основание внутренней среды живого организма. С точки зрения протолитического гомеостаза алкалоз — увеличение рН в крови (и других тканях организма) за счёт накопления щелочных веществ. Алкалоз может возникать вследствие гипервентиляции лёгких, приводящей к избыточному выведению СО2 из организма, вследствие больших потерь кислого желудочного сока при желудочных свищах, при длительном приёме диуретиков, при избыточном введении бикарбоната натрия с целью коррекции метаболического ацидоза или нейтрализации повышенной кислотности желудочного сока. При алкалозе уменьшается мозговой и коронарный кровоток, снижаются артериальное давление и минутный объем крови. Возрастает нервно-мышечная возбудимость, возникает мышечный гипертонус вплоть до развития судорог и тетании. Нередко наблюдается угнетение моторики кишечника и развитие запоров; снижается активность дыхательного центра. Для алкалоза характерно снижение умственной работоспособности, головокружение, могут возникать обморочные состояния.
Комплексные соединения
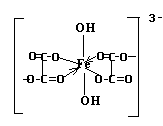
17. Определите заряд комплексообразователя и его координационное число в комплексном ионе [Fe(C2O4)2(OH)2] 3- .
Изобразите графически его структурную формулу.
Классифицируйте этот ион по природе лигандов.
Напишите выражение константы нестойкости.
Пусть заряд иона-комплексообразователя Fe =(Х+). Заряды лигандов равны:(C2O4) 2- , (OH) — . Составим уравнение баланса зарядов:
Т.О. заряд комплексообразователя: Fe +3
Координационное число -число связей, образованных комплексообразователем, с лигандами. В данном ионе к.ч. железа равно 6, т.к. 4 связи железо образует с двумя двухвалентными группами C2O4 и две связи – с двумя одновалентными группами ОН)
1. Структурная формула комплексного иона:
2. Данный ион содержит различные по природе лиганды: оксалат – ион и нидроксид – ион. Т.о. комплексный ион является ацидокомплексом (за счет оксалатов – кислотных остатков щавелевой кислоты) и гидроксокомплексом ( за счет гидроксильных групп).
3. Выражение константы нестойкости:
18. Напишите формулу комплексного соединения, имеющего название: хлорид гексаамминхрома (III).
Изобразите графически структурную формулу внутренней сферы.
Классифицируйте соединение по заряду комплексной частицы, по электропроводности, по природе ионов внешней сферы и по природе лигандов.
Рассчитайте координационное число комплексообразователя.
Напишите выражение константы нестойкости.
1. Хлорид гексаамминхрома (III) имеет молекулярную формулу:
2. Cтруктурная формула внутренней сферы:
По заряду комплексной частицы хлорид гексаамминхрома является катионным комплексом; по электропроводности –сильным электролитом, по природе ионов внешней сферы-хлоридом, по природе лигандов –аммиакатом
Координационное число комплексообразователя равно 6
Выражение константы нестойкости:
[Cr(NH3)6] 3+ ↔ Cr 3+ +6 NH3
19. Рассчитайте DG процесса [Fe(CN)6] 4- ↔ Fe 2+ + 6CN — , если Кн в стандартных условиях равна 10 -35 .
Изобразите графически структурную формулу комплексной частицы.
Классифицируйте её по природе лигандов.
Напишите выражение константы нестойкости.
Изменение свободной энергии Гиббса ΔG и константа равновесия связаны соотношением:
Подставляя данные задачи и учитывая, что стандартные условия соответствуют Т=298 К,получаем:
ΔG=-8,31*298 *ln10 -35 =-2,3*8,31*298*lg10 -35 =-2,3*8,31*298*(-35)=199349 дж=199,349 кДж
Структурная формула комплексной частицы:
3.По природе лиганда данное соединение является ацидокомплексом, т.к. CN — — кислотный остаток синильной кислоты
4. Выражение константы нестойкости:
Физико-химия коллоидно-дисперсных систем и растворов ВМС
20. Напишите коллоидно-химические формулы мицелл золей полученных по реакциям:
А) AgNO3 + KI ®
В) FeCl3 + NaOH ®
Приведите строение мицелл.
Примечания:
В вариантах А – В необходимо написать формулы мицелл в избытке каждого из исходных веществ.
2.Коллоидно-химические формулы мицелл золей:
А) AgNO3 + KI ®AgI↓+К NO3
Состав мицеллы, полученной при избытке AgNO3, может быть представлен следующим образом:
Ядро — m AgI *nAg + ; адсорбционный слой противоионов -(n-x) NO3 — ; диффузный слой противоионов — х NO3 — .
Состав мицеллы, полученной при избытке KI, может быть представлен следующим образом:
[m AgI *nI — *(n-x) К + ] x — *х К +
Ядро — m AgI *nI — ; адсорбционный слой противоионов -(n-x) К + ; диффузный слой противоионов — х К + .
Состав мицеллы, полученной при избытке CaCl2, может быть представлен следующим образом:
[m Са C2O4 *nCa 2+ *2(n-x) Cl — ] 2 x + *2х Cl —
Ядро — m Са C2O4 *nCa 2+ ; адсорбционный слой противоионов 2(n-x) Cl — ; диффузный слой противоионов — 2х Cl —
Состав мицеллы, полученной при избытке H2C2O4, может быть представлен следующим образом:
[m Са C2O4 *nC2O4 2- *2(n-x) H + ] 2 x — *2х H +
Ядро — m Са C2O4 *nC2O4 2- ; адсорбционный слой противоионов 2(n-x) H + ; диффузный слой противоионов — 2х H +
В)FeCl3 + 3NaOH ®Fe(OH)3↓ +3NaCl
Состав мицеллы, полученной при избытке FeCl3, может быть представлен следующим образом:
[m Fe(OH)3*nFe 3+ *3(n-x) Cl — ] 3x+ *3х Cl —
Ядро — m Fe(OH)3*nFe 3+ ; адсорбционный слой противоионов 3(n-x) Cl — ; диффузный слой противоионов — 3х Cl —
Состав мицеллы, полученной при избытке NaOH, может быть представлен следующим образом:
[m Fe(OH)3*nОН — * (n-x) Na + ] x- *х Na +
Ядро — m Fe(OH)3*n ОН — ; адсорбционный слой противоионов (n-x) Na + ; диффузный слой противоионов — х Na +
Г) FeCl3 + 2H2O ® Fe(OH)2Cl+ 2HCl
Состав мицеллы, полученной при гидролизе хлорида железа, может быть представлен следующим образом:
Ядро — m Fe(OH)3* nFeO + ; адсорбционный слой противоионов (n-x) Cl — ; диффузный слой противоионов — х Cl —
21. Имеются 3 коллоидных раствора: гидроксида железа (III), полученного гидролизом FeCl3, иодида серебра, полученного в избытке КI, и иодида серебра, полученного в избытке AgNO3.
Предложите два варианта взаимной коагуляции.
Объясните, используя формулы мицелл.
А)гидроксида железа (III), полученного гидролизом FeCl3:
Положительно заряженный золь
Б)иодида серебра, полученного в избытке КI:
[m AgI *nI — *(n-x) К + ] x — *х К +
Отрицательно заряженный золь
в)иодида серебра, полученного в избытке AgNO3:
Положительно заряженный золь
2.Взаимная коагуляция наблюдается при сливании растворов противоположно заряженных золей., а именно:
· Отрицательно заряженного золя иодида серебра, полученного в избытке КI, и положительно заряженного золя иодида серебра, полученного в избытке AgNO3.;
· Отрицательно заряженного золя иодида серебра, полученного в избытке КI, и положительно заряженного золя гидроксида железа (III), полученного гидролизом FeCl3.
22. Пороговая концентрация коллоидного раствора гидроксида алюминия равняется 0,63 ммоль/л.
Рассчитайте объем 0,01М раствора дихромата калия, вызывающего коагуляцию золя объёмом 200 мл.
Определите заряд гранулы, учитывая, что коагулирующим действием обладает дихромат-анион.
Предложите соответствующий вариант формулы мицеллы золя Al(OH)3.
Рассчитаем объем раствора электролита-коагулятора дихромата калия (V) по формуле:
, где γ- пороговая концентрация коллоидного раствора гидроксида алюминия, равна 0,63 ммоль/л, V золя –объем золя, согласно условию равен 0,2 л, С- концентрация электролита-коагулятора дихромата калия, равна 10 ммоль/л. Подставляя значения в формулу, получаем:
V=0,63 ммоль/л *0,2л/10 ммоль/л=0,0126 л=12,6 мл
2.Поскольку коагулирующим действием обладает дихромат-анион, заряд гранулы (коллоидной частицы) противоположен, т.е. положителен.
3. Соответствующий вариант формулы мицеллы золя Al(OH)3, стабилизированного AlCl3:
[m Al(OH)3 *nAl 3+ *3(n-x)Cl — ] +x *3xCl —
3.Строение мицеллы:
Ядро — m Al (OH)3*n Al 3+ ; адсорбционный слой противоионов 3(n-x) Cl — ; диффузный слой противоионов — 3х Cl —
23. ИЭТ альбумина плазмы крови равна 4,64.
Определите знак заряда частиц альбумина в 0,001М растворе HCl.
Укажите направление перемещения частиц альбумина при электрофорезе в данных условиях.
http://helpiks.org/8-93404.html
http://lektsia.com/4×5602.html