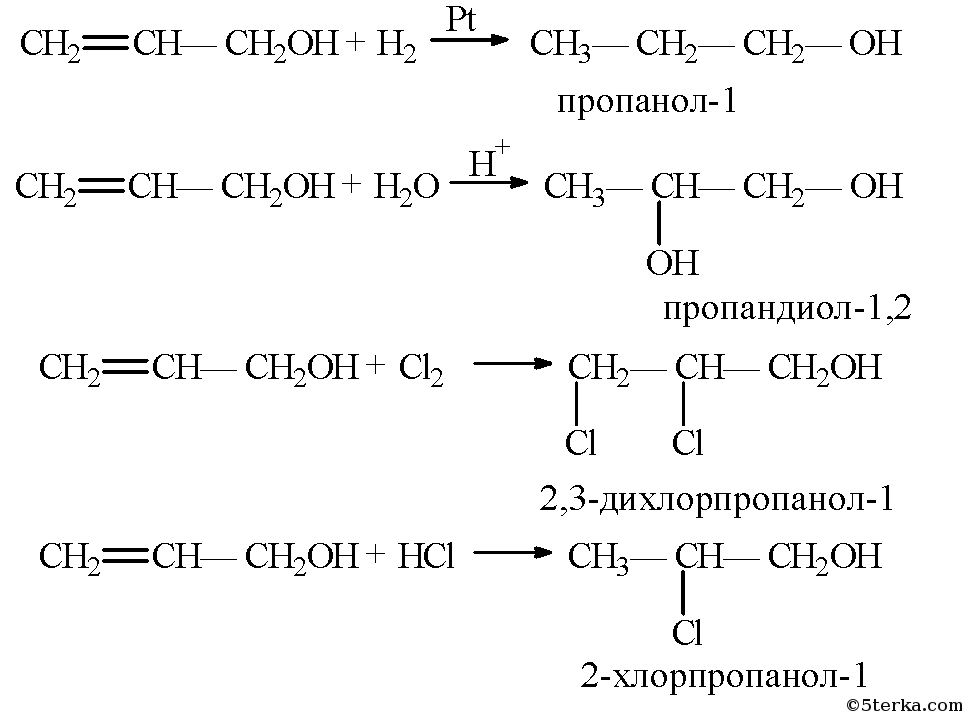
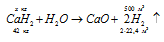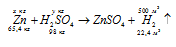12. Составьте уравнения реакций гидрирования, гидратации, галогенирования и гидрогалогенирования 2-пропенола-1. Назовите продукты всех реакций.
12. Составьте уравнения реакций гидрирования, гидратации, галогенирования и гидрогалогенирования 2-пропенола-1. Назовите продукты всех реакций.

задача №12
к главе «Глава 4. Кислородсодержащие соединения. § 17. Спирты».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Гидриды металлов, получение и свойства
Задача 794.
Как получают гидриды металлов? Составить уравнения реакций: а) получения гидрида кальция; б) взаимодействия его с водой.
Решение:
Соединения водорода с металлами называют гидридами. Гидриды металлов получают при нагревании металла в струе водорода. Гидриды имеют ионное строение, так металл кальций входит в состав СаН2 в виде иона Са 2+ , а водород – в виде аниона Н — . Таким образом, можно сделать вывод, что гидриды – солеподобные соединения.
а) При нагревании в струе водорода металлический кальций соединяется с водородом, образуя гидрид кальция:
б) Гидрид кальция СаН2 – солеподобное вещество белого цвета, которое гидролизуется как соль сильного основания и слабой кислоты по аниону:
Эта реакция может служить удобным методом для получения водорода в лабораторных условиях. Гидрид кальция можно использовать в качестве эффетивного осушителя воздушных, газовых и жидких неводных смесей, а также для количественного определения содержания воды в органических соединениях и кристаллогидратах и т.д. СаН2 служит для обнаружения следов воды.
Задача 795.
Для наполнения аэростатов в полевых условиях иногда пользуются взаимодействием гидрида кальция с водой. Сколько килограммов СаН2 придется израсходовать для наполнения аэростата объемом 500 м 3 (считая условия нормальными)? Сколько потребуется для этой цели цинка и серной кислоты?
Решение:
а) Уравнение реакции имеет вид:
Молекулярная масса СаН2 равна 42 а. е. м., значит, СаН2 – 42кг/кмоль. Массу СаН2 находим из пропорции:
х : 500 = 42 : 44,8; х = (42 . 500)/44,8 = 468,75кг.
б) Уравнение реакции имеет вид:
Массу цинка находим из пропорции:
х : 500 = 65,4 : 22,4; х = (65,4 . 500)/22,4 = 1459,82кг.
Массу серной кислоты находим из пропорции:
у : 500 = 98 : 22,4; х = (98 . 500)/22,4 = 2187,50кг.
Ответ: m(CaH2) = 468,75кг, m(Zn) = 1459,82кг, m(H2SO4) = 2187,50кг.
Задача 796.
Почему водород и кислород не взаимодействуют при обычной температуре, а при 700 °С реакция протекает практически мгновенно?
Решение:
Атомы водорода в молекуле Н2 и атомы кислорода в молекуле О2 соединены между собой очень прочными ковалентными связями. Малая скорость взаимодействия водорода с кислородом при низких температурах обусловлена высокой энергией активации этой реакции. Поэтому любое столкновение между молекулами Н2 и О2 при обычной температуре и атмосферном давлении оказывается неэффективным. И только при повышении температуры, когда кинетическая энергия сталкивающихся молекул Н2 и О2 делается большой, некоторые соударения молекул Н2 и О2 становятся эффективными и приводят к образованию активных центров, что даёт начало реакции взаимодействия водорода с кислородом, т. е. реакция инициируется, и скорость её резко возрастает. При смешивании водорода и кислорода в отношении 2 : 1 можно получить взрыв, если инициировать реакции, например ударом. При 300 °С в смеси Н2 и О2 через несколько дней образуется немного Н2О, а при 500 0 С водород полностью соединяется с кислородом за несколько часов, при нагревании смеси до 700 0 С происходит быстрый подъём температуры и реакция заканчивается со взрывом. Поэтому чтобы взорвать смесь Н2 и О2 нужно подогреть её до 700 °С хотя бы в одном месте.
Гидрид кальция: способы получения и химические свойства
Гидрид кальция CaH2 — неорганическое бинарное соединение щелочноземельного металла кальция и водорода. Белый, плавится без разложения в атмосфере H2, при дальнейшем нагревании разлагается. Сильный восстановитель.
Относительная молекулярная масса Mr = 42,09 относительная плотность для тв. и ж. состояния d = 1,9; tпл ≈ 1000º C.
Способ получения
1. Гидрид кальция получают реакцией взаимодействия кальция и водорода при 500 — 700º C:
2. Хлорид кальция взаимодействует с водородом при 600 — 700º С и образует гидрат кальция и хлороводородную кислоту:
Химические свойства
1. Гидрид кальция — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. При взаимодействии с кислородом при температуре 300 — 400º C гидрид кальция образует оксид кальция и воду:
1.2. При температуре выше 1000º C г идрид кальция взаимодействует с азотом , образуя нитрид кальция и водород:
2. Гидрид кальция взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид кальция образует гидроксид кальция и газ водород:
2.2. Гидрид кальция вступает в реакцию с кислотами :
2.2.1. С разбавленной хлороводородной кислотой гидрид кальция реагирует с образованием хлорида кальция и газа водорода:
2.2.2. В результате реакции между гидридом кальция и сероводородной кислотой при 500 — 600º С образуется сульфид кальция и водород:
2.3. Гидрид кальция реагирует с газом аммиаком при t = 300º C с образованием амида кальция и водорода:
2.4. Гидрид кальция вступает во взаимодействие с солями :
В результате реакции между гидридом кальция и хлоратом калия при 450 — 550º С образуется хлорид калия, оксид кальция и вода:
3CaH2 + 2KClO3 = 2KCl + 3CaO + 3H2O
3. Гидрид кальция разлагается при температуре выше 1000º C, с образованием кальция и водорода:
http://buzani.ru/zadachi/khimiya-glinka/1263-gidridy-metallov-zadachi-794-796
http://chemege.ru/gidrid-kalciya/