Адиабатный процесс. Изопроцессы в термодинамике
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы будем работать с уже известными нам физическими понятиями, но в несколько иной области применения. А именно с изопроцессами в термодинамике. Мы рассмотрим, какие изменения в первый закон термодинамики (закон сохранения энергии в тепловых процессах) внесут протекания этих самых процессов при неизменном макроскопическом параметре газа. Также мы рассмотрим новый, ранее неизвестный процесс – адиабатный.
Адиабатический процесс — условия протекания, уравнения и формулы
История открытия
Ряд экспериментов, проведенных в начале XIX столетия, доказали существование атмосферного давления. Так, немецкий инженер Герике сконструировал магдебургские полушария. Из сферы выкачивался воздух, после чего они с трудом разъединялись — воздух давил на них.
Пример еще одного исследования, целью какого является изучение такого явления — опыт Роберта Бойля. Физик доказал, что если трубка запаяна с короткого конца, а в длинный налита ртуть, последняя не поднимется до верха. Ведь воздушными потоками уравновешивается давящая сила.
Ламберт издал в 1779 году книгу «Пирометрия». В его труде описывается повышение и понижение температуры в приемнике воздушного насоса, когда движется поршень. Этот эффект подтвердили следующие ученые:
Дальтон опубликовал доклад, где называется особенность сгущения идеального газа. При нем выделяется тепло.
Обобщил накопившиеся знания Пуассон. По его мнению, температура при адиабатической реакции непостоянная, а, значит, закону Бойля — Мариотта необходима поправка — физик обозначил ее, как коэффициент k и выразил через соотношение теплоемкостей.
Важные нюансы
Термодинамический процесс в общем случае включает в себя теплообмен, работу, совершаемую системой и изменение внутренней энергии. Адиабатный по причине отсутствия обмена теплом сводится к последним двум.
Поэтому для него первое уравнение термодинамики приобретает вид: Δ U = — A. Приняты указанные обозначения:
- Δ U — преобразование внутренней мощности.
- A — прилагаемые внешней средой усилия.
Энтропия (S) не меняется в результате теплопередачи. Этот постулат описывается уравнением ΔS = ΔT=0. Здесь T — температура.
А также для расчетов используется такая величина, как адиабата идеального газа. Она обозначается буквой γ и вычисляется следующим образом: γ = C1/C2 (соотношение теплоемкостей).
Может подобный параметр выражаться и как количество степеней свободы. То есть γ = i + 2/ i.
Описание основных циклов
Физиками предлагается указанное определение процесса Карно: это идеальная цикличность, обеспечивающая работу тепловой машины с максимальным КПД. Наибольший и наименьший уровень разогрева совпадает с аналогичными показателями для рабочего устройства.
Среди условий для достижения нужного коэффициента полезного действия физики называют обратимость реакции, значит, следует исключить теплообмен между телами. Соответственно, преобразование тепла происходит лишь изотермически.
Обратный переход рабочего двигателя в исходную точку невозможен. Дело в том, что вся энергия затратится на восстановление изначального положения.
Работа четырехтактной двигательной системы осуществляется по схеме Отто, включающую в себя впуск, сжатие, рабочий вход и выпуск. Второй, третий и четвертый этапы считаются адиабатическими.
Прилагаемые в конце усилия равны разности мощности, с которой давят на газ и силы, затраченной на сжимание. Последнее повторяется до 7 раз (применяемая смесь зажигается принудительно).
Особенность адиабатической реакции заключается в невозможности теплообмена между окружающим пространством и объектом. С ее помощью можно объяснить, каким принципам подчиняется работа двигателя с четырьмя тактами и устройство с высокой отдачей.
Определение, уравнения и характеристика адиабатического процесса
Переходы между разными состояниями системы являются основным объектом изучения термодинамики. Одним из таких преобразований, которое играет важную роль в технике и природе, является адиабатический процесс. Что он собой представляет и какими уравнениями описывается, рассматривается в данной статье.
Определение адиабатического процесса
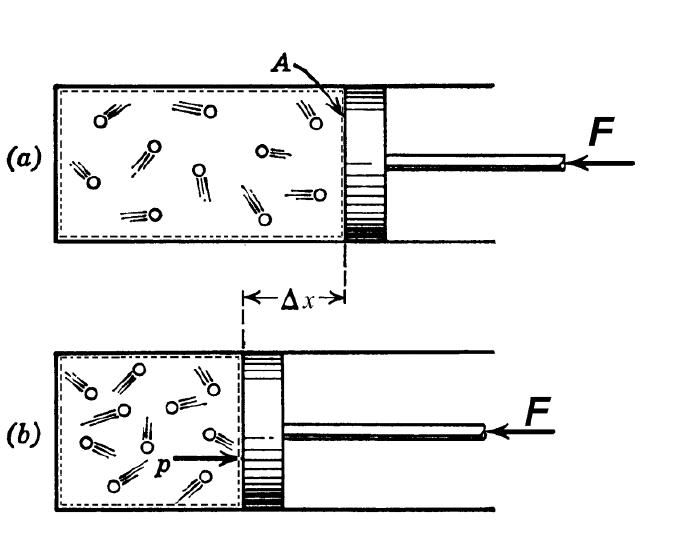
Если переход между двумя состояниями осуществляется только за счет внутренних энергетических резервов рассматриваемой системы, то он называется адиабатическим. В результате этого за счет таких ресурсов выполняется некоторая работа.
Адиабатический процесс характерен для систем, которые могут легко сжиматься и расширяться. Этим условиям удовлетворяют все газы. Обмен теплотой с окружающей средой во время протекания этого процесса практически отсутствует потому, что скорость адиабатического перехода оказывается очень большой. С другой стороны, она может быть маленькой, но при этом система должна обладать хорошей теплоизоляцией.
Графики и уравнения адиабатического процесса проще всего изучать на примере идеальных газов, у которых внутренняя энергия точно равна кинетической энергии молекул.
Формулы Пуассона
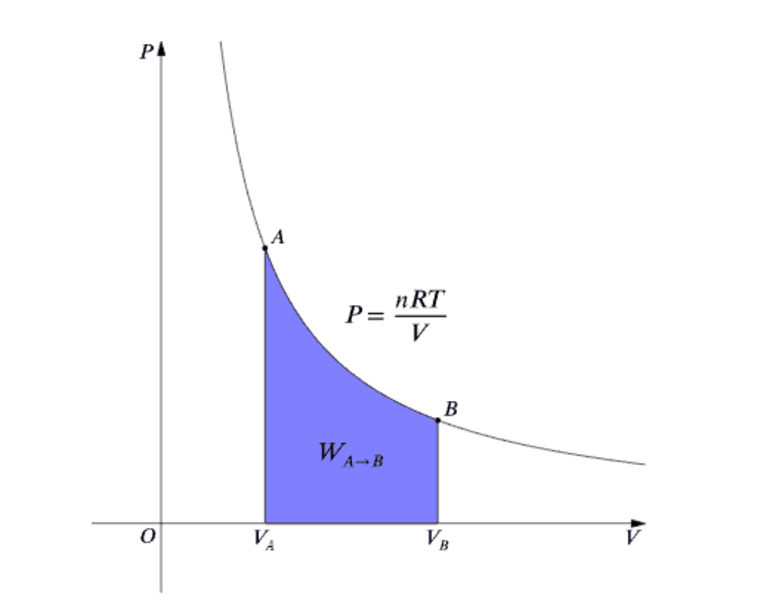
Рассмотрим подробнее. Те, кто знаком с физикой идеального газа, знают, что каждое преобразование в такой системе подчиняется некоторым уравнениям. Например, изотермический процесс описывается законом Бойля-Мариотта, изобарный — законом Шарля, изохорный — законом Гей-Люссака. Справедливо это и для рассматриваемой нами системы. Закон адиабатического процесса тоже имеет свое математическое выражение в виде уравнений Пуассона. Получим их.
В соответствии с определением изучаемого процесса можно записать следующее выражение:
Это равенство является первым законом термодинамики, который устанавливает сохранение энергии в системе. В частности, работа P*dV выполняется только за счет изменения внутренней энергии dU. Чтобы получить уравнения Пуассона, вспомним следующие соотношения для идеального газа:
Первое равенство говорит о том, что при изохорном процессе изменение внутренней энергии оказывается прямо пропорциональным температуре, где CV — изохорная теплоемкость. Второе выражение — это закон Клапейрона-Менделеева для 1 моль идеального газа. Наконец, третье равенство устанавливает связь между изобарной CP и изохорной CV теплоемкостью и газовой постоянной R для 1 моль вещества. Применение всех этих выражений позволяет получить следующие уравнения адиабатического процесса:
Все три уравнения имеют отношение к французскому математику и физику XIX века Симеону Пуассону.
Физический смысл
Величина γ называется показателем адиабаты. Он математически равен отношению теплоемкостей CP и CV. Поскольку изобарная теплоемкость всегда больше изохорной, то γ будет больше 1. Почему это происходит? В случае изобарного процесса подводимая к системе теплота расходуется не только на ее нагрев, но и на совершение системой работы.
На показатель адиабаты не влияет химический состав газа, однако он зависит от количества степеней свободы, составляющих систему молекул. В общем случае справедлива следующая формула:
Здесь f — число степеней свободы. Для одноатомного газа оно равно 3, для двухатомного — 5, а для многоатомного — 6. С учетом этих цифр получаем значения γ:
γ = 1,4 (для двухатомного);
γ = 1,33 (для многоатомного)
В случае газовой смеси, в которую входят молекулы с разным числом атомов, следует рассчитывать среднее значение γ с учетом атомных долей компонентов. Например, земной воздух на 99 % состоит из двухатомных молекул N2 и O2, то есть для него показатель γ для стандартных условий практически равен 1,4.
Адиабатический и изотермический процессы
Рассмотрим следующие преобразования. Знакомые с физикой люди могли заметить, что уравнение Пуассона, выраженное через термодинамические параметры P и V, по своей форме совпадает с выражением Бойля-Мариотта для изотермического процесса в идеальном газе. Последнее имеет вид:
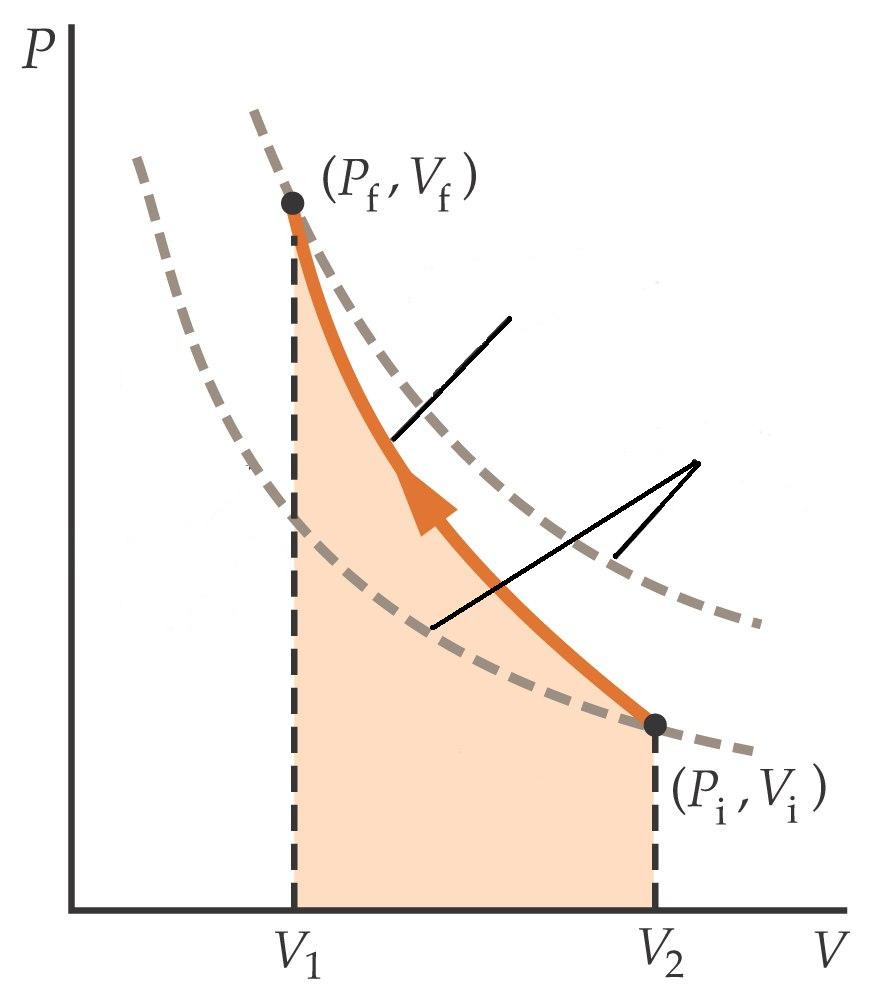
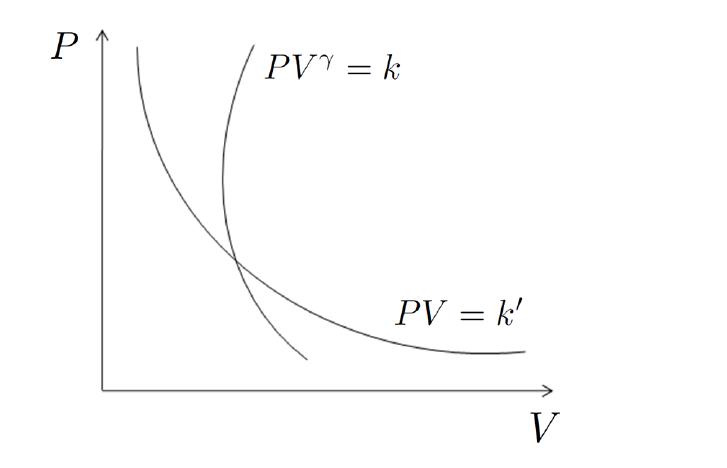
Если изобразить графики адиабатического и изотермического процессов в осях P-V, то можно увидеть, что первая кривая будет идти более резко, чем вторая. Иными словами, давление в случае адиабатического перехода падает быстрее, чем в случае изотермического преобразования. Поясним этот факт. Следует вспомнить, что при изотермическом расширении в систему поставляется некоторое количество энергии для поддержания температуры в ней, что способствует более медленному снижению давления.
http://nauka.club/fizika/adiabaticheskiy-protsess.html
http://www.syl.ru/article/459810/opredelenie-uravneniya-i-harakteristika-adiabaticheskogo-protsessa