Адиабатический процесс
Вы будете перенаправлены на Автор24
Что такое адиабатический процесс
Адиабатическим или адиабатным процессом называют процесс, при котором отсутствует теплообмен с окружающей средой ($\delta Q=0$).
В таком случае первое начало термодинамики можно записать в виде:
\[0=\frac<2>\nu RdT+pdV\ \left(1\right).\]
Из уравнения (1) следует, что при увеличении объема в адиабатном процессе уменьшается температура системы. Или говорят, что в адиабатном процессе работа совершается за счет уменьшения внутренней энергии системы. И обратное справедливо: работа, совершенная над системой, увеличивает внутреннюю энергию системы и, как следствие, температуру. Уравнение, которое характеризует адиабатный процесс в термодинамических параметрах (уравнение адиабаты) носит имя Пуассона. Получим это уравнение для идеального газа. Из уравнения состояния идеального газа:
Из соотношения Майера:
\[C_p-C_V=\nu R\ \left(3\right).\]
Подставим (3) в (2), получим:
Разделим уравнение (1) $C_VT\ (\ C_V=\frac<2>нR)$, получим:
где $\gamma =\frac
где $lnA$- некоторая постоянная.
Потенцируем уравнение (6), получаем:
Уравнение (7) есть уравнение адиабаты в параметрах T,V. Для того, чтобы перейти к уравнению адиабаты, в параметрах p,V используют уравнение Менделеева — Клайперона. И получают уравнение адиабаты в виде:
Или в параметрах p,T уравнение (7,8) имеет вид:
Зная, что теплоемкости можно представить как:
показатель адиабаты исходя из ($\gamma =\frac
Легко получить формулу работы для адиабатного процесса. По определению работа газа A равна:
где $p_1V_1=\nu RT_1.$ Используя уравнение адиабаты, записанное для двух состояний в параметрах $V,T$, получаем:
Что такое адиабата
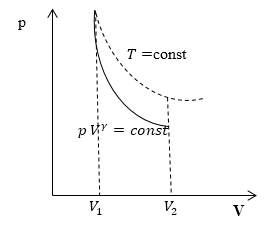
Линия, изображающая на термодинамической диаграмме адиабатный процесс, называется адиабатой (рис.1).
Для сравнения на рис. 1 представлена также изотерма (пунктиром). На рис. 1 видно, что адиабата идет круче, чем изотерма. Работа в адиабатическом процессе по расширению от объема $V_1\ $до $V_2$ меньше, чем в изотермическом процессе с таким же изменением объема. Это объясняется тем, что при адиабатном процессе происходит охлаждение газа. В изотермическом процессе при расширении давление уменьшается только за счет уменьшения плотности, тогда как в адиабатном за счет плотности и средней кинетической энергии молекул (соответственно температуры).
Задание: Одноатомный газ совершает адиабатное расширение от объема $V_1=$1$м^3\ $при температуре $Т_1=400\ К$, при этом давление газа изменяется от $p_1=5\cdot <10>^6Па\ $до $p_2=2\cdot <10>^6\ Па$. Найдите объем газа в конечном состоянии.
При адиабатном расширении имеем:
где $\gamma =\frac
Ответ: Объем газа в конечном состоянии 4,6 $м^3.$
Задание: Некоторую массу газа сжали так, что $\frac
Работа в адиабатном процессе задана формулой над газом:
Формула для работы в изотермическом процессе имеет вид:
Тогда найдем искомое отношение:
Для коэффициента адиабаты мы знаем формулу вычисления через число степеней свободы$(i)$, а для одноатомного газа $i=3$:
Подставим данные из условий задачи, получим:
Ответ: Отношение работ, которые совершают над газом в процессах сжатия в адиабатном процессе и изотермическом равно 1,89. Работа над газом в адиабатном процессе больше.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
Адиабатный процесс. Изопроцессы в термодинамике
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы будем работать с уже известными нам физическими понятиями, но в несколько иной области применения. А именно с изопроцессами в термодинамике. Мы рассмотрим, какие изменения в первый закон термодинамики (закон сохранения энергии в тепловых процессах) внесут протекания этих самых процессов при неизменном макроскопическом параметре газа. Также мы рассмотрим новый, ранее неизвестный процесс – адиабатный.
Адиабатным называют процесс которому соответствует уравнение
называют процесс изменения термодинамического состояния, происходящий без теплообмена с окружающей средой.
Какой процесс можно было бы считать адиабатным? Вопрос не столь простой. Условием адиабатности можно считать следующее условие: с одной стороны — процесс должен быть очень быстрым, чтобы за время процесса не успел произойти теплообмен, а с другой стороны — он должен быть медленным, чтобы промежуточные состояния были обратимыми (квазистатичными).
Процесс без теплообмена не является адиабатным, если он протекает настолько быстро, что промежуточные состояния не являются квазистатическими (обратимыми).
Если в цилиндре поршень сжимает газ, то в каждый момент времени давление и температура газа должны быть одинаковыми по всему объёму. Для осуществления этого требования требуется некоторое время, называемое временем релаксации. Иначе поршень будет «сгребать» перед собой «сугроб» из молекул.
Первый закон термодинамики для адиабатного процесса будет иметь вид:
Если работа, совершаемая над газом внешними телами, будет положительной (отрицательной), то изменение внутренней энергии тоже будет положительным (отрицательным), следовательно, газ нагревается (остывает).
Пусть из некоторого одинакового начального состояния начинают расширяться две одинаковые порции газа. Одна порция расширяется изотермически, другая адиабатно. При увеличении объёмов газов на некоторую величину изотермический процесс приведёт к снижению давления только потому, что уменьшится концентрация молекул.
В адиабатном же расширении газ уменьшает внутреннюю энергию и остывает. Давление при этом уменьшится за счёт уменьшения концентрации так же, как в и изотермическом процессе, но при этом давление ещё дополнительно уменьшится из-за уменьшения температуры. Поэтому давление в адиабатном процессе падает быстрее, чем в изотермическом процессе. Данный факт означает, что график адиабатного процесса в координатной плоскости `pV` будет пересекать график изотермического процесса. На качественном уровне мы уже приходим к выводу, что график адиабаты круче изотермы (рис. 13).
Уравнение, отображающее изменения термодинамических параметров при адиабатном квазистатическом процессе, называют уравнением Пуассона. Не задаваясь целью рассмотрения вывода уравнения, запишем его в готовом виде в различных формах.
http://interneturok.ru/lesson/physics/10-klass/osnovy-termodinamiki/adiabatnyy-protsess-izoprotsessy-v-termodinamike
http://zftsh.online/articles/4941