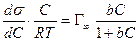Лекция 13. Адсорбция
13.1. Уравнение адсорбции Гиббса
Строгое определение понятия адсорбции по Дж. Гиббсу: адсорбцией данного компонента на границе раздела двух фаз называется разность между фактическим количеством этого компонента в системе и тем его количеством, которое было бы в системе, если бы концентрации в обеих сосуществующих фазах были постоянны вплоть до некоторой геометрической поверхности, разделяющей их.
Эта разность может быть положительной или отрицательной. Она обозначается символом G (гамма) и имеет размерность моль/м 2 . Эту величину называют избыточной адсорбцией по Дж. Гиббсу.
Хотя в приведенном определении адсорбция отнесена к геометрической поверхности, не имеющей толщины (что удобно при выводе уравнений), фактически граница между фазами представляет собой очень тонкий слой (поверхностный слой), в котором все свойства отличаются от свойств объемных фаз и изменяются не скачкообразно, а непрерывно.
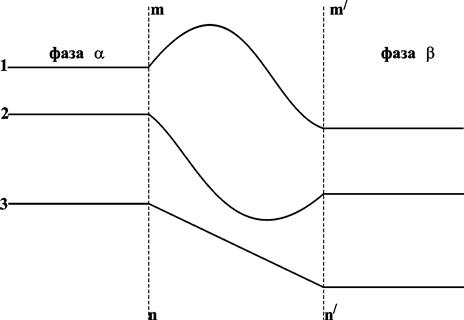
На рис. 13.1 показано возможное изменение концентрации вблизи границы раздела: концентрация компонента может быть как выше концентраций в обеих фазах (1), так и ниже (2) или иметь промежуточное значение. Эта область может рассматриваться как поверхностный слой. Таким образом, изучая границу раздела фаз, нужно рассматривать состояние трех фаз: двух объемных и одной поверхностной.
Рис. 13.1. Изменение концентрации компонентов у границы раздела фаз;
поверхностный слой – mn-m’n’
Уравнение, устанавливающее связь между всеми параметрами процесса адсорбции – величиной поверхностного натяжения s, концентрацией компонента [C] в одной из фаз, его адсорбцией Г, было выведено Дж. Гиббсом в 1876 г. Это уравнение является общим термодинамическим уравнением, справедливым для любых составов и природы поверхности раздела фаз.
Рассмотрим систему, состоящую из двух компонентов 1 и 2 и двух фаз a и b, разделенных поверхностью раздела с площадью S. Общее число молей каждого компонента в системе равно n1 o и n2 o . Если считать, что поверхностный слой не имеет толщины, т.е. представляет собой геометрическую поверхность, то обе объемные фазы будут иметь постоянный состав вплоть до этой геометрической поверхности. Обозначим число молей каждого компонента в каждой из этих фаз соответственно через n1 a ,n1 b ; n2 a ,n2 b . Так как на поверхности имеет место адсорбция, то, очевидно, n1 o ¹ n1 a + n1 b и n2 o ¹ n2 a + n2 b .
По вышеприведенному определению адсорбция каждого компонента Г1 и Г2 , отнесенная к единице площади поверхности, равна
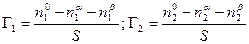
Чтобы найти Г1 и Г2, напишем уравнение энергии Гиббса для двух фаз a и b в отдельности и для всей системы в целом. В последнем случае, очевидно, нужно включить в уравнение член sdS:
dG o = — S o dT + V o dP + sdS + m1dn1 o + m2dn2 o . (13.2)
Укажем на уравнение Гиббса-Дюгема, которое устанавливает связь между химическими потенциалами:
dG = — S dT + VdP + Smidn1 (P, T – постоянные). (13.3)
Тогда для бинарной системы получим
Интегрируя это уравнение при постоянных значениях m1 и m2, получим
Из (13.4) и (13.6) вытекает, что
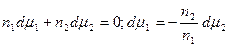
Это уравнение носит название уравнения Гиббса-Дюгема и связывает изменение химических потенциалов компонентов. Тогда с учетом уравнения Гиббса-Дюгема и поверхностных явлений получаем:
Сложение двух первых уравнений и вычитание полученной суммы из третьего дает
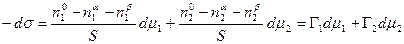
В качестве примера рассмотрим две конкретные системы: двухкомпонентный жидкий раствор, находящийся в равновесии со своим двухкомпонентным насыщенным паром, и твердое тело, находящееся в равновесии с однокомпонентным газом, совершенно не растворимым в этом твердом теле.
Поскольку в первом случае точное положение разделяющей геометрической поверхности несколько условно, то можно выбрать положение ее, при котором
Во втором случае вследствие нерастворимости газа в объеме твердого тела, объемные свойства этого тела, в частности его химический потенциал, не изменяются при адсорбции. Приписывая твердому телу индекс 1, имеем:
В обоих случаях получено одно и то же уравнение. Поэтому можно считать, что адсорбционное уравнение Гиббса имеет вид:
Оно является основным в учении о поверхностных явлениях.
Рассмотрим далее реальный раствор. Для реального раствора
где а – активность, тогда:
Подставив это значение в уравнение (13.12), получим:
ds = — Г Rt d lna,
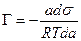
В разбавленных растворах а » С (где С – концентрация)
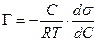
а для идеального или разреженного идеального газа
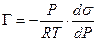
Уравнение (13.14) показывает, что если при адсорбции поверхностное натяжение s уменьшается с ростом концентрации С, т.е. ds/dC 0 и Г – отрицательно. Это соответствует поверхностно-инактивным веществам. Если известна зависимость s от С (т.е. изотерма поверхностного натяжения s = f(C) , то по уравнению Гиббса можно для каждого значения концентрации найти ds/dC и по уравнению Гиббса вычислить значение Г, т.е. построить изотерму адсорбции.
13.2. Обзор сорбционных явлений
Адсорбция на границе раздела твердое тело/газ. В общем случае явления, связанные с перераспределением веществ между различными частями гетерогенной системы, называются сорбцией. Сорбция (от лат. sorbeo – сгущать) – это изменение концентрации (часто увеличение) либо у поверхности раздела фаз (адсорбция), либо в объеме одной из фаз (абсорбция). Например, образование раствора за счет поглощения НСl (газа) и поглощение газа металлом (абсорбция). Поверхностная сорбция – адсорбция.
Твердое тело, у поверхности которого происходит адсорбция, называется адсорбентом, адсорбирующийся газ или адсорбирующийся компонент жидкого раствора – адсорбтивом, а адсорбированое вещество – адсорбат.
В строгом определении адсорбции она рассматривается как избыток вещества вблизи поверхности по сравнению с равным объемом вдали от нее. В ряде случаев удобнее рассматривать не избыток, а все количество адсорбата вблизи поверхности. Это количество обозначают символом а и называют полным содержанием, или просто адсорбцией (без указания гиббсова). Так как для пористых твердых тел бывает затруднительно знать величину поверхности, то часто адсорбцию относят не к единице поверхности, а к единице массы (моль/кг или моль/г).
Адсорбция самопроизвольна и протекает при Р = const со снижением энергии Гиббса, а при V = const – со снижением энергии Гельмгольца. Однако при этом происходит не выравнивание концентраций по всему объему системы, а увеличение разности концентраций между газовой фазой (раствором) и поверхностью. Одновременно уменьшается подвижность сорбирующихся молекул. Оба фактора ведут к уменьшению энтропии (DS o , так как DG o = DH o + TDS o ,
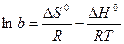
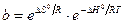
Таким образом, адсорбционный коэффициент b связан со стантартной энтропией DS° и со стандартной теплотой адсорбции q = –DH°.
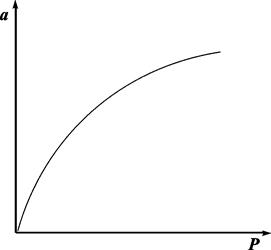
Очень часто аm называют «емкость монослоя». На рис.13.3 показана кривая, выражающая изотерму адсорбции по Ленгмюру
Рис. 13.3. Изотерма адсорбции по Ленгмюру
При очень малых заполнениях и, следовательно, очень малых давлениях Р в знаменателе, согласно (13.25), bр > 1 и а = аm, т.е. величина адсорбции перестает зависеть от давления, поскольку все центры уже заняты.
Для расчета параметров am и b уравнение Ленгмюра представляют в виде
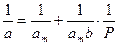
Тангенс угла наклона этой линии равен 1/amb, а отрезок, отсекаемый на оси ординат, равен 1/am.
Уравнение Ленгмюра, полученное на основании модели локализованной адсорбции газов на поверхности твердого тела, часто хорошо описывает адсорбцию растворенных веществ на поверхности жидкости (поверхность раздела раствор/газ), при которой адсорбция не локализована, так как молекулы подвижны и образуют двумерную газо- или жидкообразную пленку.
Обусловлено это тем, что основные положения модели Ленгмюра соблюдаются при адсорбции из растворов: поверхность жидкости идеально однородна, взаимодействие адсорбированных молекул в адсорбционном слое мало отличается от их взаимодействия в растворе. Оно к тому же ослаблено за счет взаимодействия молекул растворенного вещества с молекулами растворителя и практически не влияет на адсорбцию.
Уравнение Ленгмюра связано с уравнением состояния адсорбционной пленки – уравнением Гиббса. Так,
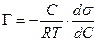
а по уравнению Ленгмюра
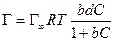
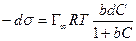
После интегрирования в пределах от sо до s и от 0 до С получим:
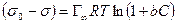
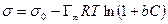
где Г¥ связано с площадью, занимаемой 1 моль адсорбированного вещества в мономолекулярном слое, следующим соотношением: 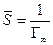
Дата добавления: 2016-02-09 ; просмотров: 2845 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Адсорбция на границе раздела раствор-газ. Уравнение Гиббса
Любая жидкость стремиться принять такую форму, при которой ее поверхность при данном объеме была бы минимальной (шар). Поверхность жидкости, граничащая с другой средой, обладает свойствами, отличными от свойств остальной массы жидкости. Поверхностный слой жидкости можно рассматривать подобным упругой пленке, стремящейся сжать жидкость. Причина этого состоит в том, что молекулы поверхностного слоя находятся в ином энергетическом состоянии, чем молекулы внутри жидкости. Каждая молекула окружена другими молекулами и силы взаимодействия ее с этими молекулами распределены симметрично.
Благодаря этому, все молекулы внутри жидкости, можно рассматривать как бы пребывающими в состоянии равновесия. В ином положении находятся молекулы поверхностного слоя. Эти молекулы оказываются под действием сил притяжения, преимущественно со стороны жидкости вследствие чего они как бы втягиваются внутрь жидкости. Стремление поверхностных молекул втянуться внутрь, связано с внутренним давлением. Чем выше это давление, тем больше поверхностное натяжение.
Под влиянием внутреннего давления поверхностный слой стремиться сократиться. Этим обстоятельством обусловлено стремление жидкости занять при неизменном объеме минимальную поверхность, например сферическая форма капель. (Силы притяжения, равные внутреннему давлению, втягивают молекулы жидкости с поверхности в глубь объема, уменьшая площадь поверхности до минимально возможной при данных условиях. Этим объясняется шарообразная форма мелких капель жидкости, находящихся в свободном состоянии в аэрозолях, туманах, эмульсиях.)
В чистой жидкости состав поверхностного слоя одинаков с составом ее в объеме. При растворении какого-либо вещества в растворителе возможны три различных случая:
1.растворение данного вещества в растворителе не изменяет поверхностного натяжения растворителя
2. растворение повышает поверхностное натяжение растворителя
3 растворение понижает поверхностное натяжение растворителя.
Так как, поверхностная энергия стремится к минимуму, то в случае, когда растворение повышает поверхностное натяжение поверхностный слой должен быть беднее растворенным веществом, чем раствор в объеме. Наоборот, когда растворение понижает поверхностное натяжение растворителя, концентрация растворенного вещества в поверхностном слое становиться больше, чем в объеме раствора. Обеднение или обогащение поверхностного слоя растворенным веществом идет до тех пор, пока этот процесс не уравновесится диффузией, при которой самопроизвольно происходит переход вещества в более бедную этим веществом часть фазы. Повышение или понижение концентрации растворенного вещества в поверхностном слое раствора является адсорбцией.
При рассмотрении явлений адсорбции растворенного вещества на границе раствор-газ молекулярно-кинетические представления малопригодны. Здесь рассматриваются явления с термодинамических позиций и связывают адсорбцию растворенного вещества с изменением свободной энергии поверхности. Свободная поверхностная энергия F равна произведению поверхности S на поверхностное натяжение δ.
Поверхностное натяжение является важной характеристикой любой жидкости.
δ Н2О =72,75 ∙10 –3 н/м
δ СН3СООН =27,63 10 –3 н/м.
Поверхностное натяжение находится в связи с величиной внутреннего давления жидкости, чем выше давление, тем больше поверхностное натяжение. Поверхностное натяжение жидкостей уменьшается с повышением температуры и становится равным нулю при критической температуре:
Физический смысл поверхностного натяжения может иметь энергетическое и силовое выражения. Энергетическое выражение в этом случае δ равна работе, затраченной на образование единицы поверхности. Энергетической единицей является дж/м 2 Силовое определение поверхностного натяжения: — это сила, действующая на поверхности по касательной к ней и стремящаяся сократить свободную поверхность тела до наименьших возможных пределов при данном объеме. Единицей измерения является н/м. Поверхностное натяжение определяется экспериментальным путем. Методы измерения делят на :
статистический – метод капиллярного поднятия лежачей или висячей капли, динамический – метод капиллярных волн, колеблющихся струй.
Наличием поверхностного натяжения можно объяснить многие биологические процессы. Например, личинки малярийного комара благодаря поверхностному натяжению подвешиваются к поверхности воды сноими дыхательными трубочками и пользуются кислородом воздуха. Если искусственно понизить поверхностное натяжение воды, то личинки погрузятся в воду и от недостатка кислорода погибнут. Наличием поверхностного натяжения воды можно объяснить, почему водяные пауки, которые бегают в тихую погоду по поверхности небольших водоемов и не тонут.
Свободная поверхностная энергия может быть уменьшена не только за счет уменьшения поверхности, но и за счет поверхностного натяжения и увеличена за счет увеличения δ, что достигается в растворах изменением их состава. Если в растворе содержится вещество, перенос которого в поверхностный слой требует меньше энергии, чем перенос в поверхностный слой молекул растворителя, то будет происходить накопление этого вещества в поверхностном слое. Происходит адсорбция, и растворенного вещества в поверхностном слое станет больше, чем в слое такой же толщины в объеме раствора. Если в растворе содержится вещество, перенос которого в поверхностный слой требует больше энергии, чем перенос молекул растворителя, то будет происходить уменьшение этого вещества в поверхностном слое и растворенного вещества в поверхностном слое станет меньше, чем в слое такой же толщины в объеме раствора.
Количественное соотношение между адсорбцией Г растворенного вещества (1 Кмоль на 1м 2 поверхности) и изменением поверхностного натяжения с концентрацией раствора определяется уравнением Гиббса (1878)
Значение dδ/dC 0 соответствует накоплению вещества в поверхностном слое, т е растворенного вещества больше чем во всем объеме. (положительная адсорбция), если dδ/dC>0 , то Г 0 С –2,7г на 1-00 г воды)
Исследование водных растворов жирных кислот показало, что для них зависимость поверхностного натяжения от концентрации выражается уравнением Б.И. Шишковского (1909)
в и К- постоянные, в- одинаково для всего гомологического ряда, а К увеличивается в 3-3,5 раза для каждого последующего члена ряда в соответствии с правилом Траубе.
Явление адсорбции имеют большое практическое значение. Адсорбция газов и паров на твердых адсорбентах лежит в основе сорбционной техники, применяемой для борьбы с отравляющими и вредными для здоровья газами и парами в воздухе, как для военных целей так и в работе ряда производств. Адсорбция газов и паров имеет первостепенное значение при кондиционировании воздуха.
Большое значение имеет применение адсорбентов (угля, силикагеля) для улавливания паров бензина при химической чистке тканей, сероуглерода — в резиновой промышленности, паров летучих растворителей в производстве лаков, целлулоида, искусственных волокон, кинопленки. С явлениями адсорбции связано получение устойчивых эмульсий, играющих огромную роль в пищевой, кожевенной, фармацевтической и др отраслях промышленности. Адсорбция из растворов нашла применение для хроматографического анализа. Он основан на разделении компонентов раствора, благодаря их различной адсорбируемости, на одном и том же адсорбенте.
Контрольные вопросы
1.Вещества поглотители называются…
2. По линейной изотерме Фрейндлиха можно определить…
3. Ионная адсорбция может протекать по механизмам…
4.Правило открытое Панетом и Фаянсом основано…
5.Важнейшей характеристикой сорбционного процесса является… 6.Сорбатами называются …
7.Твердые поверхности несмачиваемые водой называются
8. Гидрофильными называются поверхности…
9.Гидрофобными называются поверхности…
10.Гетерополярными адсорбентами называются …
12.Количественной мерой процесса смачивания служит…
13.Наиболее глубокое взаимодействие поглощенного ве-щества и поглотителя с образованием нового химическо-го вещества называется
А. Абсорбцией В. Хемосорбцией С. Десорбцией D. Адсорбцией
Е. Капилярной конденсацией
13.Обратный процесс сорбции называется
А. Адсорбцией В. Хемосорбцией С. Десорбцией
D. Абсорбцией Е.Капилярной конденсацией
Задачи
1.Рассчитать, сколько органической кислоты может быть поглощено почвой,
если в почвенном растворе установилась равновесная концентрация 12,1 моль/л., Константы уравнения Фрейндлиха равны: К=1,5, 1/n =0,15.
2.Рассчитать, сколько органической кислоты может быть поглощено почвой, если в почвенном растворе установилась равновесная концентрация 2,3 моль/л. Константы уравнения Фрейндлиха равны: К=2,5, 1/n =0,6.
Реферат: Адсорбция и адсорбционные равновесия
| Название: Адсорбция и адсорбционные равновесия Раздел: Рефераты по химии Тип: реферат Добавлен 16:01:44 27 января 2009 Похожие работы Просмотров: 6813 Комментариев: 24 Оценило: 7 человек Средний балл: 4.3 Оценка: 4 Скачать | ||||||||
| 1. Изотерма (рис. 8) | 2. Изобара | 3. Изостера |
| А =fT (c) | А =fP (T) | c=fA (T) |
| A=fT (P) | A=fC (T) | P=fA (T) |
Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции. Адсорбционное уравнение Гиббса
Считаем V поверхности раздела = 0.
dU = TdS + s dS +
Проинтегрировав, получим: U = TS + sS +
Полный дифференциал от этого уравнения:
dU = TdS + SdT + s dS + 

Подставляя значение dU из (6) в (7) и сократив одинаковые члены правой и левой части, получим:
SdT + Sd s + 
Предположим, что T = const:
Разделив правую и левую часть на поверхность S , получим фундаментальное адсорбционное уравнение Гиббса :



Определение зависимости поверхностного натяжения от адсорбции одного компонента, при постоянстве химических потенциалов других компонентов.

Известно, что 



Активность связана с концентрацией: с = × а . Предположим, что = 1 (при с ® 0). Тогда

Обычно уравнение Гиббса применяют для растворов. Растворителем может быть не только индивидуальное вещество, но и смесь. В разбавленных растворах гиббсовская адсорбция очень мала, а его химический потенциал меняется очень мало с изменением концентрации растворенного вещества, т.е. d m= 0. Поэтому для разбавленного раствора фундаментальное уравнение Гиббса выглядит так:
Из этих уравнений следует, что зная зависимость 

Зная эти производныеуравнения Гиббса, можно рассчитать значение Г , что позволяет построить зависимость Г = f (С) . Уравнение Гиббса показывает, что единица измерения гиббсовской адсорбции не зависит от единицы измерений концентрации, а зависит от размерности величины R . Так как величина R отнесена к молю вещества, а s — к единице площади, то Г = [моль/ единица площади]. Если s выразить в [Дж/м 2 ], то R нужно подставлять: R = 8,314 Дж/моль×К.
Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. ПАВ. Эффект Ребиндера. Правило Дюкло-Траубе
В уравнении Гиббса влияние природы вещества на адсорбцию отражается производной

g = [Дж×м/моль] = [Н×м 2 /моль]; [эрг см/моль] = [Гиббс].
Уравнение показывает, что чем сильнее снижается 
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции .
Поверхностную активность можно представить как отрицательный тангенс угла наклона к касательной, проведенной к кривой Г = f ( C ) в точке пересечения с осью ординат. Поверхностная активность может быть положительной и отрицательной. Значение и знак ее зависят от природы растворенного вещества и растворителя.
1. 
1. 
http://allrefrs.ru/2-28731.html
http://www.bestreferat.ru/referat-102895.html