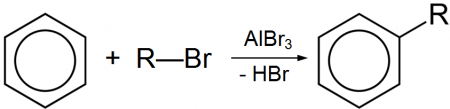Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df6fcdbade79770 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Бромид алюминия
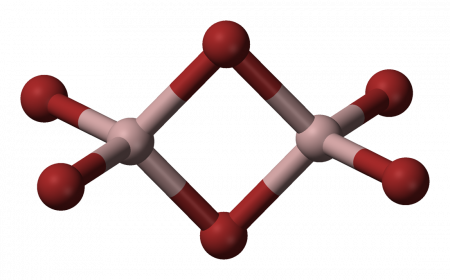
Бромид алюминия (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула Al +3 Br 3 −1 . Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6. Содержание
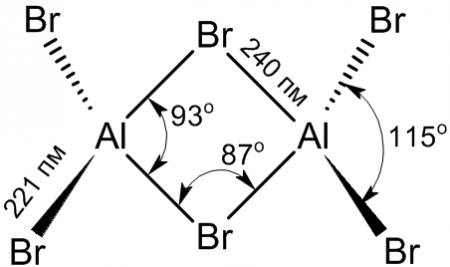
Физические свойстваБезводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C. В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно. Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома. Координационное число алюминия в молекуле бромида равно 4. Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль. Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор). Химические свойства
AlBr3 + 4 H2O ⇆ [Al(H2O)4] 3+ + 3Br − [Al(H2O)4] 3+ + H2O ⇆ [Al(H2O)3(OH)] 2+ + H3O + При нагревании водного раствора гидролиз можно провести полностью: AlBr3 + 3 H2O = Al(OH)3 ↓ + 3 HBr ↑
AlBr3 + 3 NaOH = Al(OH)3 ↓ + 3 NaBr AlBr3 + 4 NaOH = Na[Al(OH)4] + 3 NaBr
AlBr3 + H2S = AlBr3 ⋅ H2S
2 AlBr3 = 2 Al + 3 Br2 При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия: AlBr3 + 2 Al ⇆ 3 AlBr
AlBr3 + 4 LiH = Li[AlH4] + 3 LiBr
AlBr3 + C2H5Br → [C2H5] + [AlBr4] − ПолучениеБезводный бромид алюминия получают взаимодействием простых веществ (Al и Br2): Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой: 2 Al + 6 HBr = 2 AlBr3 + 3 H2 ↑ ПрименениеКоммерческое применение бромида алюминия в настоящий момент относительно небольшое. Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий. Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия. Соединение может выступать катализатором в реакции изомеризации бромалканов, например: Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом: Опасность для здоровьяПри контакте с кожей бромид алюминия может вызывать ожоги. Соединение умеренно ядовито: ЛД 50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно). источники: http://acetyl.ru/o/nal11br13.php http://chem.ru/bromid-aljuminija.html | ||||||||||||||||||||||||||||||||||||||||||||||||