IV аналитическая группа
Ион: Al3+
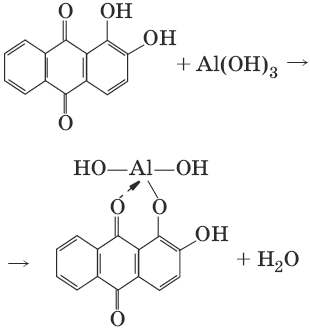
1.Реактив, условия: ализарин С14Н6O2(OH)2, NH3 • Н2O (NH4Cl)
AlCl3 + 3NH3 • H2O = Al(OH)3↓ + 3NH4Cl
Наблюдения: Розовый лак на фильтровальной бумаге.
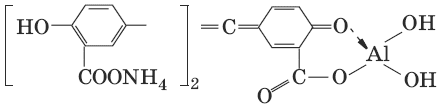
2. Реактив, условия: алюминон, CH3COOH
Уравнение реакции: алюминон с Al(OH)3 образует красный лак, которому приписывается следующая формула:
Наблюдения: розовый лак.
Ион: Сr3+
Реактив, условия: NaOH, H2O2, нагревание, амиловый спирт, H2SO4
2СrCl3 + 10NaOH + ЗН2O2 = 2К2СrO4 + 6NaCl + 8Н2O
Наблюдения: желтый раствор, при добавлении амилового спирта, H2SO4 наблюдается синее кольцо.
Ион: Zn2+
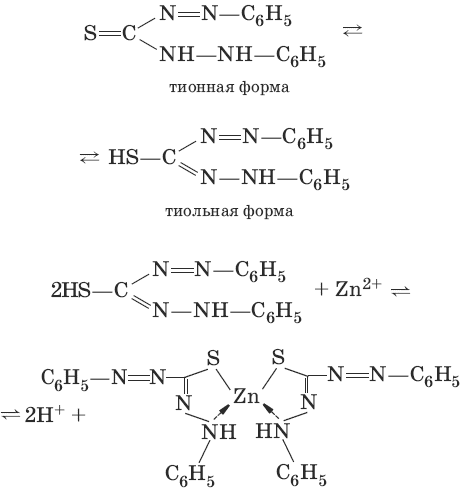
Реактив, условия: дитизон С6Н5—NH—N=C(SH)—N=N—C6H5 (дифенилкарбазон), CHCl3, рН = 2,5-10, мешают Pb2+, Cd2+, Sn2+
Наблюдения: соль красного цвета, растворимая в хлороформе (CHCl3).
Ион: AsO33-
Реактив, условия: AgNO3
Na3AsO3 + 3AgNO3 = Ag3AsO3↓ + 3NaNO3
Наблюдения: желтый аморфный осадок, растворим в концентрированном растворе аммиака и в азотной кислоте (использовать спец. слив!).
Ион: AsO43-
1. Реактив, условия: магнезиальная смесь (MgCl2 + NH4Cl + NH3), мешает PO43-
NH4Cl + MgCl2 + Na3AsO4 = NH4MgAsO4↓ + 3NaCl
Наблюдения: белый кристаллический осадок (использовать спец. слив!).
2. Реактив, условия: AgNO3
Na3AsO4 + 3AgNO3 = Ag3AsO4↓ + 3NaNO3
Наблюдения: осадок шоколадного цвета (использовать спец. слив!).
3. Реактив, условия: (NH4)2S или H2S, конц. HCl
5H2S + 2Na3AsO4 + 6HCl = As2S5↓ + 8Н2O + 6NaCl
Наблюдения: осадок желтого цвета (использовать спец. слив!).
Ион: Sn2+
1. Реактив, условия: Bi(NO3)3, pH > 7
SnCl2 + NaOH = Sn(OH)2↓ + 2NaCl
Sn(OH)2 + 2NaOH(изб.) = Na2[Sn(OH)4] + 2NaCl
3Na2[Sn(OH)4] + 2Bi(NO3)3 + 6NaOH = 2Bi + 3Na2[Sn(OH)6] + 6NaNO3
Наблюдения: осадок черного цвета.
2. Реактив, условия: HgCl2, конц. HCl
SnCl2 + 2HCl = H2[SnCl4]
H2[SnCl4] + 2HgCl2 = H2[SnCl6] + Hg2Cl2↓
Наблюдения: осадок белого цвета, который постепенно чернеет вследствие образования металлической ртути.
Дата добавления: 2016-04-23 ; просмотров: 2353 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Как протекают различные химические процессы
Уравнения реакций хлорида алюминия с аммиаком и щелочью
Задача 1052.
Чем различается действие избытка водных растворов NH3 и NаОН на раствор АIСI3? Написать уравнения соответствующих реакций.
Решение:
При действии избытка водного раствора аммиака на хлорид алюминия образуется гель гидроксида алюминия:
При действии избытка водного раствора гидроксида натрия на хлорид алюминия образуется комплексный ион [Al(OH)4(H2O)2] − :
Расчет энергии Гиббса
Задача 1053.
Пользуясь табличными данными приложения, установить, возможно ли самопроизвольное протекание реакции:
4А1 + 3СО2 = 2А12О3 + 3С.
Решение:
Уравнение реакции:
Находим стандартные значения энергии Гиббса образования веществ, участвующих в реакции из таблиц, учитывая, что значения энергии Гиббса простых веществ равны нулю. ΔG 0 (СО2) = -394,6 кДж/моль; ΔG 0 (Al2O3) = -1583,3 кДж/моль.
ΔG 0 = 2ΔG 0 (Al2O3) — 3ΔG 0 (СО2) = 2(-1583,3) – 3(-394,6) = -19823,8 кДж.
Определение массы электрода гальванического элемента
Задача 1054.
При работе гальванического элемента: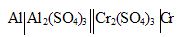
Решение:
MЭ(Al 3+ ) = M(Al 3+ )/3 = 26, 981/3 = 8,999 г/моль; MЭ(Cr 3+ ) = M(Cr 3+ )/3 = 51,998/3 = 17,332 г/моль.
При работе гальванического элемента на электродах, согласно закону эквивалентов, происходит эквивалентное окисление и восстановление металлов, получим:
Находим массу алюминия, на которую уменьшился алюминиевый электрод, получим:
m(Al) = m(Cr 3+ )/MЭ(Cr 3+ ) . MЭ(Al 3+ ) = 31,2/17,332 . 8,999 = 16,198 г.
Аммиак. Задача № 34 из ФИПИ 2020 с объяснениями
Сегодня мы будем решать и разбирать очередную задачу № 34 из ЕГЭ 2020 года.
Задача:
Насыщенный раствор хлорида алюминия (растворимость 46 грамм в 100 граммах воды при 20 С) массой 50,85 грамм разлили в две колбы: в первую добавили избыток раствора Na2CO3, во вторую 20,4 грамма 25%-ного раствора аммиака. Во второй колбе осадок в 2 раза тяжелее, чем в первой. Найдите концентрацию аммиака во второй колбе после окончания реакции.
Решение:
Для начала необходимо составить уравнения химических реакций (как и в других реакциях, где есть химический процесс).
В условии сказано, что есть хлорид алюминия (AlCl3), который разлили в две колбы: в первой был раствор карбонат натрия, во второй — раствор аммиака.
Если ты забыл как аммиак реагирует с различными веществами, в то числе, с солями, рекомендую освежить знания по теме: Аммиак
А пока мы запишем две реакции:
Объяснять, как уравнивать я не буду, ты это уже знаешь.
А по поводу воды в этих двух реакциях уточняю: если у тебя в условии указан раствор какого — то вещества, то химическая реакция однозначно будет с участием H2O .
Идем дальше!
Первое вещество, с которого мы начнем расчеты — это хлорид алюминия.
Сначала ищем его массу с учетом растворимости (см. условие), для этого составляем пропорцию:
46 / (46 + 100) = x / 50,85,
x = 46 * 50,85 / 146 = 16,02 грамм.
Теперь находим количество вещества AlCl3:
Молярная масса хлорида алюминия (по таблице ПСЭ) равна 133,5 грамм/ моль; n (AlCl3) = 16,02 / 133,5 = 0,12 моль.
Мы нашли моль AlCl3, но вопрос — к какой именно реакции его отнести?
У нас ведь две реакции, с карбонатом натрия и аммиаком, и в обеих есть хлорид алюминия.
Как же быть? Верный ответ — 0,12 моль представляет собой общее количество хлорида, и нужно составить маленькое уравнение (без него никак):
Возьмем количество AlCl3 из первой реакции за x, а этот же хлорид из второй реакции — за y.
В итоге пишем: x + y = 0,12 моль.
Если посмотреть на данные химические реакции, то заметим, что количество хлорида алюминия в первой и второй реакциях не равны:
— в первой перед AlCl3 стоит 2,
— во второй — 1.
Это означает, что мы имеем две соли, которые взяты в неравных количествах, и данную деталь нельзя игнорировать.
Поэтому, пишем так: y = 2x.
Теперь соединяем эти два действия в одно уравнение:
Решив их, получаем:
Что делаем теперь?
Через количество хлорида алюминия мы можем найти все остальное, но нам не нужно искать все вещества, мы ищем аммиак:
1) Вначале вычисляем массу аммиака (чистого): m (NH3) =0,25 * 20,4 = 5,1 грамм.
(По условию аммиак был взят 25%-й в массой 20,4 грамма, нужно узнать его чистую массу)
2) Молярная масса аммиака: 17 грамм / моль; n (NH3) = 5,1 / 17 = 0,3 моль.
3) Теперь необходимо узнать, сколько аммиака прореагировало. Но здесь есть вопрос — а как мы это узнаем?
Ответ прост: по уравнению, моль хлорида алюминия (по которому мы и находим все остальные вещества) во второй реакции = 0,08 моль. Значит, моль аммиака будет в три раза больше (см. на реакцию, перед аммиаком стоит цифра 3).
Путем нехитрого действия находим: 0,08 моль * 3 = 0,24 моль.
4) Далее вычитаем от начального количества аммиака его прореагировавшее количество: 0,3 — 0,24 = 0,06 моль.
Так как аммиак взят в избытке, то решаем по недостатку(Al(OH)3 по второй реакции). Однако, без аммиака нельзя, так как в задаче его и нужно найти.
5) Следующим шагом находим массу аммиака: 0,06 * 17 = 1,02 грамма.
В условии задачи необходимо найти массовую долю аммиака, но без массы это невозможно.
Следующий шаг.
С NH3 мы пока закончили, на очереди — гидроксид алюминия (Al(OH)3) , который выпал в осадок, и мы не имеем права не учитывать его по причине того, что при нахождении общей массы раствора необходимо убрать все вещества, которые являются осадками или газами.
1) Получим его моль: n (Al(OH)3) = n (AlCl3) = 0,08 моль.
Смотри на вторую реакцию, перед гидроксидом алюминия, как и перед хлоридом алюминия нет коэффициентов, а значит, их взято одинаковое количество, отсюда и равное число моль.
2) Молярная масса Al(OH)3 = 78 грамм / моль; m ( Al(OH)3 ) = 0,08 * 78 = 6,24 грамм.
Далее:
Учитывая, что моли хлорида алюминия в двух реакциях одинаковы, значит, концентрация так же одинакова.
0,12 / 50,85 = 0,08 / x;
x = 0,08 * 50,85 / 0,12 = 33,9 грамм.
Рассмотрим подробнее данное действие:
- 0,12 — это моль хлорида алюминия (общий),
- 50,85 — это масса AlCl3 по условию (общая),
- 0,08 моль — это количество вещества хлорида алюминия.
Через пропорцию находим массу AlCl3.
Осталось самое последнее действие!
Найдем массовую долю аммиака:
ω (NH3) = 1,02 / (33,9 + 20,4 – 6,24) = 1,02 / 48,06 = 0,0212, или 2,12%.
Здесь мы делим полученную массу аммиака на массу раствора (без осадка).
Массу раствора найдем по формуле:
масса хлорида алюминия + масса аммиака — осадок Al(OH)3 .
http://buzani.ru/zadachi/khimiya-glinka/1352-uravneniya-khimicheskikh-reaktsij-zadachi-1052-1054
http://pangenes.ru/post/ammiak-zadacha-no-34-iz-fipi-2020-s-obyasneniyami.html