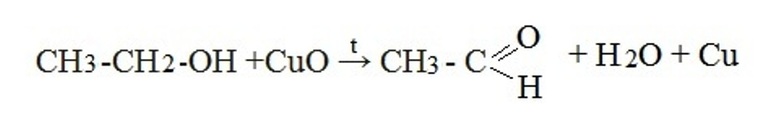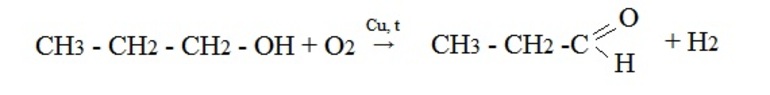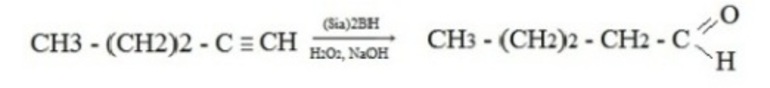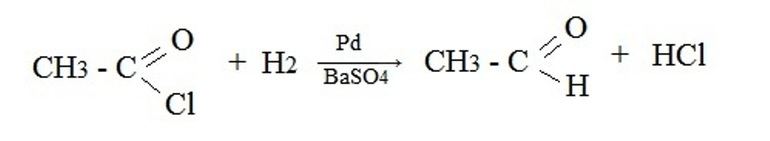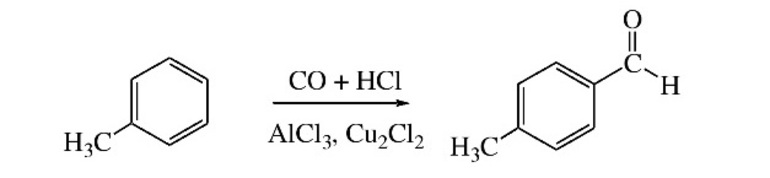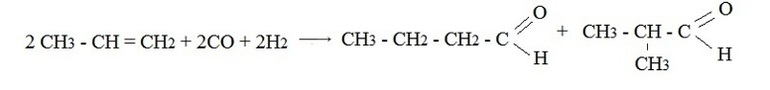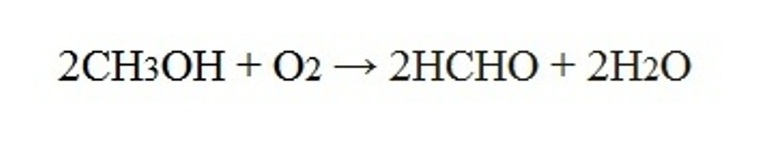Получение альдегидов

Средняя оценка: 4.1
Всего получено оценок: 217.
Средняя оценка: 4.1
Всего получено оценок: 217.
Альдегиды – это производные углеводородов, молекулы которых содержат карбонильную группу. Какие же способы получения альдегидов существуют, и при каких реакциях происходит их образование?
Что такое альдегиды?
Альдегиды – кислородосодержащие производные углеводородов, содержащие карбонильную группу С=О. В альдегиде две валентности атома углерода карбонила заняты алкильным радикалом и атомом водорода. Общая структурная формула альдегида выглядит следующим образом:

Для альдегидов характерна изомерия углеводородного радикала. Они могут иметь неразветвленную или разветвленную цепь. По международной номенклатуре ИЮПАК (IUPAC) названия альдегидов производят от названий соответствующих углеводородов с прибавлением суффикса -аль, или от исторически сложившихся названий соответствующих карбоновых кислот, в которые они превращаются при окислении (муравьиный альдегид, уксусный альдегид и т.д.).
Альдегиды могут находится в жидком, газообразном или твердом состоянии. Газом является формальдегид, остальные члены ряда альдегидов – жидкости, а высшие альдегиды – твердые вещества
Получение альдегидов
Основные способы получения следующие:
- окисление спиртов. Альдегиды получают при окислении первичных спиртов, а кетоны при окислении вторичных. Альдегиды, полученные из первичных спиртов, которые потом окисляются до карбоновых кислот. Чтобы альдегид не превратился в кислоту, его отгоняют в ходе реакции:

- дегидрирование спиртов. В результате этого процесса пары спирта пропускают над нагретым катализатором. Этот способ позволяет получать карбонильные соединения без побочных продуктов окисления
В роли катализаторов могут выступать Cu, Ag, Cr,Zn.
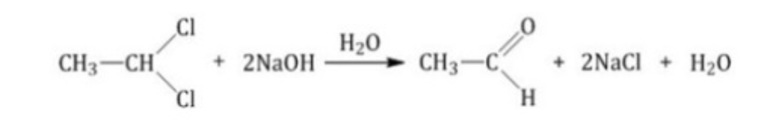
- гидролиз дигалогенпроизводных. При действии воды образуются нестойкие двухатомные спирты, которые в момент образования выделяют воду; образуются соединения с карбонильной группой. Реакция ускоряется в присутствии щелочей.
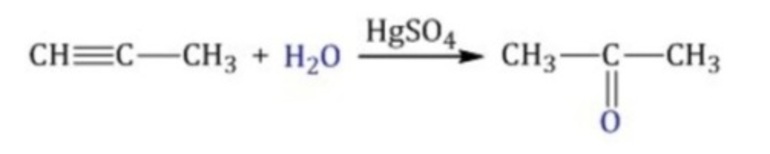
- гидратация алкинов. При гидратации ацетилена образуется уксусный альдегид, при гидратации гомологов ацетилена – кетоны. При гидратации алкинов (реакция Кучерова) происходит присоединение воды к ацетилену в присутствии солей ртути, в результате чего образуется ацетальдегид:

Что мы узнали?
Альдегиды, как и кетоны, образуются от углеводородов. Образование альдегидов происходит в результате разных реакций, например, при окислении спиртов, дегидрировании спиртов, гидратации алкинов, гидролизе дигалогенпроизводных. Также в данной статье представлены уравнения реакций получения альдегидов.
Получение альдегидов — уравнения химических реакций
Получение альдегидов в лаборатории
Все свойства химических веществ зависят от электронного строения их молекул. В карбонильной группе атом кислорода, как более электроотрицательный по сравнению с атомом углерода, перетягивает на себя электронную плотность двойной связи. Это ведет к поляризации связи и появлению частичных зарядов — положительного заряда у углерода и отрицательного у кислорода.
В карбоксильной группе степень окисления углерода равна +1, это промежуточный заряд, который можно достигнуть с помощью окисления или восстановления различных углеродсодержащих веществ. Ряд кислородсодержащих органических соединений с повышением степени окисления углерода, связанного с функциональной группой, выглядит следующим образом:
Спирты → Альдегиды → Карбоновые кислоты.
Таким образом, все лабораторные методы получения карбонильных соединений можно условно разделить на 3 группы:
- Окислительные методы.
- Восстановительные методы.
- Получение ароматических альдегидов.
Синтез ароматических соединений вынесен отдельно только для тех химических взаимодействий, в которых принимает участие бензольное кольцо.
Окислительные методы
В качестве исходных веществ в реакциях окисления используют первичные спирты, дигалогенпроизводные алканов и алкины. При окислении вторичных спиртов получаются кетоны, таким образом, получение альдегидов и кетонов имеет схожий механизм.
Рассмотрим примеры химических уравнений.
- Окисление первичных спиртов оксидом меди или реакция дегидратации (отщепление воды):
- Окисление спиртов кислородом на медной сетке или дегидрирование (отщепление водорода):
- Реакция Кучерова, или окисление алкинов путем присоединения воды в присутствии солей ртути. При гидратации ацетилена образуется ацетальдегид, при гидратации других алкинов в этих условиях образуются кетоны:
- Гидроборирование алкинов в присутствии щелочного раствора перекиси водорода, в этом случае присоединение происходит против правила Марковникова:
- Гидролиз дигалогеналканов в присутствии раствора щелочи:
В результате обратной реакции восстановления карбонильных соединений получаются исходные вещества, которые были взяты для их получения.
Например, в результате гидрирования (присоединения водорода) ацетальдегида образуется этиловый спирт.
Восстановительные методы
В качестве исходных реагентов используют производные карбоновых кислот: хлорангидриды, сложные эфиры, амиды и т.п. Например, восстановление водородом хлорангидрида уксусной кислоты на палладиевом катализаторе:
Ароматические альдегиды
Ароматические альдегиды можно получить в лаборатории теми же способами, что и альдегиды жирного ряда. Это могут быть реакции дегидратации и дегидрирования ароматических спиртов, гидролиз дигалогенпроизводных углеводородов ароматического ряда, восстановление производных карбоновых кислот. Уравнения этих взаимодействий будут аналогичны тем, которые были рассмотрены выше.
Специфической реакцией лабораторного синтеза ароматических альдегидов является введение в ароматическое ядро карбоксильной группы – формилирование. Исходные вещества – любой ароматический углеводород, угарный газ плюс хлористый водород, катализатор — смесь хлористого алюминия с монохлоридом меди.
Промышленные способы
В настоящее время известен целый ряд электросинтезов альдегидов, которые перспективны в промышленном производстве лекарственных, парфюмерных, реактивных и других препаратов. Один из наиболее распространенных способов – оксосинтез. Этим способом можно получить карбонильные соединения, содержащие в своем составе три атома углерода и более. В основе реакции лежит гидроформилирование алкенов синтез-газом (смесь угарного газа с водородом).
Продуктами оксосинтеза является смесь альдегидов, соотношение которых можно изменять в результате подбора соответствующих катализаторов.
Дегидрирование первичных спиртов используется в промышленности только для получения уксусного альдегида. В качестве сырья выступает этиловый спирт, важным условием реакции является наличие катализатора (медь, активированная церием) и высоких температур в пределах 270-300˚С. За один цикл в реакцию вступает 25-50% этанола, выход продукта составляет 90-95%. В виде побочных продуктов реакции образуются этилен, этилацетат и высшие спирты.
При производстве формальдегида (метаналя) используется процесс окисления муравьиного спирта при температуре 400-450˚С, одно из условий – избыток кислорода. В качестве катализатора выступают оксиды железа и молибдена.
Получение ацетальдегида в результате гидратации ацетилена потеряло свое промышленное значение. Причиной является высокая токсичность катализатора реакции – ртути сернокислой. Ацетальдегид и акролеин в промышленности получают в результате окисления алкенов. Реакция проходит в присутствии смеси хлоридов палладия и меди. В качестве сырья для получения уксусного альдегида используют этилен, для получения акролеина – пропилен.
Основным сырьем для получения различных ароматических карбонильных соединений является бензальдегид. Промышленное получение бензальдегида основывается на реакции гидролиза бензальхлорида. В качестве гидролизующих агентов используют углекислые соли натрия или кальция, гидроксиды натрия или кальция, а также кислоты с добавлением соответствующих солей металлов.
Использование тех или иных методов получения альдегидов обусловлено процентом выхода продукта химической реакции, доступностью исходного сырья и возможностью соблюдения условий синтеза.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://nauka.club/khimiya/poluchenie-aldegidov.html http://acetyl.ru/f/o175.php |