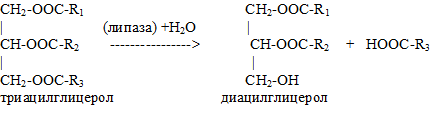Альфа амилаза уравнение катализируемой реакции
Pandey A, Nigam P, Soccol CR, Soccol VT, Singh D, Mohan R.
«Advances in microbial amylases.»
Biotechnol Appl Biochem. 2000, 31 ( Pt 2), 135-52. PubMed: 10744959
Dreher ML, Dreher CJ, Berry JW.
«Starch digestibility of foods: a nutritional perspective.»
Crit Rev Food Sci Nutr. 1984, 20(1), 47-71. PubMed: 6380959
Keskin SO, Sumnu G, Sahin S.
«Usage of enzymes in a novel baking process.»
Nahrung. 2004, 48(2), 156-60. PubMed: 15146975, doi: 10.1002/food.200300412
Lee S, Mouri Y, Minoda M, Oneda H, Inouye K.
«Comparison of the wild-type alpha-amylase and its variant enzymes in Bacillus amyloliquefaciens in activity and thermal stability, and insights into engineering the thermal stability of bacillus alpha-amylase.»
J Biochem (Tokyo). 2006, 139(6), 1007-15. PubMed: 16788051, doi: 10.1093/jb/mvj107
Lee S, Oneda H, Minoda M, Tanaka A, Inouye K.
«Comparison of starch hydrolysis activity and thermal stability of two Bacillus licheniformis alpha-amylases and insights into engineering alpha-amylase variants active under acidic conditions.»
J Biochem (Tokyo). 2006, 139(6), 997-1005. PubMed: 16788050, doi: 10.1093/jb/mvj113
Han XZ, Ao Z, Janaswamy S, Jane JL, Chandrasekaran R, Hamaker BR.
«Development of a low glycemic maize starch: preparation and characterization.»
Biomacromolecules. 2006, 7(4), 1162-8. PubMed: 16602734, doi: 10.1021/bm050991e
Synowiecki J, Grzybowska B, Zdzieblo A.
«Sources, properties and suitability of new thermostable enzymes in food processing.»
Crit Rev Food Sci Nutr. 2006, 46(3), 197-205. PubMed: 16527752, doi: 10.1080/10408690590957296
Reynolds KA, Watt PM, Boone SA, Gerba CP.
«Occurrence of bacteria and biochemical markers on public surfaces.»
Int J Environ Health Res. 2005, 15(3), 225-34. PubMed: 16134485
Zeikus JG, Vieille C, Savchenko A.
«Thermozymes: biotechnology and structure-function relationships.»
Extremophiles. 1998, 2(3), 179-83. PubMed: 9783163
Амилаза
α‑Амилаза (диастаза, 1,4‑a‑D‑глюкангидролаза, КФ 3.2.1.1.) катализирует гидролиз α‑1,4‑глюкозидных связей крахмала, гликогена и родственных им полисахаридов до мальтозы, декстринов и других полимеров. Молекулярная масса фермента около 48000 Д. В состав молекулы входит атом кальция, который не только активирует фермент, но и защищает его от действия протеиназ, активность амилазы возрастает при влиянии ионов хлора. В крови она представлена двумя изоферментами: панкреатическим — P‑тип и слюнным — S‑тип, каждый из которых делится на несколько фракций. Изофермент S‑типа составляет в целом 45‑70% (в среднем 57%), остальное приходится на долю P‑типа. Оба изофермента имеют почти идентичные каталитические и иммунологические свойства, незначительно отличаются по электрофоретической подвижности, но хорошо разделяются при гель‑фильтрации на ДЭАЭ‑сефадексе. Существует также макроамилаза, которая не выделяется почками, но может встречаться в сыворотке крови в норме (около 1 % здоровых людей) и патологии (2,5 %).
Высокая активность амилазы наблюдается в околоушной и поджелудочной железах. Вместе с тем, ее активность, хотя и намного ниже, обнаруживается в толстом и тонком кишечнике, скелетных мышцах, печени, почках, легких, фаллопиевых трубах, жировой ткани. В крови фермент связан как с белками плазмы крови, так и с форменными элементами. Активность фермента одинакова у мужчин и у женщин и не зависит от характера принимаемой пищи и времени суток.
Существующие методы изучения активности a‑амилазы в биологических жидкостях делятся на две большие группы:
1. Сахарифицирующие (редуктометрические), основанные на исследовании образующихся из крахмала сахаров по редуцирующему действию глюкозы и мальтозы.
2. Амилокластические , базирующиеся на определении остатка нерасщепленного крахмала:
- по степени интенсивности его реакции с йодом. Эти методы более чувствительны и специфичны, но точность их во многом зависит от качества крахмала и оптимизации условий определения.
- по вязкости суспензии крахмала, не отличаются высокой точностью и сейчас не применяются.
3. Методы с применением хромогенных субстратов –– основаны на использовании комплексов субстрат‑краситель, которые под действием α‑амилазы распадаются с образованием водорастворимого красителя.
4. Методы, основанные на сопряженных ферментативных реакциях :
Крахмал + Н2О 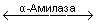
Мальтоза + Н2О 
Глюкоза + АТФ 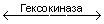
Глюкозо‑6‑Ф+НАДФ 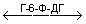
Активность фермента устанавливается по скорости накопления НАДФН.
В качестве унифицированных утверждены два амилокластических метода: Каравея (со стойким крахмальным субстратом) и Смита‑Роэ.
Определение активности амилазы с окрашенным
субстратом по набору фирмы «Lachema»
Принцип
α‑Амилаза катализирует гидролиз нерастворимого цветного крахмального субстрата с образованием синего, растворимого в воде красителя. Количество освобожденного красителя пропорционально каталитической активности фермента.
Нормальные величины
| Сыворотка | указанный метод | 2,3‑5,8 мккат/л |
| по Каравею | 12‑32 мг/с·л | |
| по Смиту‑Рое | 4,4‑8,3 мг/с·л | |
| У новорожденных значения активности ниже в 2‑5 раз. | ||
| Моча | указанный метод | 16,6‑33,3 мккат/л |
| по Каравею или Смиту‑Рое | Завышение результатов наблюдается при стрессовых состояниях, при сокращении сфинктера Одди под воздействием, например, наркотических анальгетиков, сниженные результаты получаются при использовании оксалата и цитрата. | |
Клинико‑диагностическое значение
Повышение активности фермента происходит главным образом при заболеваниях поджелудочной железы. При остром панкреатите активность в крови и моче возрастает в 10‑30 раз. Гиперамилаземия наступает в начале заболевания, достигает максимума к 12‑24 ч, затем снижается и приходит к норме на 2‑6 день. Однако при тотальном панкреонекрозе может не отмечаться повышение активности амилазы. Возрастание активности фермента выявляется при беременности, почечной недостаточности, кишечной непроходимости, заболеваниях желчных путей, диабетическом кетоацидозе, некоторых опухолях легких и яичников, поражении слюнных желез. Выявление повышенного количества изоферментов P‑ или S‑типа не патогномонично для какого‑либо заболевания.
Низкие уровни фермента в сыворотке крови не имеют существенного значения.
Классификация, свойства ферментов и составление уравнений реакций с участием ферментов
Липаза, орнитиндекарбоксилаза, амилаза, глюкозофосфатизомераза
Задание 1.
Нужно написать уравнения реакции с участием ферментов: липаза, орнитиндекарбоксилаза, амилаза, глюкозофосфатизомераза. Указать класс и подкласс ферманта.
Решение:
1.Липаза
Липаза (lipase) — фермент класса гидролаз, катализирующий гидролиз сложноэфирных связей в триглицеридах с образованием жирной кислоты и глицерина. Липазы – ферменты, которые контролируют гидролиз нейтральных жиров (триацилглицеролов):
Класс 3. Гидролазы;
Подкласс 3.1. Действующие на сложные эфиры.
Подкласс 3.1. Действующие на сложные эфиры.
Подподкласс 3.1.1. Гидролазы карбоновых кислот.
Классификационный номер — КФ 3.1.1.3.
Характеристика фермента:
Систематическое название — Триацилглицерол:ацилгидролаза.
Рабочее название — ТАГ-липаза
2. Орнитиндекарбоксилаза
Орнитиндекарбоксилаза — высокоспецифичный фермент, катализирует превращение орнитина в путресцин:
Путресцин (диаминобутан) является трупным ядом.
Орнитиндекарбоксилаза относится к классу лиазы, подклассу — углерод-углерод-лиазы. Лиазы – ферменты, катализирующие разрыв С—О, С—С, C—N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем.
Классификация орнитиндекарбоксилаз:
Класс 4. Лиазы;
Подкласс 4.1. Углерод-углерод-лиазы.
3. Амилаза
Амилаза — фермент, который катализирует реакцию гидролиза крахмала, гликогена и родственных поли- и олигосахаридов. Амилаза, присутствующий в слюне, катализирует выделение глюкозы из крахмала. При оптимальной температуре и pH одна молекула амилазы может производить 18 ООО молекул глюкозы в секунду.
Крахмал + Н2О (амилаза) → Мальтоза + Мальтотриоза + Декстрин + nС6Н12O6
Схема реакции (фермент амилаза слюны):
Классификация:
Класс 3. Гидролазы, катализирующие гидролиз химических связей.
Подкласс 3.2. Действующие на сахар (углевод).
4. Глюкозофосфатизомераза.
Глюкозофосфатизомераза относится к эпимиразам. Эпимеразы изменяют конфигурацию при одном из хиральных атомов углерода, например: взаимопревращение ?- и ?-изомеров, превращения рибулоза — ксилулоза, галактоза — глюкоза, манноза — галактоза.
Глюкозофосфатизомераза — катализирует взаимное превращение глюкозо-6-фосфата и фруктозо-6-фосфата:
Классификация:
Класс 5. Изомеразы;
Подкласс 5.1. Рацемазы и эпимеразы.
Лактатдегидрогеназа, триацилглицерол-липаза, глутатионтиолестераза (S- ацилглутатион гидролаза), гексокиназа
Задание 2.
Помогите написать уравнения реакции с участием ферментов имеющих следующий шифр: КФ 1.1.1.27., КФ 3.1.1.3., КФ 3.1.2.7., КФ 2.7.1.1.
Решение:
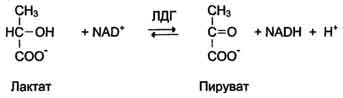
1. КФ 1.1.1.27.
Лактатдегидрогеназа (L-лактат: NAD-оксидоредуктаза (LDH) 1.1.1.27.) — фермент, принимающий участие в реакциях гликолиза. Лактатдегидрогеназа катализирует превращение лактата в пируват, при этом образуется NADH.
Например, катализирует следующую реакцию:
Лактат + НАД Лактатдегидрогеназа → Пируват + НАДН
ЛДГ катализирует передачу восстановительного эквивалента от лактата на НАД+ (NАD+) или от НАДН (NADH) на пируват.
L-лактат + НАД + → пируват + НАДН + H +
Молочная кислота (лактат) CH3-CH(OH)-COOH — 2-гидроксипропановая кислота.
Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты):
2. К.Ф.3.1.1.3.
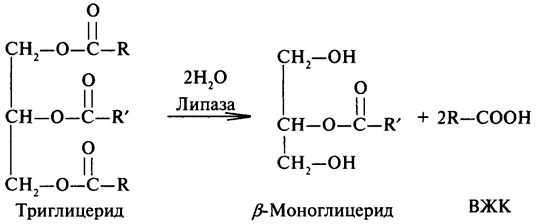
К.Ф.3.1.1.3. — это фермент липаза или триацилглицерол-липаза широко распространена в природе и играет важную роль в процессах, протекающих при переработке и хранении пищевых продуктов. В настоящие время выделены и охарактеризованы липазы растительного происхождения (липаза клещевины, пшеницы и других злаков), животного (панкреатическая липаза, липаза молока) и микробного (бактериальные и грибные липазы).
Липазы являются универсальными ферментами, используемыми для преобразования липидов. Субстратами липаз являются глицериды и другие сложные эфиры. Липазы более других представителей класса гидролаз обладают способностью катализировать различные типы реакций. Эти типы следующие:
1 – Гидролиз эфиров:
2 – Синтез эфиров:
Обычно липазы катализируют реакцию расцепления триглицеридов согласно приведенному ниже уравнени:
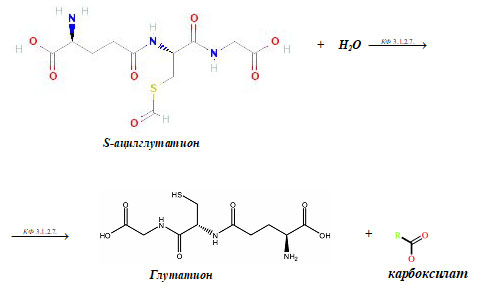
3. КФ 3.1.2.7.
КФ 3.1.2.7. — это глутатионтиолестераза (S- ацилглутатион гидролаза) или (цитрил-глутатион тиоэфиргидролаза). Этот фермент катализирует следующую химическую реакцию:
S- ацилглутатион + H2O → глутатион + карбоксилат
3. КФ 3.1.2.7.
КФ 2.7.1.1. — это фермент гексокиназа (ATР: D-гексозо-6-фосфотрансфераза), катализирует перенос фосфатной группы с АТР на моносахариды:
http://biokhimija.ru/enzymes/amilase.html
http://buzani.ru/zadachi/organicheskaya-khimiya/1652-klassifikatsiya-fermentov-zadanie-1-2