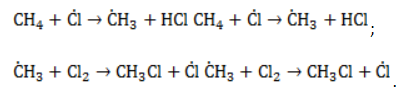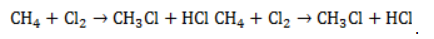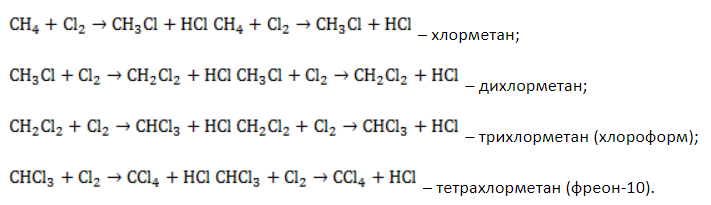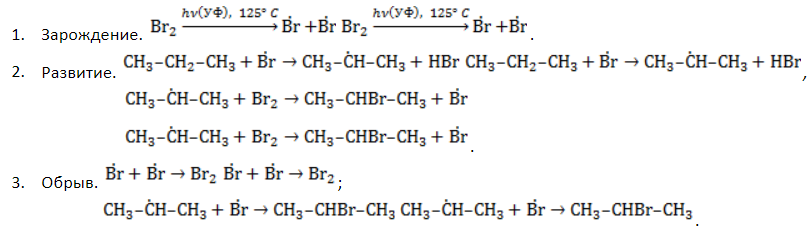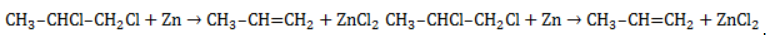8. Схеме алкан + галоген→ cоответствует уравнение реакции 1?
Химия | 5 — 9 классы
8. Схеме алкан + галоген→ cоответствует уравнение реакции 1.
C3H4 + 2Cl2→C3H4Cl4 2.
С2H4 + H2O→C2H5OH 3.
C2H6 + Br2→C3H6Br2 4.
C2H6 + Cl2→C2H5Cl + HCl 9.
В реакции горения пропана коэффициент перед формулой кислорода равен 1) 5 2) 8 3) 9 4) 10 10.
Реакция гидратации – это 1) реакция присоединения молекул водорода 2) реакция отщепления молекул водорода 3) реакция присоединения молекул воды 4) реакция отщепления молекул воды.
9) С3H8 + 5O2 — > ; 3CO2 + 4H2O Ответ : 1.
Составить уравнение реакции присоединения к молекуле бутена?
Составить уравнение реакции присоединения к молекуле бутена.
Сколько молекул воды может образоваться из одного миллиона молекул кислорода?
Сколько молекул воды может образоваться из одного миллиона молекул кислорода?
Сколько молекул водорода понадобится для проведения этой реакции?
И для пропана, и для пропена характерны1)реакции гидрирования2)малая растворимость в воде3) — гибридизация атомов углерода в молекуле5)реакции гидратации6)горение на воздухе?
И для пропана, и для пропена характерны
2)малая растворимость в воде
3) — гибридизация атомов углерода в молекуле
6)горение на воздухе.
1. Составьте по схеме уравнение реакции : Бутадиен — 1, 3 + хлороводород = 2?
1. Составьте по схеме уравнение реакции : Бутадиен — 1, 3 + хлороводород = 2.
Определите число одинарных связей в молекулах ацетилена и бутадиена — 1, 2 3.
Как называются в органической химии следующие реакции : а) присоединения водорода б) присоединения воды в) присоединения галогенов.
Напишите для вещества С10Н18 возможные реакции : а) горения ; б) гидрирования ; в) присоединения галогена водорода?
Напишите для вещества С10Н18 возможные реакции : а) горения ; б) гидрирования ; в) присоединения галогена водорода.
CH2 = C — CH = CH2 + HBr›?
CH2 = C — CH = CH2 + HBr›.
Реакция дегидробромирования относится к реакциям : а) замещения ; б)отщепления ; в)присоединения ; г) изомеризации?
Реакция дегидробромирования относится к реакциям : а) замещения ; б)отщепления ; в)присоединения ; г) изомеризации.
Что получится при реакции CH3 — CH(Cl) — CH(CH3)2 + H2OВся загвоздка для меня в том, что это алкан, а они как известно не вступают в реакцию с водой?
Что получится при реакции CH3 — CH(Cl) — CH(CH3)2 + H2O
Вся загвоздка для меня в том, что это алкан, а они как известно не вступают в реакцию с водой.
Помогите с тестом пожалуйста Реакция объединения нескольких молекул называется : 1) изомеризация ; 2) замещения ; 3) присоединение ; 4) отщепления ?
Помогите с тестом пожалуйста Реакция объединения нескольких молекул называется : 1) изомеризация ; 2) замещения ; 3) присоединение ; 4) отщепления ;
Напишите пожалуйста все реакции с этим веществом(Горение, присоединение, окисление, полимеризация, отщепление, изомеризацию)?
Напишите пожалуйста все реакции с этим веществом(Горение, присоединение, окисление, полимеризация, отщепление, изомеризацию).
На этой странице вы найдете ответ на вопрос 8. Схеме алкан + галоген→ cоответствует уравнение реакции 1?. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
Ковалентная полярная молекула неметалла с кислотным остатком никак не может образовать ионную связь + неорганическое вещество.
1) 4 2) 2 3) 1 4) 1 5) 2 6) 2 7) 4 8) 2 9) 3 10) 11) 3 12) 2.
Молярная масса водорода — 2 г / моль в сосуде было 0, 24 / 2 = 0, 12 моль водорода молярная масса кислорода — 32 г / моль в сосуде было 4 / 32 = 0, 125моль кислорода молярная доля водорода составляет 0, 12 / (0, 12 + 0, 125) = 49, 0% молярная доля ки..
N(FeCl₂) = m(FeCl₂) / M(FeCl₂) n(FeCl₂) = 13 / 126, 75 = 0, 103 моль n(NaOH) = m(NaOH) / M(NaOH) n(NaOH) = 15 / 40 = 0, 375 моль хлорид железа прореагирует полностью FeCl₂ + 2NaOH = Fe(OH)₂↓ + 2NaCl гидроксид хлорид натрия железа (II) n(Fe(OH)₂) = n(..
2HCl + CaO — > CaCl2 + H2O (реакция обмена) ( образуется хлорид кальция и вода).
CaO + 2HCl = CaCl2 + H2O оксид кальция + соляная кислота = хлорид кальция + вода.
CH3 — CH2 — CН = CH — CH3 это пентен — 2.
А. Ba(OH)2 + CO2 = BaCO3 + H2O Б. Ba(OH)2 + P2O5 = Ba3(PO4)2 + H2O B. Ba(OH)2 + SO3 = BaSO4 + H2O Г. Ba(OH)2 + Cl2O7 = Ba(ClO4)2 + H2O.
HCl Cl — 1 Cl2O7 Cl + 7 NACL Cl — 1 HClo3 СL + 5.
Алканы. Химические свойства. Радикальное замещение на примере реакции галогенирования
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На уроке будет рассмотрена тема: «Алканы. Химические свойства. Радикальное замещение на примере реакции галогенирования». Вы узнаете много нового о химических свойствах алканов. Рассмотрите, что представляет собой радикальное замещение, используя для примера реакцию галогенирования.
Галогенирование алканов на примере пропана
Галогенирование – процесс присоединения к молекуле органического соединения атома галогена – это одно из химических взаимодействий, в которых участвуют углеводороды ряда алканов. Благодаря общности структуры молекул у всех членов гомологического ряда реакции с галогеном обладают единым характером. При этом галогенирование пропана и следующих за ним в гомологическом ряду соединений имеет особенности, связанные с наличием в молекулах вторичных, третичных и четвертичных атомов углерода.
Краткая характеристика алканов
К простейшим органическим соединениям относятся ациклические насыщенные, или предельные углеводороды (алканы). Их отличают следующие структурные особенности:
- неразветвленные (прямые) или разветвленные молекулы, не содержащие циклических образований;
- все химические связи в молекуле – одинарные.
Общая формула имеет вид 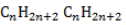
Механизм замещения у алканов носит радикальный характер, так как разрыв слабополярной связи C-H протекает с образованием пары свободных радикалов – нейтральных частиц, имеющих по одному неспаренному электрону. Атом водорода может замещаться галогеном, нитрогруппой или сульфогруппой.
Галогенирование алканов
Реакция свободно-радикального замещения (обозначается символом SR – от англ. substitution radical reaction) водородного атома в молекуле алкана атомом галогена называется галогенированием. Ее инициирование требует воздействия ультрафиолетового облучения или повышенной температуры. Реакция носит цепной характер, так как в каждом ее акте образуются свободные радикалы, генерирующие следующий акт.
Замещение фтором – фторирование – чрезвычайно экзотермический процесс, сопровождающийся взрывом и разрушением молекулы алкана. Реакция с участием йода, наоборот, является эндотермической и обратимой – в ходе ее происходит восстановление продукта реакции йодоводородом, поэтому прямое йодирование неэффективно. Практический интерес представляют реакции алканов с хлором и бромом.
Стадии галогенирования
Удобнее всего рассмотреть, какой механизм имеет реакция хлорирования алканов, на примере метана. При облучении или нагреве реакционной смеси реакция инициируется, и далее цепная реакция протекает в несколько стадий.
- Зарождение цепи – распад молекулы хлора на активные радикалы:
- Развитие цепи. Взаимодействуя с молекулой метана
, радикал
отщепляет от нее атом водорода с образованием метил-радикала
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
- Обрыв цепи. Цепной процесс прекращается, когда радикалы реагируют между собой:
В общем виде уравнение галогенирования метана хлором записывается в форме:
Процесс замещения не ограничивается образованием хлорметана, на молекулы которого также воздействуют радикалы 
Выход продуктов зависит от мольного соотношения реагентов и условий реакции. Так, при эквимолярном количестве метана и хлора и температуре 440° C соотношение молярных долей продуктов в процентах составляет около 39:41:19:1.
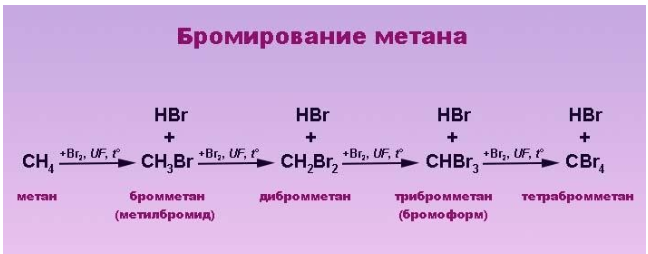
Реакция бромирования отличается меньшим выделением энергии и протекает медленнее, так как его реакционная способность ниже, чем у хлора.
Региоселективность
Начиная с пропана 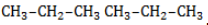
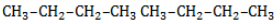
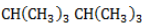
Селективность зависит от следующих факторов:
- Активность реагента. Чем активнее галоген, тем слабее проявляется избирательность при замещении водорода. Так, при взаимодействии алкана с хлором региоселективность значительно меньше, чем в реакциях с бромом, или не наблюдается.
- Температура. Нагревание ведет к снижению селективности.
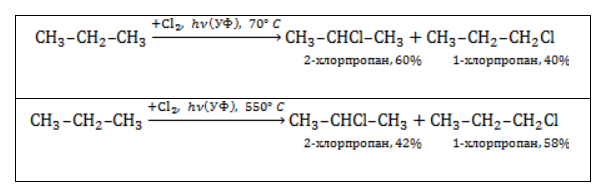
Хлорирование и бромирование пропана
В реакции пропана с хлором при низкой температуре селективная направленность выражена слабо. Несмотря на то, что образующиеся в ходе реакции радикалы 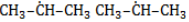
При нагревании радикалы хлора атакуют первичные атомы даже более активно, так как на разрыв их связи с водородом затрачивается меньше энергии.
При бромировании пропана региоселективность вследствие меньшей активности брома достигает высоких значений:
Бромирование протекает аналогично реакции с участием простейших алканов с преимущественным замещением водорода у вторичных атомов:
Продуктом этой реакции является 2-бромпропан.
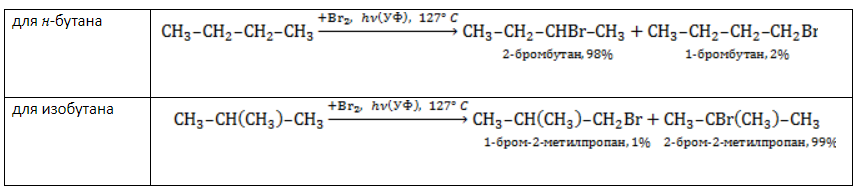
Галогенирование бутана
В реакциях бутана с хлором селективность не играет заметной роли. Даже при низкой температуре соотношение продуктов хлорирования может быть различным:
Бромирование бутана демонстрирует большую селективность:
Реакция отщепления
Активные двухвалентные металлы (как правило, магний или цинк) отщепляют от молекул дигалогеналканов атомы хлора или брома, если они замещают водород у двух соседних атомов углерода. Между последними образуется двойная связь. Продуктом такой реакции является алкен.
Пример реакции дегалогенирования алканов – отщепление цинком атомов хлора от 1,2-дихлорпропана с образованием пропилена (пропена) и хлорида цинка:
Применение галогеналканов
Хлорированные и бромированные алканы применяются в качестве промежуточных соединений в различных отраслях, таких как синтез высокомолекулярных соединений, производство лаков, красок и растворителей. Хлоралканы служат сырьем для фторалканов, которые нельзя получить прямым фторированием.
Токсичность галогеналканов тем меньше, чем активнее входящий в их состав галоген. Поэтому фторалканы наиболее безопасны. Фторсодержащие фреоны широко используются в качестве вспенивателей, хладагентов и пропеллентов.
http://interneturok.ru/lesson/chemistry/10-klass/predelnye-uglevodorody/alkany-himicheskie-svoystva-radikalnoe-zameschenie-na-primere-reaktsii-galogenirovaniya
http://allinchemistry.ru/organicheskaya-himiya/galogenirovanie-alkanov-na-primere-propana













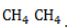 , радикал
, радикал 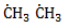 , который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию: