Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df7767f3a09c4ae • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Амины: способы получения, строение и свойства
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
Строение аминов
Атом азота находится в состоянии sp 3 -гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин CH3-NH2 | Диметиламин CH3-NH-CH3 | Триметиламин (CH3)3N |
| Ароматические | Фениламин C6H5-NH2 | Дифениламин (C6H5)2NH | Трифениламин (C6H5)3N |
| Смешанные | Метилфениламин CH3-NH-C6H5 | Диметилфениламин (CH3)2N-C6H5 |
Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
| Например. Ф ормуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н-Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
 |  |
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
| Например. Ф ормуле С4Н11N соответствуют амины положения аминогруппы. |
| 1-Аминобутан (н-бутиламин) | |
 |  |
Изомерия между типами аминов
| Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины. |
| Пропиламин (первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин (третичный амин) |
 |  |  |
Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Химические свойства аминов
| Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства. |
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:


| Поэтому амины и аммиак обладают свойствами оснований. |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
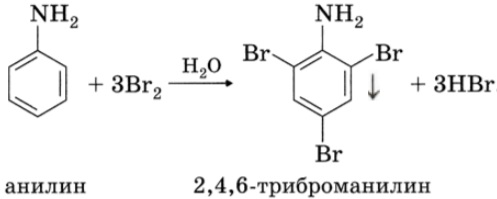
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |
Получение аминов
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочнойсреде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
15 комментариев
Добавить ваш
Где получение аминов , там 2) Реакция Зинина слева написано R как радикал, а справа (после равно) уже метиламин, почему метиламин справа, а слева просто R? Разве Зинин не анилин получил этим способом?
Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония.
Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном?
Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Здравствуйте! Не показано взаимодействие аминов со спиртами.
Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования.
R3N + RCl = R4N(+)Cl(-)
По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр.
Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение.
спасибо, отличная идея!
для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть
На ЕГЭ пока оптической изомерии нет.
Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
что значит «дальнейшее»? у триметиламина — и так уже нет N-H связей, может вы имели в виду протонированный триметил-амин (скажем) солянокислый, что в форме соли он останется третичным амином например до момента щелочного депротонирования(высвобождения основания амина)
—
а что кстати, есть способ галоидным алкилом моноалкилирование первичного ароматического амина до вторичного осуществить, избежав образования третичного амина — диалкилированного уже
на этилировании уже проще, а вот метиллирование нейромедиаторов не удавалось остановить на стадии N,N-ДиМет.(например в ацетоне с карбонатом калия, или с DIPEA), выход третичного целевого амина всегда оказывался либо самым низким из продуктов реакции, либо просто очень низким(10% в сложной смеси аминов с преобладанием четвертичной соли триметиламмония метилиодида, а сейчас подумал — если при N-метилировании первичного ароматического амина метилиодидом, образуется гидроиодид N-метил…исх.пер.амина, он же даже во второе метиллирование уже не должен входить, усиленным основанием став (скажем адреналином, основнее норадреналина исходного как я понимаю за счет появившегося электроннодонороного метила) и так будет выведен из реакционной среды(например выпав осадком соли, не солватированной в неполярной РС)
получается в отсутствие основного катализа алкилирование первичных аминов ограничивается моно-алкилированием — не далее чем до вторичного амина? или на практике соли не так надёжны как в оптимистичных прогнозах теоретизирующего учащегося?
Амины органические основания подтвердите уравнениями реакций
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие вещества называют аминами?
Аминами называют органические вещества, в молекулах которых углеводородный радикал связан с аминогруппой ―NH2.
Как классифицируют амины по природе углеводородного радикала?
На предельные и ароматические амины.
В предельных аминах углеводородный радикал ― остаток предельных углеводородов, а в ароматических ― остаток ароматических углеводородов.
Задание 2
Амины называют органическими основаниями. Почему?
Водные растворы аминов содержат в небольшой степени гидроксид-анионы ОН — и имеют щелочную среду. Благодаря этому и способности образовывать соли с неорганическими кислотами их называют органическими основаниями.
Напишите уравнения реакций подтверждающих эту характеристику.
CH3NH2 + H2O ⇄ [CH3NH3] + + OH-
CH3NH2 + HCl ⟶ [CH3NH3]Cl
Сравните основные свойства аммиака, метиламина и анилина.
Основные свойства метиламина выражены сильнее, чем в аммиака. В молекуле метиламина атом азота соединен с углеводородным радикалом, а поскольку электроотрицательность водорода меньше, чем углерода и азота, происходит смещение электронов от трех атомов водорода к атому углерода и затем к атому азота, в результате электронная плотность на атоме азота увеличивается, а повышение электронной плотности превращает азот в более сильного донора пары электронов, то есть способность присоединять к себе катион водорода по донорно-акцепторному механизму, что повышает основные свойства вещества. 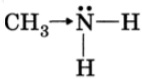
Основные свойства анилина выражены слабее, чем в аммиака. В молекуле анилина атом азота соединен с фенильным радикалом, происходит смещение электронов от атома азота к бензольному кольцу, вследствие этого электронная плотность на атоме азота уменьшается и аналин является более слабым основанием, чем аммиак. 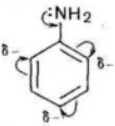
Таким образом, а ммиак является более сильным основанием, чем анилин, но более слабым, чем метиламин.
Задание 3
На примере молекулы анилина рассмотрите третье положение теории химического строения органических соединений о взаимном влиянии атомов в молекулах. Ответ подтвердите уравнениями химических реакций.
С одной стороны, в молекуле анилина происходит смещение электронной плотности от аминогруппы к бензольному кольцу, в результате уменьшается электронная плотность на атоме азота и ослабевают основные свойства анилина. Анилин в водном растворе не меняет окраску лакмуса и фенолфталеина.
С другой стороны, увеличивается электронная плотность в бензольном кольце, сильнее всего ― в положениях 2, 4 и 6 относительно аминогруппы, поэтому реакции замещения анилина протекают легче. При действии на анилин брома реакция замещения протекает при обычных условиях без использования катализатора и замещается три атома водорода, образуя 2,4,6-триброманилин.
Задание 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
хлорметан ⟶ метанол ⟶ метиламин ⟶ бромид метиламмония.
CH3Cl + NaOH ⟶ CH3OH + NaCl
CH3OH + NH3 ⟶ CH3NH2 + H2O
CH3NH2 + HBr ⟶ [CH3NH3]Br
Задание 5
Смешали 10 л газообразного метиламина (н.у.) и 10 г хлороводорода. Какая масса кристаллического хлорида метиламмония при этом образовалась? Какой газ и в каком объёме остался в колбе после окончания реакции?
Дано: V(CH3NH2)=10 л, m(HCl)=10 г
Найти: m([CH3NH3]Cl)-?, Vостаток(газа)-?
Решение
1. Вычисляем количество вещества метиламина в объёме 10 л по формуле: n=V/VM, где VM ― молярный объём.
n(CH3NH2)=V(CH3NH2)/VM=10 л : 22,4 л/моль=0,446 моль
2. Вычисляем ко личество вещества хлороводорода массой 10 г по формуле: n =m/M, где M ― молярная масса.
M (HCl )=36,5 г/моль
n(HCl)=m(HCl)/M(HCl)=10 г : 36,5 г/моль=0,274 моль
3. Составим химическое уравнение:
HCl + CH3NH2 =[CH3NH3]Cl
По уравнению реакции 1 моль HCl рагирует с 1 моль CH3NH2 , количество вещества одинаковое, то есть с 0,274 моль хлороводорода реагирует 0,274 моль метиламина. По условию задачи имеем 0,446 моль метиламина, следовательно он взят в избытке, то есть реагирует не полностью, поэтому расчеты будем проводить по данным хлороводорода.
n( [CH3NH3]Cl )= n прореаг.( CH3NH2 )= n( HCl )=0,274 моль
nостаток( CH3NH2 )=n ( CH3NH2 )-n прореаг.( CH3NH2 )=0,446 моль-0,274 моль=0,172 моль
4. Вычисляем массу хлорида метиламмония в количестве вещества 0,274 моль формуле: n=m/M, где M ― молярная масса.
M( [CH3NH3]Cl )=67,5 г/моль
m( [CH3NH3]Cl )=n ( [CH3NH3]Cl ) • M( [CH3NH3]Cl )=0,274 г • 67,5 г/моль=18,5 г
5. Вычисляем объём остатка метиламина в количестве вещества 0,172 моль по формуле: V= n • VM, где VM ― молярный объём .
n( CH3NH2 )=n( CH3NH2 ) • VM=0,172 моль • 22,4 л/моль=3,85 л
Ответ: образовалось 18,5 г хлорида метиламмония и осталось 3,85 л метиламина.
Задание 6
При сжигании органического вещества образовалось 1,26 г воды, 0,896 л оксида углерода (IV) и 0,224 л азота (н.у.). Найдите молекулярную формулу этого вещества.
Известно: органическое вещество СхHyNz, m(H2O)=1,26 г, V(СО2)=0,896 л, V(N2) =0,224 л
Найти: формулу СхHyNz — ?
Решение
1-й способ
1. Вычисляем ко личество вещества воды массой 1,26 г по формуле: n =m/M, где M ― молярная масса.
M (H2O )=18 г/моль
n(H2O)=m( H2O )/M( H2O )=1,26 г : 18 г/моль=0,07 моль
2. Вычисляем количество вещества CO2 и N2 в заданном объёме по формуле: n=V/VM, где VM ― молярный объём .
n( CO2 )=V(CO2)/VM=0,896 л : 22,4 л/моль=0,04 моль
n(N 2 )=V( N 2 )/VM=0,224 л : 22,4 л/моль=0,01 моль
3. Вычисляем количество вещества атомов С в 0,04 моль СО2.
n(C)=n(CO2)=0,04 моль
4. Вычисляем количество вещества атомов H в 0,07 моль H2O. В 1 моль Н2О содержится 2 моль атомов Н, а в 0,07 моль Н2О количества вещества атомов в 2 раза больше:
n(H)=2•n(H2O)=2•0,07 моль=0,14 моль
5. Вычисляем количество вещества атомов N в 0,01 моль N2. В 1 моль N2 содержится 2 моль атомов N, а в 0,01 моль N2 количества вещества атомов в 2 раза больше:
n(N)=2•n(N2)=2•0,01 моль=0,02 моль
6. Находим соотношение атомов в веществе:
х:у:z=n(C) : n(H) : n(N)=0,04:0,14:0,02
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что наименьшее число (0,02) равно единице, а большее число делим на него, тогда
х:у:z=0,04/0,02 : 0,14/0,02 : 0,02/0,02=2:7:1, следовательно, формула имеет вид C2H7N, или C2H5-NH 2
2-й способ
1. Вычисляем количество вещества CO2 в объёме 0,896 л и N2 в объёме 0,224 л по формуле: n=V/VM, где VM=22,4 л/моль при н.у.
n( CO2 )=V(CO2)/VM=0,896 л : 22,4 л/моль=0,04 моль
n(N 2 )=V( N 2 )/VM=0,224 л : 22,4 л/моль=0,01 моль
2. Составляем пропорцию для вычисления массы атомов C в 0,04 моль СО2 и решаем ее:
В 1 моль СО2 содержится 12 г С, а
в 0,04 моль СО2 ― х г С
х=m(C)=0,04 моль • 12 г : 1 моль = 0,48 г
3. Составляем пропорцию для вычисления массы атомов N в 0,01 моль N2 и решаем ее:
В 1 моль N2 содержится 28 г N, а
в 0,01 моль H2O ― х г N
х=m(N)=0,01 моль • 28 г : 1 моль = 0,28 г
4. Составляем пропорцию для вычисления массы атомов H в 1,26 г Н2О и решаем ее:
В 18 г H2O содержится 2 г H, а
в 1,26 г H2O ― х г H
х=m(H)=1,26 г • 2 г : 18 г = 0,14 г
5. Находим соотношение атомов в веществе:
х:у:z=m(C)/M(C) : m(H)/M(H) : m(N)/M(N)=0,48/12 : 0,14/1 : 0,28/14=0,04:0,14:0,02
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что наименьшее число (0,02) равно единице, а большее число делим на него, тогда
х:у:z=0,04/0,02 : 0,14/0,02 : 0,02/0,02=2:7:1, следовательно, формула имеет вид C2H7N, или C2H5―NH 2
Ответ: C2H7N, или C2H5―NH 2
Задание 7 Создайте компьютерные 3D-модели молекул метиламина и анилина. Рассмотрите взаимное расположение атомов и атомных групп относительно атома азота. Сделайте самостоятельно.
http://chemege.ru/aminy/
http://gdz.cool/h10_gos_2019/831-h10_gos_2019_18.html