Как протекают различные химические процессы
Уравнения реакций хлорида алюминия с аммиаком и щелочью
Задача 1052.
Чем различается действие избытка водных растворов NH3 и NаОН на раствор АIСI3? Написать уравнения соответствующих реакций.
Решение:
При действии избытка водного раствора аммиака на хлорид алюминия образуется гель гидроксида алюминия:
При действии избытка водного раствора гидроксида натрия на хлорид алюминия образуется комплексный ион [Al(OH)4(H2O)2] − :
Расчет энергии Гиббса
Задача 1053.
Пользуясь табличными данными приложения, установить, возможно ли самопроизвольное протекание реакции:
4А1 + 3СО2 = 2А12О3 + 3С.
Решение:
Уравнение реакции:
Находим стандартные значения энергии Гиббса образования веществ, участвующих в реакции из таблиц, учитывая, что значения энергии Гиббса простых веществ равны нулю. ΔG 0 (СО2) = -394,6 кДж/моль; ΔG 0 (Al2O3) = -1583,3 кДж/моль.
ΔG 0 = 2ΔG 0 (Al2O3) — 3ΔG 0 (СО2) = 2(-1583,3) – 3(-394,6) = -19823,8 кДж.
Определение массы электрода гальванического элемента
Задача 1054.
При работе гальванического элемента: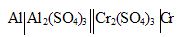
Решение:
MЭ(Al 3+ ) = M(Al 3+ )/3 = 26, 981/3 = 8,999 г/моль; MЭ(Cr 3+ ) = M(Cr 3+ )/3 = 51,998/3 = 17,332 г/моль.
При работе гальванического элемента на электродах, согласно закону эквивалентов, происходит эквивалентное окисление и восстановление металлов, получим:
Находим массу алюминия, на которую уменьшился алюминиевый электрод, получим:
m(Al) = m(Cr 3+ )/MЭ(Cr 3+ ) . MЭ(Al 3+ ) = 31,2/17,332 . 8,999 = 16,198 г.
Через раствор хлорида алюминия пропустили аммиак, при этом выпал осадок белого цвета. Полученный осадок отфильтровали и подействовали
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,838
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Гидроксид алюминия: получение и свойства
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
http://www.soloby.ru/1139574/%D0%B0%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%B8%D1%8F-%D0%BF%D1%80%D0%BE%D0%BF%D1%83%D1%81%D1%82%D0%B8%D0%BB%D0%B8-%D0%BF%D0%BE%D0%BB%D1%83%D1%87%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9-%D0%BE%D1%82%D1%84%D0%B8%D0%BB%D1%8C%D1%82%D1%80%D0%BE%D0%B2%D0%B0%D0%BB%D0%B8-%D0%BF%D0%BE%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D0%BE%D0%B2%D0%B0%D0%BB%D0%B8
http://chemege.ru/gidroksid-alyuminiya/