Нитрид трийода
| Нитрид трийода | |||
|---|---|---|---|
| |||
| Систематическое наименование | Йодид азота | ||
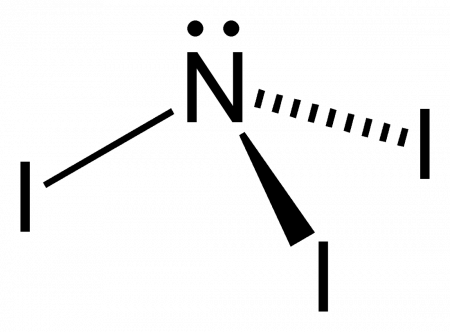
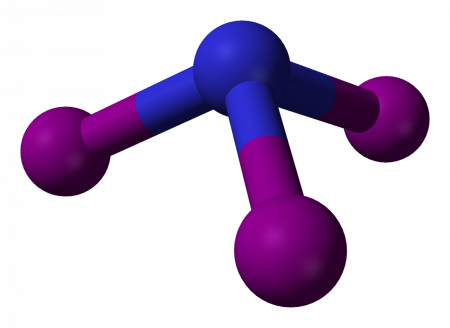
| Хим. формула | NI3 | ||
| Состояние | кристаллы | ||
| Молярная масса | 394.77 г/моль | ||
| Температура | |||
| • кипения | возгоняется при — 20 °C | ||
| • разложения | от 0 до 25 С | ||
| Рег. номер CAS | 13444-85-4 | ||
| PubChem | 61603 | ||
| SMILES | |||
| ChemSpider | 55511 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Нитрид трийода (иногда йодистый азот, ошиб. азид йода) — чрезвычайно взрывчатое неорганическое соединение с формулой NI3. Обычно известен в виде чёрно-коричневых кристаллов — аддукта с аммиаком NI3· n NH3 (аммиаката), но был получен и в индивидуальном виде реакцией BN с IF при низких температурах.
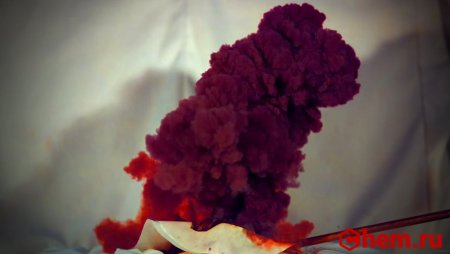
Представляет собой чёрные кристаллы, очень чувствительные к механическим воздействиям. В сухом виде взрывается от прикосновения, образуя розовато-фиолетовое облако паров йода. Это единственное вещество, которое взрывается под воздействием альфа-частиц и других продуктов ядерного распада.
Содержание
Свойства
Аддукт нитрида йода разлагается при взаимодействии с диэтилцинком:
Благодаря именно этой реакции установлено строение аддукта йодида азота с аммиаком http://pubs.rsc.org/en/content/articlepdf/1905/ct/ct9058700055 [2]
Во влажном виде при наличии избытка аммиака в растворе сравнительно устойчив. Единственное известное взрывчатое вещество, способное сдетонировать от альфа-излучения. Из-за крайней нестабильности применяется исключительно как эффектный химический фокус.
Нестабильность вещества вызвана большой длиной связи N−I и огромными размерами трёх атомов йода, приходящихся на один атом азота, и соответственно низкой энергией активации реакции разложения.
Нерастворим в этаноле. Разлагается горячей водой, кислотами-окислителями, щелочами.
Разложение чистого вещества протекает по следующей реакции:
Аммиак, который присутствует в аддукте, является восстановителем для образующегося йода:
Нитрид трийода подвергается гидролизу с образованием оксида азота III и йодоводородной кислоты:
Получение
Получают взаимодействием водного раствора аммиака (нашатырный спирт) — обычно 25 % и спиртового раствора йода в соотношении 1:2. При смешивании выпадает чёрный или бурый осадок, представляющий собой продукт присоединения аммиака к нитриду трийода.
Возможно использование кристаллического йода вместо раствора, в этом случае кристаллы йода поливают раствором аммиака. При реакции с безводным аммиаком в условиях низких температур образующийся продукт имеет состав NI3 ⋅ (NH3)5 , при нагревании он начинает терять часть аммиака.
Осадок может быть очищен от примеси аммиака промыванием спиртом, но при этом его детонационная чувствительность сильно возрастает.
Биологическая роль
Йодид азота III — потенциально опасное вещество. Является ирритантом (в очень больших количествах), взрывоопасен.
 Химическая кунсткамера
Химическая кунсткамера
Самые эффектные и красивые опыты
10.3. Вещество, не терпящее прикосновения
Такое вещество открыл французский химик Жорж Симон Серюлла (1774–1832), который увлекался получением неустойчивых химических веществ. Однажды он выделил из водного раствора темно-коричневый осадок нитрида трийода I3N и оставил его сушиться на фильтре до утра. Когда на следующий день Серюлла, чем-то рассерженный, резко открыл дверь в лабораторию, то произошел взрыв, разнесший в щепки лабораторный стол.
Позднее Серюлла, работая с малыми количествами I3N, установил, что достаточно прикоснуться к его красно-фиолетовым кристаллам палочкой или просто подуть на них, как раздастся сильный хлопок с выделением фиолетового дыма – паров йода. Нитрид йода взрывается даже от громкой музыки.
Чтобы получить столь чувствительное к прикосновению вещество, в фарфоровую чашку наливают 6–8 мл концентрированного водного раствора аммиака NH3 и добавляют к нему не более 0,5 г порошка йода I2 при непрерывном помешивании. Образовавшийся темно-коричневый осадок моноаммиаката нитрида йода I3N•NH3 взбалтывают в растворе и выливают на фильтр. Осадок промывают на фильтре ледяной водой, затем охлажденным во льду этиловым спиртом для удаления не вступившего в реакцию избыточного йода. После этого промывают осадок диэтиловым эфиром, тоже охлажденным во льду, и затем раскладывают осадок для сушки небольшими порциями (по объему не больше пшеничного зерна) на отдельные бумажки, чтобы больше уже не трогать их с места: после высыхания вещество становится очень опасным. Достаточно прикоснуться к сухому нитриду йода (не рукой, а длинной палочкой!), как он взрывается, выделяя буро-фиолетовые пары йода.
Получение и разложение нитрида йода (точнее, соединения нитрида йода с аммиаком) протекают в соответствии с реакциями:
Нитриды – соединения азота, имеющего отрицательную степень окисления (обычно –3), с металлами и неметаллами* .
Нитриды металлов обладают высокими температурами плавления, достигающими почти 3000 °С (нитриды титана TiN и циркония ZrN). Большинство нитридов металлов – очень твердые и хрупкие вещества.
Нитриды многих металлов разлагаются водой с выделением аммиака и образованием гидроксидов металлов. Например, нитриды лития Li3N, магния Mg3N2 и цинка Zn3N2 взаимодействуют с водой соответственно следующим образом:
Эти реакции носят название реакций необратимого гидролиза. Естественно, что нитриды этих металлов разлагаются и под действием разбавленных кислот, превращающих их в соли металлов и соли аммония. Так, нитрид кальция Ca3N2, попадая в разбавленную соляную кислоту, дает хлорид кальция CaCl2 и хлорид аммония NH4Cl:
Нитриды неметаллов хлора и йода Cl3N и I3N – взрывчатые вещества, они разлагаются от удара, трения, нагревания на азот N2 и соответственно хлор Cl2 или йод I2.
Нитриды тяжелых металлов разлагаются только под действием фтороводородной кислоты.
10.4. Фейерверк в жидкости
Чтобы выполнить этот опыт, в стеклянный цилиндр емкостью 100–150 мл наливают концентрированную серную кислоту H2SO4 до половины его объема. Затем осторожно по стеклянной палочке, прислоненной изнутри к стенке цилиндра, добавляют этиловый спирт C2H5OH так, чтобы его слой не смешивался с нижним слоем серной кислоты. Высота слоя спирта должна составлять 1/3 от высоты слоя H2SO4.
После этого в цилиндр высыпают 1/2 чайной ложки предварительно растертых в ступке кристаллов перманганата калия KMnO4. Теперь для полноты впечатления можно погасить свет или задернуть шторы. Кристаллики перманганата калия опускаются через слой спирта и оседают на поверхности кислоты.
Через некоторое время с поверхности кислоты начинают опускаться вниз зеленоватые струйки, а между слоями спирта и кислоты появляются вспышки света и раздаются громкие хлопки. Вспышки перемещаются по поверхности кислоты и озаряют цилиндр светом. Это происходит внезапно, и один хлопок следует за другим.
При действии серной кислоты на KMnO4 образуется марганцовая кислота HMnO4:
Кислота очень неустойчива и легко разлагается на оксид марганца(VII) и воду:
Оксид марганца(VII) выделяется в виде зеленовато-черной маслянистой жидкости, устойчивой при температурах ниже –7 °С и при полном отсутствии воды. Он является сильнейшим окислителем и превращает этиловый спирт C2H5OH в диоксид углерода и воду, а сам переходит в диоксид марганца MnO2:
Впервые Mn2O7 был получен в 1791 г. при действии на KMnO4 концентрированной серной кислоты, а описанный выше опыт первым осуществил немецкий химик Эйльхард Мичерлих в 1832 г., когда он изучал свойства марганцовой кислоты HMnO4.
Внимание! Этот опыт должен проводить преподаватель химии или руководитель химического кружка, т. к. он связан с использованием вредных и опасных веществ.
* К нитридам относят соединения азота со всеми химическими элементами, кроме кислорода и фтора; электроотрицательность у кислорода и фтора больше, чем у азота.
* К нитридам относят соединения азота со всеми химическими элементами, кроме кислорода и фтора; электроотрицательность у кислорода и фтора больше, чем у азота.
Удаление нежелательных волос с помощью йода и аммиака
Воздействие аммиака и йода на волосяные фолликулы

Вообще, йодная и нашатырная спиртовые настойки, как пишется официально в инструкции, вместе не совместимы, так как могут усиливать негативное влияние на организм в комбинации. Для удаления нежелательных волос это то, что нужно. Эта смесь еще сильнее ускоряет выпадение волосков, с помощью которой можно полностью избавиться от волосяного покрова за считанные недели. Более того, смесь йода и нашатырного спирта не окрашивает волосы, так как йод теряет свой яркий коричневый цвет в нашатыре, становясь черным.
Плюсы и минусы от удаление нежелательных волос
Хоть это действенный и достаточно серьезный способ устранения лишнего волосяного покрова, после которого волос может уже больше не появиться на теле, тем не менее, такой метод борьбы с оволосением чреват негативными последствиями при неаккуратном применении, имеет свои противопоказания.
Основные риски, связанные с применением йодно-аммиачной смеси:
- Легко заработать ожог на коже, особенно если она сухая или чувствительная
- Можно получить в конечном итоге дерматит, шелушение или аллергическую реакцию
- Эта смесь здорово сушит кожные покровы
- Можно получить желтоватый оттенок кожи на теле, который будет тяжело смыть
- Всегда существует риск, что в индивидуальном случае эта смесь окажется неэффективной в плане избавления от волосяного покрова, но негативные эффекты будут проявлены на состоянии кожи сполна
- Также возможно, что растительность тела исчезнет на некоторое время, но нет гарантии, что со временем новые волоски не появятся снова.

Ни в коем случае нельзя наносить препарат на лицо, там кожа более нежная, нежели на теле и существует еще больший риск заработать себе аллергию, покраснения, ожоги. Лучше всего перед нанесением смеси на тело провести тест на чувствительность к каждому компоненту рецепта. По очереди следует немного нанести каждый препарат и понаблюдать, не появится ли через некоторое время сыпь, зуд или покраснение. Если появилась любая возможная реакция чувствительности на один из компонентов, значит, следует отказаться от этого способа удаления волосков на теле.
Рецепт йодно-нашатырной смеси
Это классический вариант удаления волосков с помощью спиртовых настоек йода, аммиака, медицинского спирта и касторового масла.
Требуется вместе размешать в 30-ти граммах спирта 70% или 96%: 5 грамм нашатыря, полтора грамма йода, 5 грамм касторового масла. Кожа смазывается ежедневно, 2-3 раза в сутки. В зависимости от строения волосяной луковицы, они выпадут у кого-то через пару дней, а у кого-то через 2-3 недели. Если мазать более трех недель, а результата нет, значит, данный способ не подошел и процедуру требуется поскорее прекратить.
http://him.1sept.ru/article.php?ID=200101402
http://lekhar.ru/lekarstva/antiseptiki/jod-i-ammiak-ot-volos/


 Химическая кунсткамера
Химическая кунсткамера