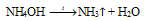Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e0fe6ce4b1c7174 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Получение аммиака и изучение его физических и химических свойств
Получение аммиака.
Проведем все действия, описанные в учебнике. Из газоотводной трубки будет выделяться аммиак. Он растворяется в воде, пропитавшей фенолфталеиновую бумажку. Уравнение реакции имеет вид:
В результате образуется гидроксид аммония, который имеет щелочную реакцию окрашивает индикатор в малиновый цвет.
Изучение свойств аммиака
Если поднести к отверстию пробки стеклянную палочку, смоченную концентрированной соляной кислотой, то над отверстием образуется белая дымка. Происходит реакция:
NH4Cl обладает летучестью, его частички поднимаются вместе с аммиаком. Их мы и видим в виде белой дымки. Проведем растворение аммиака так как это описало в учебнике. Из-за очень хорошей растворимости аммиака вода в пробирке поднимается. Образуется NH4OH.
1. Запишем уравнение реакции между Са(ОН)2 и NH4Cl:
Как можно видеть из уравнения, в реакции образуются пары воды. Они конденсируются на более холодных стенках пробирки. Если капельки воды попадут на раскалённое дно, то пробирка может треснуть. Поэтому ее наклоняют таким образом, чтобы капельки скатывались к отверстию пробирки.
2. Аммиак легче воздуха (т.к. М(NH3) = 17 г/моль.
М(воздуха) = 29 г/моль). Он поднимается вверх, поэтому его надо собирать в перевернутую пробирку. Аналогично можно собирать Н2 (М = 2 г/моль), СН4 — метан (М= 16 г/моль); Не (М= 4г/моль) и другие.
З. Если вместо НСl поднести к отверстию пробирки с аммиаком палочку, смоченную концентрированной азотной кислотой, то мы ничего не увидим:
NH4NO3 — не обладает летучестью.
4. Обычно для определения оснований используют реакции с образованием нерастворимых гидроксидов, например, Mg(OH)2. Уравнение реакции имеет вид:
Выпадает белый осадок.
Изучение свойств водного раствора аммиака.
1. Водный раствор аммиака имеет щелочную среду, т.е. дает малиновую окраску с фенолфталеином. При кипячении раствора гидроксид аммония разлагается, в результате чего аммиак улетучивается, а раствор становится нейтральным.
Фенолфталеин в нейтральной среде — бесцветный.
2. Фенолфталеин дает малиновую окраску в растворе гидроксида аммония, так как тот является основанием. При добавлении соляной кислоты происходит нейтрализация раствора и цвет исчезает.
3. Происходит взаимодействие между раствором АlCl3 и NH4OH.
Скажите пожалуйста, чем объяснить то, что если к раствору аммиака с фенолфталеином добавить хлорид аммония, раствор
Станет бледно -розовым?
Как известно, фенолфталеин реагирует на ион ОН (-), а в растворе аммиака устанавливается равновесие: NH4OH NH4(+) + OH(-)
Добавление хлорида аммония (который полностью диссоциирует) в этот раствор вызывает смещение равновесия влево (по принципу Ле Шателье) , т. е. к уменьшению концентрации ионов ОН (-). Вот и весь фокус с посветлением раствора! Почти такой же эффект наблюдается (немного слабее) , если добавить не хлорид аммония, а карбонат или сульфид аммония, хотя уж их-то нельзя обвинить в «кислотности», как тут некоторые утверждают!
А водный раствор аммиака с фенолфталеином какого цвета? Бесцветный, что ли?
http://buzani.ru/khimiya/o-s-gabrielyan-9kl/593-prakticheskaya-rabota-7-poluchenie-ammiaka-i-izuchenie-ego-svojstv
http://sprashivalka.com/tqa/q/29092492