Физико-химические методы анализа (стр. 5 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 |
Кроме концентрации ионов водорода прямым потенциометрическим методам с ионоселективными электродами можно определить содержание нескольких десятков различных ионов. Для этой цели используют методы градуировочного графика, концентрационного элемента и метод добавок.
Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалетности происходит резкое изменение (скачок) потенциала индикаторного электрода. Так же, как и в других титриметрических методах, реакции потенциометрического титрования должны протекать строго стехиометрически, иметь высокую скорость и идти до конца.
Для потенциометрического титрования собирают цепь из индикаторного электрода в анализируемом растворе и электрода сравнения. В качестве электродов сравнения чаще всего используют электроды второго рода — каломельный или хлорсеребряный.
Тип применяемого индикаторного электрода при потенциометрическом титровании зависит от свойств титриметрической смеси и ее взаимодействия с электродом. В кислотно-основном титровании используют стеклянный электрод, в окислительно-восстановительном — инертный (платиновый) электрод или электрод, обратимый по отношению к одному из ионов, содержащихся в титриметриметрической смеси; в осадительном – серебряный электрод; в комплексонометрическом — металлический электрод; обратимый к титруемому иону металла.
Для нахождения точки эквивалентности часто строят дифференциальную кривую в координатах DЕ/DV – V. На точку эквивалентности указывает максимум полученной кривой, а отсчет по оси абсцисс, соответствующий этому максимуму, дает объем титранта, израсходованного на титрование до точки эквивалентности. Определение точки эквивалентности до дифференциальной кривой значительно точнее, чем по простой зависимости Е – V.
Основными достоинствами метода потенциометрического титрования являются высокая точность и возможность проводить определения в разбавленных растворах, в мутных и окрашенных средах, а также определять несколько веществ в одном растворе без предварительного разделения. Значительно расширяется область практического применения потенциометрического титрования при использовании неводных растворителей. Они позволяют анализировать многокомпонентные системы, которые в водном растворе определить не удается, провести анализ веществ, нерастворимых или разлагающихся в воде, и т. д. Потенциометрическое титрование легко может быть автоматизировано. Промышленность выпускает несколько типов автотитраторов, использующих потенциометрические датчики.
К недостаткам потенциометрического титрования можно отнести не всегда быстрое установление потенциала после добавления титранта и необходимость во многих случаях проводить при титровании большое количество отсчетов.
В потенциометрическом анализе основными измерительными приборами являются потенциометры различных типов. Они предназначены для измерения ЭДС электродной системы. Так как ЭДС зависит от активности соответствующих ионов в растворе, многие потенциометры позволяют непосредственно измерять также величину рХ – отрицательный логарифм активности иона Х. Такие потенциометры в комплекте с соответствующим ионоселективным электродом носят название иономеров. Если потенциометр и электродная система предназначены для измерения активности только водородных ионов, прибор называется рН-метром.
2.1. 2. Решение типовых задач по теме «Потенциометрический анализ»
Задача 1. Вычислить электродный потенциал медного электрода, опущенного в раствор соли меди с концентрацией Сu2+ равной 0,1 моль/л; Е°Cu2+/ Cu° = 0,34 В.

Задача 2. При потенциометрическом титровании 20,0 мл раствора NH4VO3 0,1 моль-экв/л раствором FeSO4 были получены следующие данные:
V(мл) 10,0 13,0 13,5 14,0 14,5 15,0 15,5 16,0
E(мв) 730 700 680 650 550 500 480 470
DЕ / DV 10 40 60 200 100 40 20 10
Рассчитать концентрацию NH4VO3 в анализируемом растворе.
Решение: Точка эквивалентности, найденная по графику соответствует 14,35 мл раствора FeSO4, затраченного на титрование анализируемого раствора NH4VO3.

Ответ: 0,0717 моль-экв/л.
2.1.3. Контрольные вопросы по теме «Потенциометрический анализ»
На чем основаны потенциометрические методы анализа? Какая зависимость выражается уравнением Нернста? Пояснить смысл входящих в него величин. Что представляют собой электроды I и II рода? Привести примеры этих электродов. Какие функции выполняют индикаторные электроды и какие – электроды сравнения? Указать требования, которые к ним предъявляются. Привести схему установки для потенциометрических измерений. В чем сущность потенциометрического определения рН раствора? Какие индикаторные электроды могут быть использованы для определения рН? Как устроен стеклянный электрод? Как можно определить стандартный потенциал этого электрода? Указать достоинства и недостатки стеклянного электрода. Каковы основные типы ионоселективных электродов? Как они устроены? Какие имеют характеристики? Указать достоинства, недостатки и области применения метода прямой потенциометрии. В каких координатах строят кривые потенциометрического титрования? Чем обусловливается выбор координат? Назвать соответствующие пары электродов и привести примеры потенциометрического титрования с использованием: а) реакций кислотно-основного взаимодействия; б) реакций осаждения; в) реакций комплексонообразования; г) реакций окисления-восстановления. Какие виды потенциометрии используются в анализе и на чем они основаны?
2.2. Кондуктометрический метод анализа
2.2.1. Основные законы и формулы
Кондуктометрический метод анализа основан на измерении удельной электропроводности анализируемого раствора. Электропроводностью называют величину, обратную электрическому сопротивлению R. Единицей измерения электропроводности является Ом-1 или сименс (См). Растворы электролитов, являясь проводниками II рода, подчиняются закону Ома. По аналогии с сопротивлением проводников I рода сопротивление раствора прямо пропорционально расстоянию между электродами l и обратно пропорционально площади их поверхности S

Где r — удельное сопротивление (Ом . см). при l = 1 см и S = 1 см2 имеем R= r, следовательно, удельное сопротивление равно 1 см3 раствора.
Величину, обратную удельному сопротивлению, называют удельной электропроводностью c = 1/ r. Удельная электропроводность (См . см-1) численно равна току ( в А) , проходящему через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1 В на единицу длины.
Электропроводность разбавленных растворов электролитов зависит от числа ионов в растворе (т. е. от концентрации), числа элементарных зарядов, переносимых каждым ионом (т. е. от заряда иона), и от скорости движения одинаково заряженных ионов к катоду или аноду под действием электрического поля. С учетом всех этих факторов электропроводящие свойства ионов характеризуют эквивалентной ионной электрической проводимостью (подвижностью).
Эквивалентной электрической проводимостью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Ее единицей измерения является См . см-2 / моль . экв.
Удельная и эквивалентная проводимость взаимосвязаны соотношением

Где с – молярная концентрация эквивалента, моль-экв/л.
Методы прямой кондуктометрии основываются на том, что в области разбавленных и умеренно концентрированных растворов электрическая проводимость растет с увеличением концентрации электролита.
В практической работе обычно используют заранее построенную градуировочную кривую зависимости электрической проводимости раствора от концентрации тех или иных электролитов. В связи с относительно близкими значениями подвижностей ионов кондуктометрические измерения дают информацию главным образом лишь об общей концентрации ионов в растворе. Малая селективность кондуктометрического метода существенно ограничивает его применение.
Измерения электрической проводимости растворов широко применяют в титриметрическом анализе для определения точки эквивалентности (кондуктометрическое титрование). В методах кондуктометрического титрования измеряют электрическую проводимость раствора после добавления небольших определенных порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах c – Vтитранта (удельная электропроводность – объем раствора титранта). Практически в этом методе могут быть использованы такие химические реакции, в ходе которых происходит резкое изменение (обычно возрастание) электрической проводимости после точки эквивалентности (реакции кислотно-основного взаимодействия, осаждении и т. д.).
Токи, имеющие частоту порядка мегагерц и десятков мегагерц, называют токами высокой частоты. При таких частотах в растворе начинают играть роль эффекты молекулярной, или деформационной, и ориентационной поляризации. Поляризация обоих типов вызывает кратковременный электрический ток (ток смещения). Кроме того, поляризация молекул приводит к существенному изменению диэлектрической и магнитной проницаемостей раствора, что открывает новую возможность исследования свойств системы при титровании.
При построении кривой высокочастотного титрования показания прибора откладывают по оси ординат как функцию объема добавленного титранта. Промышленностью выпускаются стандартные высокочастотные титраторы.
Электрохимические методы анализа. Кондуктометрия
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- 7.1. Принципы и классификация электрохимических методов анализа
- 7.2. Кондуктометрия
- 7.3. Потенциометрия
- 7.4. Кулонометрия. Вольтамперометрия. Полярография
7.1. Принципы и классификация электрохимических методов анализа
Электрохимические методы анализа основаны на использовании процессов, протекающих на поверхности электрода или в приэлектродном пространстве. Аналитическим сигналом в электрохимических методах анализа может служить любой электрический параметр, связанный с составом раствора и концентрацией вещества в нем потенциал (Е), сила тока (I), сопротивление (R), электрическая проводимость (W), количество электричества (Q). Названия конкретных методов чаще всего связаны с измеряемыми электрическими параметрами потенциометрия, амперометрия, кондуктометрия и др. (табл. 7.1).
Таблица 7.1 Классификация электрохимических методов по измеряемому параметру
Приборы электрохимических методов анализа, несмотря на все их многообразие, содержат одни и те же основные узлы:
- ● электрохимическую ячейку;
- ● устройство для измерения электрического параметра;
- ● внешние металлические проводники.
Электрохимическая ячейка — это сосуд с раствором электролита, в который погружены два или три электрода. Существуют следующие типы электрохимических ячеек:
- ● гальванический элемент два электрода — индикаторный и сравнения, используют в потенциометрии;
- ● кондуктометрическая ячейка два идентичных электрода, используют в кондуктометрии;
- ● электрохимическая трехэлектродная ячейка три электрода (рабочий, сравнения и вспомогательный), используют в вольтамперометрии;
- ● электролитические ячейки применяются в методах, основанных на протекании электролиза. В качестве устройств измерения электрических параметров служат
- ● микроамперметры (измерение силы тока I);
- ● милливольтметры (измерение разности потенциалов Е;
- ● мосты переменного тока (измерение сопротивления R;
- ● кондуктометры (измерение электрической проводимости W).
7.2. Кондуктометрия
Кондуктометрия является старейшим, самым простым и наименее селективным из всех электрохимических методов анализа. Метод возник в 1885 г., когда Кольрауш выяснил зависимость электропроводности от концентрации. В 1923 г. метод вошел в практику аналитических лабораторий (Кольтгоф), а в 60-е гг. ХХ в. появились первые кондуктометрические детекторы в жидкостной хроматографии. Кондуктометрический метод анализа основан на измерении электропроводности раствора:
W = I / R, где W — электропроводность раствора; R — сопротивление раствора. Аналитическим сигналом могут служить либо электропроводность раствора, либо его сопротивление. Сигнал возникает за счет диссоциации молекул на ионы; миграции ионов под действием внешнего источника напряжения. По этой причине данным методом можно анализировать только растворы электролитов.
Кондуктометрическая ячейка — это стеклянный сосуд с двумя идентичными электродами, выполняющими одинаковые функции, между которыми находится раствор электролита. Геометрическая форма сосуда влияет на измеряемую величину. Важнейшая характеристика такой ячейки — ее константа θ. Электроды изготавливают из платины, платинированной платины, нержавеющей стали. Они должны быть одинаковыми, инертными, параллельно расположенными, жестко закрепленными, с одинаковой площадью поверхности. Метод кондуктометрии подразделяют на прямую кондуктометрию и кондуктометрическое титрование.
Прямая кондуктометрия. Концентрацию вещества в этом методе определяют по результатам измерения электрической проводимости (или сопротивления). При этом используют два приема нахождения неизвестной концентрации
Метод градуировочного графика. График строят в координатах удельная электропроводность — концентрация (χ – С). Он линеен в небольшом диапазоне концентраций.
Расчетный метод. Метод используют для очень разбавленных растворов. Прямая кондуктометрия используется в качестве метода аналитического контроля растворов электролитов. Поскольку в величину аналитического сигнала вносят вклад все ионы, присутствующие в растворе, то применение метода ограничено из-за малой селективности.
Наиболее эффективно использование метода:
- ● для определения общего содержания электролитов в растворе (например, определение солей в минеральной, морской, речной воде);
- ● контроля качества дистиллированной воды (наиболее эффективный метод);
- ● контроля качества жидких пищевых продуктов (молока, напитков, вин);
- ● контроля качества технической воды, используемой в ряде производств (тонкие химические производства, фармацевтические 114 производства, теплотехнические производства (питание котлов), технология водоочистки, оценка загрязненности сточных вод);
- ● оценки чистоты органических растворителей (после экстракции примесей водой).
Преимуществами метода прямой кондуктометрии являются
- ● простота;
- ● высокая чувствительность (до 10 –4 мольл);
- ● достаточная точность (2 %).
Недостатком метода является малая селективность. При проведении прямых кондуктометрических измерений необходимо предварительно определить константу ячейки θ, поскольку удельная электрическая проводимость (χ) не равна электрической проводимости (W), а лишь пропорциональна ей χ = θ W = θ R, вследствие того, что электричество проводят не только ионы, заключенные в объеме между электродами (площадью 1 см 2 и расстоянием между ними 1 см). Чтобы найти константу ячейки, измеряют сопротивление (R) стандартных растворов электролитов (КС1 или NaC1) с известной удельной электрической проводимостью при нескольких концентрациях. Затем, используя справочные данные, рассчитывают θ.
Кондуктометрическое титрование. Сущность метода заключается в том, что измеряют удельную электропроводность χ раствора в ходе титрования и строят кривую титрования, которая является линейной (рис. 7.1). По оси абсцисс откладывают объем (V) раствора, используемого в ходе титрования. По излому кривой определяют объем титранта в точке эквивалентности (т.э.) и проводят расчет результатов анализа по закону эквивалентов. В кондуктометрическом титровании используют реакции в водных и неводных растворах. В ходе титрования электропроводность будет заметно меняться, если вводить или удалять ионы с высокой подвижностью.
Рис. 7.1. График кондуктометрического титрования раствора вещества
Окислительно-восстановительные реакции (ОВР) используют реже. Для протекания ОВР надо создавать определенные условия, например добавлять сильную кислоту, вспомогательные растворы. В результате в растворе оказывается много посторонних ионов (подвижных ионов Н+). На фоне значительного сигнала от посторонних ионов трудно зафиксировать небольшие изменения аналитического сигнала в ходе титрования. Многие ОВР протекают медленно, а ускорить их путем нагревания не представляется возможным, так как температура влияет на величину электропроводности. Ионы, образованные одним элементом, но в разных степенях окисления, трудно различить методом кондуктометрического титрования.
Часто излом на кривых кондуктометрического титрования получается нечетким, закругленным (см. рис. 7.1). В этом случае для нахождения объема титранта в т.э. приходится делать графические построения (продлевать линейные участки кривой и находить точку их пересечения).
На четкость излома влияют следующие факторы:
- ● концентрация титруемого вещества и титранта (общий фактор для всех типов реакций) чем меньше концентрация, тем менее четкий излом;
- ● в кислотно-основном титровании — сила кислоты или основания (чем меньше константа диссоциации, тем менее четкий излом);
- ● в комплексонометрическом титровании устойчивость комплекса (чем меньше Куст, тем менее четким получается излом из-за диссоциации комплекса);
- ● в осадительном титровании — растворимость осадка (чем больше ПР, тем менее четким получается излом из-за растворения осадка); постоянство состава осадка; скорость образования осадка; чистота осадка, который может быть загрязнен за счет соосаждения.
Кондуктометрическое титрование является удобным методом анализа, если продуктом реакции является слабый электролит (кислотно-основное взаимодействие, комплексообразование) или малорастворимое соединение (реакция осаждения). Слабая одноосновная уксусная кислота СН3СООН находится в кондуктометрической ячейке и титруется раствором NaOH из бюретки:
Как видно из уравнения реакции, в ходе титрования число зарядов увеличивается (исходное вещество — слабый электролит, среди продуктов есть два иона). Значит, электропроводность при титровании будет возрастать. До начала титрования в растворе содержится мало ионов, так как СН3СООН слабодиссоциированное соединение, поэтому значение χ должно быть невелико. В процессе титрования до т.э. образуется соль — сильный электролит. За счет этого в растворе появляются ионы СН3СОО – и Na + , причем по мере приближения к т.э. ионов становится больше. Следовательно, удельная электропроводность будет возрастать. После т.э. при добавлении избытка титранта в растворе появляются ионы Na+ и очень подвижные ионы ОН – во все больших и больших количествах, поэтому χ будет резко возрастать.
7.3. Потенциометрия
Метод возник в 1893 г., когда немецкий химик Р. Беренд впервые провел потенциометрическое титрование. Метод анализа основан на зависимости равновесного электродного потенциала (Е) от активности (a) или концентрации (с) вещества в растворе. Для измерений необходимо составить гальванический элемент из подходящего индикаторного электрода и электрода сравнения, а также прибор для измерения потенциала индикаторного электрода. Индикаторный электрод — это электрод, потенциал которого зависит от активности или концентрации определяемых ионов.
Требования к индикаторным электродам:
- 1) электрод должен обратимо реагировать на изменение активности или концентрации определяемых ионов;
- 2) потенциал его должен устанавливаться быстро (это особенно важно при проведении потенциометрического титрования);
- 3) электрод не должен влиять на состав раствора (например, часто используемый платиновый электрод может катализировать протекание некоторых реакций);
- 4) электрод должен быть химически устойчив по отношению к веществам, находящимся в растворе (например, цинковый электрод в кислых растворах может растворяться);
- 5) электрод должен быть неполяризуемым, т. е. его потенциал не должен меняться при протекании тока;
- 6) электрод должен иметь простую конструкцию.
Электрод сравнения — это электрод, относительно которого измеряют потенциал индикаторного электрода (он нужен для измерения ЭДС гальванического элемента). Требования к электродам сравнения:
1) потенциал электрода должен оставаться постоянным и не зависеть от состава анализируемого раствора;
2) электрод должен иметь низкое сопротивление.
Остальные требования к электроду сравнения такие же, как к индикаторному электроду. С помощью стандартного водородного электрода (рис. 7.2) можно определить потенциал другой системы. В каждом конкретном случае проведения анализа с использованием метода потенциометрии химик-аналитик должен обоснованно выбрать электродную систему. Индикаторный электрод выбирается в соответствии с требованиями к нему и в зависимости от типа химической реакции и природы определяемых ионов.
Рис. 7.2. Водородный электрод сравнения раствор — 1н серная кислота; электрод — платинированная платина
Электрод сравнения выбирается в соответствии с требованиями к нему. В аналитической химии чаще всего в такой роли используют хлорсеребряный электрод Ag, AgCl KCl (3М). Для проведения анализа измеряют ЭДС гальванического элемента и по зависимости Е = f (a) находят активность иона графическим или расчетным способом (метод градуировочного графика; метод добавок). Точность метода составляет 2–10 %. В аналитической химии метод применяют для определения рН, содержания катионов и анионов с использованием ионоселективных электродов (ионометрия).
Ионоселективные электроды (ИСЭ) — это датчики, позволяющие избирательно определять активность одних ионов в присутствии других (рис. 7.3). Одним из ионоселективных электродов, широко используемых в аналитической практике, является стеклянный электрод, который изготавливается из специальных сортов стекол, способных к обмену ионов.
Рис. 7.3. Устройство ИСЭ 1 — полупроницаемая мембрана (одни ионы из раствора проходят через нее, другие — нет); 2 — корпус; 3 — раствор постоянной концентрации определяемого иона; 4 — внутренний электрод сравнения; 5 — экранированный провод; 6 — анализируемый электролит
Ионометрия — это перспективный и быстроразвивающийся раздел потенциометрии, основанный на ионоселективных электродах. Главная часть ионоселективного электрода — мембрана 1 (см. рис. 7.3), проницаемая для одного вида ионов. Мембрана разделяет внутренний раствор 3 с известной концентрацией ионов и внешний, исследуемый раствор 6 с неизвестной концентрацией. В каждом из растворов находится металлический электрод. Исследуемые ионы проходят через мембрану в сторону меньшей концентрации, накапливаются, устанавливается динамическое равновесие и на поверхности мембраны возникает мембранный потенциал, противодействующий дальнейшему движению ионов. Измеряемая разность потенциалов между металлическими электродами описывается уравнением Нернста и позволяет рассчитать активность (концентрацию) ионов в широком интервале (до 5 порядков). Даже тысячекратный избыток посторонних ионов не влияет на работу электродов.
Высокочастотное титрование.
При высокочастотном титровании используют ток, получаемый в специальных высокочастотных генераторах (частота 
Ячейка с анализируемым раствором помещается между металлическими пластинами или внутрь
индуктивной катушки. В первом случае ячейка представляет собой конденсатор, во втором – индуктивность, то есть ячейка является электрической емкостью.
Сопротивление и электропроводность ячейки зависят:
Ø От подвижности ионов
Ø От свойств самого раствора, то есть от поляризации его молекул
Поляризация бывает двух типов:
1) Поляризация молекулярная (деформационная).
| + — |
— молекула была нейтральной
— стала диполем после прохождения тока высокой частоты
2) Поляризация ориентации (только для полярных молекул), то есть перемещение молекул в электрическом поле.
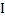 |
| V |
При высокочастотном титровании электроды с раствором не соприкасаются. Замеряется изменение тока, проходящего по цепи в зависимости от принятого объема рабочего раствора.
Недостатки метода:
ü Небольшая чувствительность.
ü Небольшая избирательность.
Преимущества:
ü Возможность определения агрессивных сред, органических соединений, растворов образующих плотные осадки.
ü Экономия драгоценных металлов.
ТЕМА II: «ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА»
http://farmf.ru/lekcii/elektrohimicheskie-metody-analiza-konduktometriya/
http://helpiks.org/4-50515.html





