Уравнение теплового баланса процесса горения
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
по дисциплине «ХИМИЯ ПРОЦЕССОВ ГОРЕНИЯ»
Для специальности 280705.65 – пожарная безопасность
СМК-УМК 4.4.2-40-2013
Тема 1.: Физико-химическая природа процессов горения
Занятие № 1.4: Температура горения (6 час.)
| № | Основные вопросы | Содержание вопросов, методика проведения | Время |
| ВВОДНАЯ ЧАСТЬ | Принятие доклада, проверка наличия слушателей, объявление темы занятия и основных вопросов. Тестирование, опрос. | ||
| ОСНОВНАЯ ЧАСТЬ | |||
| Учебные вопросы | |||
| 1. | Расчет теплового эффекта реакции горения | Преподаватель объясняет алгоритм решения задач 1.1 Расчет теплового эффекта реакции по 1 следствию закона Гесса. 1.2. Расчет теплового эффекта реакции по формуле Менделеева Далее курсанты самостоятельно решают подобные задачи | |
| 2. | Расчет температуры горения | Преподаватель объясняет алгоритм решения задач 2.1 Расчет температуры горения индивидуальных веществ; 2.2. Расчет ТГ для веществ сложного элементного состава. Далее курсанты самостоятельно решают подобные задачи | |
| ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ | Преподаватель характеризует работу курсантов на занятии, отвечает на вопросы. Курсанты записывают в тетрадь задание на самоподготовку по теме занятия. Преподаватель объявляет правила выполнения задания и срок его сдачи. |
III. Учебно-материальное обеспечение
1. Технические средства обучения: мультимедийная система, компьютерная техника, интерактивная доска.
2. Периодическая система элементов Д.И. Менделеева, демонстрационные плакаты, схемы.
ОСНОВНАЯ ЧАСТЬ (235 мин.)
Тепловое воздействие – один из наиболее опасных факторов пожара, который вызывает основные разрушения, уничтожает материальные ценности, вызывает гибель людей, определяет обстановку на пожаре, создает огромные трудности при его ликвидации. Расчет тепловых явлений, сопровождающих горение, позволяет принять правильные и своевременные меры противопожарные защиты.
Уравнение теплового баланса процесса горения
Тепловой баланс процесса горения складывается из следующих составляющих:
Основная статья приходной части теплового баланса – это теплота горения вещества Qгор.
Вторая составляющая – Qисх – теплота исходных веществ, т.е. теплосодержание горючего и окислителя. Эта величина зависит от агрегатного состояния и химической природы горючего. Например, для метана Qисх
Анализ этого уравнения показывает, что практически единственным источником тепловой энергии любого процесса горения, а значит, и любого пожара, является тепловой эффект химических реакций окисления в пламени, т.е. теплота горения, которая относится к важнейшим характеристикам пожарной опасности веществ и материалов.
Вопрос № 1. Расчет теплового эффекта реакции горения (50 мин.)
Энтальпией горения (DНгор, кДж/моль) вещества называется тепловой эффект реакции окисления 1 моль горючего вещества с образованием высших оксидов.
Теплота горения (Qгор) численно равна энтальпии горения, но противоположна по знаку.
Для индивидуальных веществ тепловой эффект реакции может быть рассчитан по I следствию закона Гесса.
| Расчет теплового эффекта реакции горения индивидуального вещества | Пример 1. Рассчитать тепловой эффект реакции горения 1 моль бутана С4Н10. |
1. Запишем уравнение реакции горения бутана.
2. Выражение для теплового эффекта этой реакции по I следствию закона Гесса
3. По таблице 1 приложения находим значения энтальпий образования углекислого газа, воды (газообразной) и бутана.
DН 0 (СО2) = -393,5 кДж/моль; DН 0 (Н2О) = — 241,8 кДж/моль;
Подставляем эти значения в выражение для теплового эффекта реакции
DН 0 р-и = 4×(–393,5) + 5×(–241,8) – (- 126,2) = — 2656,8 кДж
DН 0 р-и = DН 0 гор = — 1656,8 кДж/моль или Qгор = + 2656,8 кДж/моль.
Таким образом, при сгорании 1 моля бутана выделяется 2656,8 кДж тепла.
В пожарно-технических расчетах часто пользуются понятием удельной теплоты горения. Удельная теплота горения – это количество теплоты, которое выделяется при полном сгорании единицы массы или объема горючего вещества. Размерность удельной теплоты горения – кДж/кг или кДж/м 3 .
В зависимости от агрегатного состояния воды в продуктах горения различают низшую и высшую теплоту горения. Если вода находится в парообразном состоянии, то теплоту горения называют низшей теплотой горения Qн. Если пары воды конденсируются в жидкость, то теплота горения – высшая Qв.
Температура пламени достигает 100 К и выше, а вода кипит при 373 К, поэтому в продуктах горения на пожаре вода всегда находится в парообразном состоянии, и для расчетов в пожарном деле используется низшая теплота горения Qн.
Низшая теплота горения индивидуальных веществ может быть определена переводом значения DНгор, кДж/моль в Qн, кДж/кг или кДж/м 3 . Для веществ сложного элементного состава низшая теплота горения может быть определена по формуле Д.И. Менделеева. Кроме того, для многих веществ значения низшей теплоты горения приведены в справочной литературе [ ], некоторые данные представлены в приложении 2.
| Перевод значения энтальпии горения из кДж/моль в кДж/кг | Пример 2. Энтальпия горения этилацетата СН3СООС2Н5 равна DНгор = — 2256,3 кДж/моль. Выразить эту величину в кДж/кг. |
Значение DНгор = — 2256,3 кДж/моль показывает, что при сгорании 1 моля этилацетата выделяется 2256,3 кДж тепла, т.е. Qгор = + 2256,3 кДж/моль.
1 моль СН3СООС2Н5 имеет массу 88 г. Можно составить пропорцию
1 кг = 1000 г ¾ Qн кДж/кг

В общем виде формула для перевода из размерности кДж/моль в кДж/кг выглядит следующим образом:
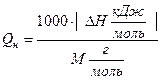
Если необходимо осуществить перевод из размерности кДж/моль в кДж/м 3 , то можно воспользоваться формулой

| Расчет низшей теплоты сгорания Qн по формуле Д.И. Менделеева | Пример 3. Вычислить низшую теплоту сгорания сульфадимезина С12Н14О2N4S по формуле Д.И. Менделеева. |
Значения низшей теплоты сгорания веществ и материалов могут быть рассчитаны по формуле Д.И.Менделеева. Данная формула может быть использована для расчетов Qн веществ сложного элементного состава, а также для любых индивидуальных веществ, если предварительно рассчитать массовую долю каждого элемента в соединении (w).
QН = 339,4×w(C) + 1257×w(H) — 108,9 [(w(O) +w(N)) -w(S)] — 25,1[9×w(H) +w(W)], кДж/кг,
w (С), w (Н), w (S), w (О),w (N) – – массовые доли элементов в веществе, %; w (W) – содержание влаги в веществе, %.
1. Для того, чтобы воспользоваться данной формулой, необходим расчет процентного состава каждого элемента в веществе (массовой доли).
Молярная масса сульфадимезина С12Н14О2N4S составляет 278 г/моль.
w(C) = (12×12)/278 = 144/278 = 0,518 ×100 = 51,8 %
w(H) = (1×14)/278 = 14/278 = 0,05 ×100 = 5,0 %
w(O) = (16×2)/278 = 32/278 = 0,115 ×100 = 11,5 %
w(N) = (14×4)/278 = 56/278 = 0,202 ×100 = 20,2 %
w(S) = 100 – (51,8 + 5,0 + 11,5 + 20,2) = 11,5 %
2. Подставляем найденные значения в формулу Д.И. Менделеева.
Теплота горения смеси газов и паров определяется как сумма произведений теплот горения каждого горючего компонента (Qн) на его объемную долю в смеси (j об ):
Qн = 
Можно воспользоваться эмпирической формулой для расчета Qн для газовой смеси:
Вопрос № 2. Расчет температуры горения (185 мин.)
Выделяющееся в зоне горения тепло расходуется на нагревание продуктов горения, на нагрев горючего вещества и окружающей среды. Температура, до которой в процессе горения нагреваются продукты горения, называется температурой горения. В технике и пожарном деле различают теоретическую, калориметрическую, адиабатическую и действительную температуру горения .
Тепловой баланс процессов горения
1333. Тепловой баланс процессов горения
3.1 Расчёт теплоты сгорания
При тепловых расчётах определят, как правило, низшую теплоту сгорания вещества. Низшая теплота рассчитывается как количество тепла, выделяющегося при сгорании единицы количества вещества или единицы массы при газообразном состоянии воды как продукта реакции. В первом случае речь идёт о мольной теплоте сгорания, во втором – об удельной теплоте сгорания. Связь мольной и удельной теплоты сгорания даётся формулой

где 

Формулы, для расчёта низшей теплоты сгорания приводятся в таблице 3-1.
Табл. 3-1 Расчётные формулы для определения низшей теплоты сгорания.


Формула (3.2) представляет следствие из закона Гесса. Согласно этому следствию тепловой эффект реакции будет равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ. Здесь 


Формула (3.3) носит название формулы . Она применяется для расчёта теплот сгорания сложных веществ, если известен их состав в массовых процентах. Здесь C, H,S, N,O – содержание соответствующего элемента в массовых процентах, W — влажность горючего.
Теплоту сгорания газовоздушных смесей определяют по формуле

где Qн – низшая теплота сгорания газообразного горючего, ц – содержание горючего в смеси (в объёмных %). В случае нескольких горючих газов производится суммирование по всем горючим

Пример 1. Рассчитать мольную и удельную теплоту сгорания уксусной кислоты.
Горючее – индивидуальное вещество. Для расчёта мольной теплоты сгорания воспользуемся следствием из закона Гесса (3.4). Запишем уравнение реакции
CH3CO2H + 2(O2 +3,76N2) = 2CO2 + 2H2O + 2·3,76N2.
Кислород и азот – простые вещества и их стандартные теплоты образования равны нулю. теплоты образования остальных участников реакции возьмём из справочных данных: ДfH0(CH3CO2H) = -485,6 кДж/моль, ДfH0(CO2) = -396,9 кДж/моль, ДfH0(H2O) = -242,2 кДж/моль. Теплота сгорания уксусной кислоты будет равна 

Пример 2. Рассчитать низшую теплоту сгорания органического вещества состава С – 62%, H – 8%, O – 28%, S – 2%.
Горючее – сложное вещество, для расчёта теплоты сгорания воспользуемся формулой Менделеева (3.3). 
Пример 3. Рассчитать теплоту сгорания газовой смеси состава (в об. %) CH4 – 40%, C4H10 – 20%,O2 – 15%, H2S – 15%, NH3 – 10%, CO2 – 10%.
Определим низшую теплоту сгорания каждого горючего газа в смеси CH4, C4H10, H2S и NH3 используя следствие из закона Гесса (3.4). Теплоты образования горючих продуктов реакции возьмём из справочных таблиц. Поскольку теплота образования азота равна нулю (простое вещество) то для простоты не будем включать азот воздуха в уравнение реакции.
Табл. 3-2. Теплоты сгорания компонентов газовой смеси.
Теплота сгорания, кДж/моль
CH4 +2O2 = CO2 + 2H2O
C4H10 + 6,5O2 = 4CO2 + 5H2O
H2S +1,5O2 = H2O + SO2
NH3 +0,75O2 = 0,5N2 + 1,5H2O
По формуле (3.6) определим теплоту сгорания газовой смеси.


Пример 4: Рассчитать теплоту сгорания 1 м3 стехиометрической смеси гексана с воздухом.
Стехиометрический состав смеси находится из уравнения реакции
C6H14 + 9,5(O2 + 3,76N2) = 6CO2 + 7H2O + 9,5·3,76N2.
Весь объём участников реакции, т. е. сумму стехиометрических коэффициентов, примем за 100%. А количество горючего (1 моль) будет соответствовать стехиометрической концентрации 



3.2 Тепловой баланс и расчёт температуры горения
Под температурой горения понимают максимальную температуру, до которой нагреваются продукты горения. В технике и пожарном деле различают теоретическую, калориметрическую, адиабатическую и действительную температуру горения.
Теоретическая температура горения – это температура, при которой выделившаяся теплота горения смеси стехиометрического состава расходуется на нагрев и диссоциацию продуктов горения. Практически диссоциация продуктов горения начинается при температуре выше 2000 К
Калориметрическая температура горения – это температура, которая достигается при горении стехиометрической горючей смеси с начальной температурой 273 К и при отсутствии потерь в окружающую среду.
Адиабатическая температура горения – это температура полного сгорания смесей любого состава при отсутствии тепловых потерь в окружающую среду.
Действительная температура горения – это температура горения, достигаемая в условиях реального пожара. Она намного ниже теоретической, калориметрической и адиабатической, т. к. в реальных условиях до 40 % теплоты горения обычно теряется на излучение, недожог, нагрев избытка воздуха и т. д.
Экспериментальное определение температуры горения для большинства горючих веществ представляет значительные трудности, особенно для жидкостей и твёрдых материалов. Однако в ряде случаев теория позволяет с достаточной для практики точностью вычислить температуру горения веществ, основываясь только на знании их химической формулы, состава исходной горючей смеси и продуктов горения.
В общем случае используется зависимость вида

где Qпг – теплота, перешедшая в продукты горения (энтальпия или теплосодержание продуктов горения), Vпг – объём продуктов горения, Cp – удельная теплоёмкость продуктов горения при постоянном давлении, Tг – температура горения. Но напрямую пользоваться формулой (3.7) нельзя, т. к. теплоёмкость есть функция температуры (
Энтальпия продуктов горения определяется из уравнения теплового баланса.


где Qпг – энтальпия продуктов горения, Qисп – теплота испарения, Qпот – тепловые потери за счёт излучения (Qи), недожога (Qнед) и диссоциации (Qдисс) продуктов горения. В зависимости от рода учитываемых потерь теплоты в зоне горения (на излучение, недожог, диссоциацию продуктов горения) вычисляется та или иная температура.
Энтальпия продуктов реакции может быть представлена как сумма энтальпий всех продуктов реакции.

где Vпг. i – объём i-того продукта горения, Cp, i – его изобарная теплоёмкость, Tг – температура горения.
При кинетическом горении газопаровоздушных смесей потери теплоты из зоны горения пренебрежимо малы, поэтому для этих смесей действительная температура горения близка к адиабатической, которую и используют в пожарно-технических расчетах.
Для расчёта температуры горения составим уравнение теплового баланса, учитывая, что выделяющееся тепло нагревает продукты горения от начальной температуры T0 до температуры Tг.

где з — коэффициент теплопотерь (доля потерь тепла на излучение, а также в результате неполноты сгорания). из уравнения теплового баланса следует

Трудность в определении температуры горения по этой формуле заключается в том, что теплоёмкость газа зависит от температуры. Так как газы нагреваются от температуры T0 до температуры Тг, то в формулу (3.12) необходимо подставить среднее значение теплоёмкости именно в этом интервале температур. Но температура горения нам неизвестна и мы хотим её найти. В этом случае можно поступить следующим образом. Среднее значение температуры горения большинства веществ в воздухе составляет примерно 1500 К. Поэтому с небольшой погрешностью в определении Тг для расчётов можно взять среднее значение теплоёмкости в интервале температур 273–1500 К.
3.3 Расчёт температуры горения методом последовательных приближений
Для более точных расчётов температуры горения используют метод последовательных приближений, по известной зависимости теплосодержания (энтальпии) продуктов горения от температуры. Если теплосодержание продуктов горения при Т=273 К принять равным нулю, то полное теплосодержание продуктов горения при Тг будет равно количеству теплоты, выделившейся в результате химической реакции. Учётом теплопотерь

где Hпг, i – энтальпия i – того продукта горения. Задача состоит в том, чтобы найти температуру, при которой будет справедливо это равенство. Энтальпии продуктов горения приведены в справочных таблицах.
Алгоритм расчёта приведён в табл. 3-3.
Табл. 3-3. Алгоритм расчёта температуры горения.
Объём и состав продуктов горения
Низшая теплота сгорания или количество тепла, пошедшего на нагрев продуктов горения (при наличии теплопотерь)
Среднее значение энтальпии продуктов горения

Температура горения T1 по средней энтальпии с помощью справочным таблицам, ориентируясь на азот (наибольшее содержание в продуктах горения)
Теплосодержание продуктов горения с температурой Т1

Теплосодержание продуктов горения с температурой Т2 Если Q1>Qпг то T2 T1
Расчёт ведётся до получения неравенства 

Температура взрыва, протекающего в изохорно-адиабатическом режиме (при постоянном объёме) рассчитывается по уравнению теплового баланса (3.13) и алгоритму табл. 3-3, В отличие от горения вместо энтальпии продуктов горения используется их внутренняя энергия (также находимая по справочным таблицам)

где Cv – теплоёмкость при постоянном объёме кДж/моль·К, кДж/кг·К.
Пример 5: Рассчитать адиабатическую температуру горения стехиометрической смеси этилового спирта (C2H6O) с воздухом.
Так как горючее – индивидуальное вещество для определения состава и объёма продуктов горения запишем уравнение реакции.
C2H6O + 3(O2 + 3,76N2) = 2CO2 + 3H2O + 3·3,76N2.
Объёмы продуктов реакции 










Пример 6: Рассчитать адиабатическую температуру горения органического вещества состава С – 60%, H – 7%, O – 25%, W – 8%.
Горючее – сложное вещество, состав продуктов горения определяем по формулам §2.2. 










Пример 7: Рассчитать действительную температуру горения фенола (C6H6O, 
Так как горючее – индивидуальное вещество составим уравнение реакции горения фенола.
C6H6O + 7(O2 + 3,76N2) = 6CO2 + 3H2O + 7·3,76N2
Определим объём и состав продуктов горения фенола. 






Пример 8: Рассчитать температуру взрыва метановоздушной смеси стехиометрического состава.
Расчет едём по алгоритму, изложенному в табл. 3-3. с учётом формулы (3.17). Составим уравнение реакции взрыва и найдём объём и состав продуктов горения
CH4 + 2(O2 + 3,76N2) = CO2 + 2H2O + 2·3,76N2.
Объёмы продуктов горения 










3.4 Задачи для самостоятельного решения
1. В каком случае в условиях пожара при горении бутана выделится больше тепла: при полном горении или неполном, протекающем по реакции С4Н10 + 4,5О2→4СО+5Н2О. Ответ необходимо подтвердить расчётом с использованием закона Гесса.
2. Вычислить теплоту образования ацетилена (C2H2) из элементов, если его теплота горения равна 1411, 2 кДж/моль.
3. Определить теплоту сгорания 12 кг бензола (C6H6), если теплота его образования составляет -82,9 кДж/моль/
4. Определить теплоту образования пимелиновой кислоты (С7Н12О4), если теплота её сгорания составляет 3453, 5 кДж/моль.
5. Определить теплоту сгорания салициловой кислоты (C7H6O3), если теплота её образования составляет -589,5 кДж/моль.
6. Вычислить теплоту образования метана, если при сжигании 10 г его в стандартных условиях выделяется 556,462 кДж тепла.
7. Определить теплоту сгорания бензилового спирта (С7Н8О), если теплота его образования составляет -875, 4 кДж/моль.
8. При образовании октана (C8H18) из элементов выделяется 208,45 кДж/моль тепла. Рассчитать его теплоту горения.
9. Теплота образования ацетона (C3H6O) составляет -248,28 кДж/моль. Определить его теплоту горения и количество тепла, которое выделится при сгорании 30 г. вещества.
10. Рассчитать теплоту сгорания сульфапиридазина (С11Н12О3N4S) без учёта потерь на испарение влаги.
11. Определить теплоту сгорания сульфофенилгидразина (С6Н8О3N2S) с учётом потерь на испарение воды. Содержание влаги в веществе 20 %.
12. Определить теплоту сгорания 4, 4-диаминодифенилсульфона (С12Н12О2N2S) без учёта потерь на испарение влаги по формуле .
13. Определить теплоты сгорания 4, 6-диметилгексагидро-1, 3, 5-триазинтиона-2 (С5Н9N3S) по формуле .
14. Определить теплоту сгорания по формуле диаминомезитилен-6-сульфокислоты (С9Н14О3N2S), если содержание влаги в веществе 35 %.
15. Определить низшую теплоту горения древесины состава: С – 41,5%; Н – 6%; О – 43 %; N – 2%; W– 7,5%.
16. Определить теоретическую температуру горения ацетона (C3H6O) с использованием средних значений теплоёмкостей.
17. Определить теоретическую температуру горения пентана (C5H12) с использованием средних значений теплоёмкостей.
18. Определить теоретическую температуру горения октана (C8H18) и использованием средних значений теплоёмкостей.
19. Определить теоретическую температуру горения бензола (C6H6) с использованием средних значений теплоёмкостей.
20. Методом последовательных приближений рассчитать адиабатическую температуру горения пропанола (C3H8O).
21. Рассчитайте температуру горения для стехиометрической смеси горючего вещества с воздухом (табл. 3-4).
Анализ уравнения теплового баланса горения топлива
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
« МОРДОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ им. Н. П. ОГАРЕВА»
(ГОУВПО «МГУ им. Н. П. Огарева»)
ИНСТИТУТ МЕХАНИКИ И ЭНЕРГЕТИКИ
КАФЕДРА ТЕПЛОЭНЕРГЕТИЧЕСКИХ СИСТЕМ
Теория горения и взрыва
Специальность – 330600 «Защита в чрезвычайных ситуациях – 65»
Направление подготовки специалиста – 656500 «Безопасность жизнедеятельности»
ЛАБОРАТОРНАЯ РАБОТА № 2
ТЕПЛОВОЙ БАЛАНС ГОРЕНИЯ
Определение теплоты горения (теплотворной способности) топлива
Определение теоретической температуры горения.
Лабораторная работа №2
ТЕПЛОВОЙ БАЛАНС ГОРЕНИЯ
Овладение методами расчета теплового баланса процесса горения газообразных, жидких и твердых топлив. Работа сводится к решению следующих задач.
- Определение теплоты горения (теплотворной способности) топлива.
- Определение теоретической температуры горения.
Химические реакции сопровождаются выделением или поглощением теплоты. При выделении теплоты реакция называется экзотермической, а при поглощении – эндотермической. Все реакции горения являются экзотермическими, а продукты горения относятся к экзотермическим соединениям.
Выделяемая (или поглощаемая) при протекании химической реакции теплота называется теплотой реакции. В экзотермических реакциях она положительна, в эндотермических – отрицательна. Реакция горения всегда сопровождается выделением теплоты. Теплотой горения Qг (Дж/моль) называется количество теплоты, которое выделяется при полном сгорании одного моля вещества и превращении горючего вещества в продукты полного горения. Моль является основной единицей количества вещества в системе СИ. Один моль – это такое количество вещества, в котором находится столько же частиц (атомов, молекул и т.д.), сколько содержится атомов в 12 г изотопа углерода–12. Масса количества вещества, равного 1 молю (молекулярная или молярная масса) численно совпадает с относительной молекулярной массой данного вещества.
Например, относительная молекулярная масса кислорода (O2) равна 32, углекислого газа (CO2) равна 44, а соответствующие молекулярные массы будут равны M = 32 г/моль и M = 44 г/моль. Таким образом, в одном моле кислорода содержится 32 грамма этого вещества, а в одном моле CO2 содержится 44 грамма углекислого газа.
В технических расчетах чаще используется не теплота горения Qг, а теплотворная способность топлива Q (Дж/кг или Дж/м 3 ). Теплотворной способностью вещества называется количество теплоты, которое выделяется при полном сгорании 1 кг или 1 м 3 вещества. Для жидких и твердых веществ расчет проводится на 1 кг, а для газообразных – на 1 м 3 .
Знание теплоты горения и теплотворной способности топлива необходимо для расчета температуры горения или взрыва, давления при взрыве, скорости распространения пламени и других характеристик. Теплотворная способность топлива определяется либо экспериментальным, либо расчетным способами. При экспериментальном определении теплотворной способности заданная масса твердого или жидкого топлива сжигается в калориметрической бомбе, а в случае газообразного топлива – в газовом калориметре. С помощью этих приборов измеряется суммарная теплота Q0, выделяющаяся при сгорании навески топлива массой m. Величина теплотворной способности Qг находится по формуле

Связь между теплотой горения и
теплотворной способностью топлива
Для установления связи между теплотой горения и теплотворной способностью вещества необходимо записать уравнение химической реакции горения.
Продуктом полного горения углерода является диоксид углерода:
Продуктом полного горения водорода является вода:
Продуктом полного горения серы является диоксид серы:
При этом выделяются в свободном виде азот, галоиды и другие негорючие элементы.
Горючее вещество – газ
В качестве примера проведем расчет теплотворной способности метана CH4, для которого теплота горения равна Qг = 882.6 
- Определим молекулярную массу метана в соответствии с его химической формулой (СН4):
М=1∙12+4∙1=16 г/моль.
- Определим теплотворную способность 1 кг метана:

- Найдем объем 1 кг метана, зная его плотность ρ=0.717 кг/м 3 при нормальных условиях:

- Определим теплотворную способность 1 м 3 метана:

Аналогично определяется теплотворная способность любых горючих газов. Для многих распространенных веществ значения теплоты горения и теплотворной способности были измерены с высокой точностью и приведены в соответствующей справочной литературе. Приведем таблицу значений теплотворной способности некоторых газообразных веществ (табл. 2.1). Величина Q в этой таблице приведена в МДж/м 3 и в ккал/м 3 , поскольку часто в качестве единицы теплоты используется 1 ккал = 4.1868 кДж.
Таблица 2.1 — Теплотворная способность газообразных топлив
| Вещество | Метан | Ацетилен | Этан | Пропан | Бутан | |
| Q | МДж/м 3 | 39.54 | 57.78 | 69.33 | 98.18 | 126.57 |
| ккал/м 3 | 9444 | 13800 | 16560 | 23450 | 30230 | |
Горючее вещество – жидкость или твердое тело
В качестве примера проведем расчет теплотворной способности этилового спирта С2Н5ОН, для которого теплота горения Qг = 1373.3 кДж/моль.
- Определим молекулярную массу этилового спирта в соответствии с его химической формулой (С2Н5ОН):
М = 2∙12 + 5∙1 + 1∙16 + 1∙1 = 46 г/моль.
- Определим теплотворную способность 1 кг этилового спирта:

Аналогично определяется теплотворная способность любых жидких и твердых горючих. В табл. 2.2 и 2.3 приведены значения теплотворной способности Q (МДж/кг и ккал/кг) для некоторых жидких и твердых веществ.
Таблица 2.2 — Теплотворная способность жидких топлив
| Вещество | Метиловый спирт | Этиловый спирт | Ацетон | Керосин | Мазут, нефть | Бензин | |
| Q | МДж/кг | 23.85 | 29.85 | 30.98 | 41.87 | 43.96 | 46.89 |
| ккал/кг | 5700 | 7130 | 7400 | 10000 | 10500 | 11200 | |
Таблица 2.3 — Теплотворная способность твердых топлив
| Вещество | Дерево свежее | Дерево сухое | Бурый уголь | Торф сухой | Антрацит, кокс | Парафин | |
| Q | МДж/кг | 6.28 | 14.65 | 16.75 | 27.63 | 31.40 | 46.05 |
| ккал/кг | 1500 | 3500 | 4000 | 6600 | 7500 | 11000 | |
Если теплотворная способность топлива неизвестна, то ее можно рассчитать с помощью эмпирической формулы, предложенной Д.И. Менделеевым. Для этого необходимо знать элементарный состав топлива (эквивалентную формулу топлива), то есть процентное содержание в нем следующих элементов:
В продуктах сгорания топлив всегда содержатся пары воды, образующиеся как из-за наличия влаги в топливе, так и при сгорании водорода. Отработанные продукты сгорания покидают промышленную установку при температуре выше температуры точки росы. Поэтому тепло, которое выделяется при конденсации водяных паров, не может быть полезно использовано и не должно учитываться при тепловых расчетах.
Для расчета обычно применяется низшая теплотворная способность Qн топлива, которая учитывает тепловые потери с парами воды. Для твердых и жидких топлив величина Qн (МДж/кг) приближенно определяется по формуле Менделеева:
где в скобках указано процентное (масс. %) содержание соответствующих элементов в составе топлива.
В этой формуле учитывается теплота экзотермических реакций горения углерода, водорода и серы (со знаком «плюс»). Кислород, входящий в состав топлива, частично замещает кислород воздуха, поэтому соответствующий член в формуле (2.1) берется со знаком «минус». При испарении влаги теплота расходуется, поэтому соответствующий член, содержащий W, берется также со знаком «минус».
Сравнение расчетных и опытных данных по теплотворной способности разных топлив (дерево, торф, уголь, нефть) показало, что расчет по формуле Менделеева (2.1) дает погрешность, не превышающую 10%.
Низшая теплотворная способность Qн (МДж/м 3 ) сухих горючих газов с достаточной точностью может быть рассчитана как сумма произведений теплотворной способности отдельных компонентов и их процентного содержания в 1 м 3 газообразного топлива.
где в скобках указано процентное (объем. %) содержание соответствующих газов в составе смеси.
В среднем теплотворная способность природного газа составляет примерно 53.6 МДж/м 3 . В искусственно получаемых горючих газах содержание метана СН4 незначительно. Основными горючими составляющими являются водород Н2 и оксид углерода СО. В коксовальном газе, например, содержание Н2 доходит до (55 ÷ 60)%, а низшая теплотворная способность такого газа достигает 17,6 МДж/м 3 . В генераторном газе содержание СО
15%, при этом низшая теплотворная способность генераторного газа Qн = (5.2÷6.5) МДж/м 3 . В доменном газе содержание СО и Н2 меньше; величина Qн = (4.0÷4.2) МДж/м 3 .
Рассмотрим примеры расчета теплотворной способности веществ по формуле Менделеева.
Определим теплотворную способность угля, элементный состав которого приведен в табл. 2.4.
Таблица 2.4 — Элементный состав угля
| Элемент | C | H | S | N | O | W | A |
| Содержание, масс. % | 37.2 | 2.6 | 0.6 | 0.4 | 12 | 40 | 7.2 |
- Подставим приведенные в табл. 2.4 данные в формулу Менделеева (2.1) (азот N и зола A в эту формулу не входят, поскольку являются инертными веществами и не участвуют в реакции горения):
Qн= 0.339∙37.2+1.025∙2.6+0.1085∙0.6–0.1085∙12–0.025∙40 = 13,04 МДж/кг.
Определим количество дров, необходимое для нагрева 50 литров воды от 10С до 100С, если на нагревание расходуется 5% теплоты, выделяемой при горении, а теплоемкость воды с = 1 ккал/(кг∙град) или 4.1868 кДж/(кг∙град). Элементный состав дров приведен в табл. 2.5:
Таблица 2.5 — Элементный состав дров
| Элемент | C | H | N | O | W |
| Содержание, масс. % | 43 | 7 | 2 | 41 | 7 |
- Определим количество теплоты, необходимое для нагрева m = 50 кг воды:
Q1 =
- Найдем теплотворную способность дров по формуле Менделеева (2.1):
Qн= 0.339∙43+1.025∙7–0.1085∙41–0.025∙7= 17.12 МДж/кг.
- Определим количество теплоты, расходуемое на нагрев воды, при сгорании 1 кг дров (с учетом того, что на ее нагрев расходуется 5% теплоты (=0.05), выделяемой при горении):
Q2 = Qн= 0.05·17.12 = 0.86 МДж/кг.
- Определим количество дров, необходимое для нагрева 50 литров воды от 10С до 100С:

Таким образом, для нагрева воды требуется около 22 кг дров.
- ТЕОРЕТИЧЕСКАЯ ТЕМПЕРАТУРА ГОРЕНИЯ
Температура горения любого вещества не является постоянной величиной. Она зависит от условий горения (в замкнутом объеме или на открытом воздухе), от условий теплоотдачи, полноты сгорания топлива, коэффициента избытка воздуха и других факторов.
Для сравнения температуры горения Тг разных веществ расчет ведется при строго одинаковых следующих условиях.
- Горючее и воздух вступают в реакцию горения при температуре Т = 0С.
- Количество воздуха равно теоретически необходимому, то есть коэффициент избытка воздуха α =1.
- Горение происходит мгновенно до полного окисления (СО2, Н2О, SO2) без образования промежуточных продуктов неполного горения (например, угарного газа СО).
- Вся выделенная теплота сообщается продуктам горения и расходуется исключительно на их нагревание.
Рассчитанная при этих условиях температура называется теоретической. Практически реализуемая температура горения T (при пожарах, при горении в печах, каминах, камерах сгорания и других технических устройствах) всегда ниже теоретической Tг. Это связано с тем, что реальный процесс горения происходит с избытком воздуха, в условиях неполного сгорания. Кроме того, теплота горения частично расходуется на нагрев окружающей среды, а при температурах выше 1700С – на диссоциацию продуктов горения.
Например, при горении древесины, отличие Тг от практически реализуемой температуры горения может достигать более 500 С (табл. 2.6).
Таблица 2.6 — Температура горения древесины
| Древесина | Q, МДж/кг | Тг, С | Т, С |
| Береза | 13.25 | 1575 | 1069 |
| Ель | 13.45 | 1590 | 1080 |
| Сосна | 13.84 | 1605 | 1090 |
Расчет теоретической температуры горения
При определении теоретической температуры горения Тг предполагается, что вся выделившаяся теплота сообщается продуктам сгорания. Температура, до которой нагреются продукты сгорания, зависит от количества сообщаемой им теплоты, состава и количества продуктов сгорания и их удельной теплоемкости. Для расчета теоретической температуры горения Тг запишем уравнение теплового баланса.

где Q – теплотворная способность топлива, Дж/кг;
V – объем продуктов сгорания, образующихся при горении 1 кг топлива, м 3 /кг;
сp –объемная удельная теплоемкость продуктов сгорания, Дж/(м 3 ∙град);
Тг – теоретическая температура горения, С;
Тн – начальная температура воздуха, С.
При горении в нормальных условиях (Тн=0С) уравнение (5.3) примет вид:

Из (2.4) следует формула для расчета теоретической температуры горения:

Поскольку продукты сгорания реальных топлив, как правило, состоят из разных газов, теплоемкость и плотность которых различны, то эта формула (2.4) записывается в следующем виде:

Соответственно, формула для расчета с учетом (2.6) примет вид

Для повышения точности расчетов необходимо учитывать зависимость теплоемкости газов от температуры. Однако, для оценочных расчетов можно принять средние значения теплоемкости (табл. 2.7).
Таблица 2.7 — Средняя теплоемкость (сp) газов в диапазоне температур (1000÷3000)С
| Газ | СО2 | SO2 | H2O | H2 | N2 | CO | O2 |
| кДж/(м 3 ∙град) | 2.13 | 2.13 | 2.09 | 1.42 | 1.42 | 1.42 | 1.42 |
Расчет теоретической температуры горения Тг проводится в следующем порядке.
- Рассчитывается количество и состав продуктов горения, образующихся при сгорании 1 кг заданного топлива в соответствии с методикой, изложенной выше (раздел 2.4).
- Рассчитывается по формулам (2.1) или (2.2), или определяется из таблиц теплотворная способность топлива Q.
- Рассчитывается теоретическая температура горения Тг по формуле (2.7).
В качестве примера определим теоретическую температуру горения каменного угля, элементный состав которого приведен в табл. 2.8., при коэффициенте избытка воздуха = 1.5.
Таблица 2.8 — Элементный состав угля
| Элемент | C | H | S | N | O | W | A |
| Содержание, масс.% | 76 | 4.5 | 4.7 | 1.8 | 3.5 | 3.0 | 6.5 |
| Массовая доля, z | 0.76 | 0.045 | 0.047 | 0.018 | 0.035 | 0.03 | 0.065 |
- Определим состав и количество газообразных продуктов сгорания 1 кг рассматриваемого топлива в данных условиях по методике, приведенной в разделе 4.
Объем СО2 и SO2: 
Объем H2O: 
Объем N2 и О2: 
- Проведем расчет теплотворной способности рассматриваемого топлива по формуле Менделеева (2.1):
Qн=0.339∙76+1.025∙4.5+0.1085∙4.7–0.1085∙3.5–0.025∙3.0=29.92 МДж/кг.
- Проведем расчет теоретической температуры горения по формуле (2.7):

Таким образом, теоретическая температура горения каменного угля при коэффициенте избытка воздуха = 1.5 в условиях постоянного давления (на открытом воздухе) составляет около 1600С.
Содержание отчета
1. Теоретические сведения о сущности вопроса и ходе выполнения работы (опыта).
2. Краткое описание лабораторной установки, технические и метрологические характеристики средств измерений, краткие пояснения проводимых опытов
3. Данные эксперимента, занесенные в таблицу, расчеты, рисунки.
4. Анализ результатов эксперимента, выводы по работе и анализ результатов.
- Зельдович Я.Б., Баренблатт Г.Н., Либрович В.Б., Махвиладзе Г.М. Математическая теория горения и взрыва. – М.: Наука, 1980. – 478 с.
- Основы практической теории горения: Учебное пособие для вузов / В.В. Померанцев, К.М. Арефьев, Д.Б. Ахмедов и др. – Л.: Энергоатомиздат, 1986. 312 с.
Есть женщины, которые говорят, что не примут от вас ни сантима. Вот они-то вас и разоряют. Саша́Гитри
ещё >>
http://pandia.ru/text/81/493/91060.php
http://davaiknam.ru/text/laboratornaya-rabota-2-teplovoj-balans-goreniya-opredelenie-te








