Опыты по химии. Амины
Бромирование анилина
Аминогруппа влияет на свойства бензольного кольца. Она делает его более реакционноактивным. К насыщенному водному раствору анилина прильем бромную воду. Раствор мутнеет. Выпадает белый осадок 2,4,6-триброманилина.
С6Н5NH2 + 3 Br2 = C6H2Br3 + 3HBr
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и бромом.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие анилина с соляной кислотой
Анилин – слабое основание. С сильными кислотами анилин способен образовывать соли. Приготовим смесь анилина с водой. Прибавим к смеси соляную кислоту. Происходит растворение анилина. В растворе образуется солянокислый анилин или хлорид фениламмония
С6Н5NH2 + HCI = [C6H5NH3] CI
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение среды раствора анилина
Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов. Возьмем пробу раствора анилина. Добавим в пробирку лакмус. Окраска индикатора не изменяется, это значит, что раствора анилина имеет нейтральную реакцию среды. Оборудование: пробирка, штатив для пробирок.
Оборудование: пробирка, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение физических свойств анилина
Анилин – бесцветная маслянистая жидкость. При хранении анилин постепенно окисляется и приобретает вначале желтую, затем бурую окраску. Изучим растворимость анилина в воде. Прибавим анилин к воде и перемешаем раствор. Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется всего 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественное определение азота в органических соединениях
Очень чувствительным методом определения азота в органических соединениях является сплавление вещества с металлическим натрием. Небольшую порцию анализируемого вещества сплавляем с кусочком металлического натрия. Важно, чтобы весь натрий прореагировал или окислился. Когда весь натрий прореагировал, охлаждаем пробирку, заливаем ее водой и кипятим. К полученному раствору добавляем крупинку сульфата железа (II) и вновь нагреваем. Затем добавляем соляную кислоту. Появление синего окрашивания свидетельствует о наличии азота в исследуемом органическом соединении. При сплавлении натрия с азотсодержащим веществом образуется цианид натрия. С солью двухвалентного железа цианид натрия образует гексацианоферрат (II) натрия. Так как сульфат железа (II) всегда содержит примесь железа (III), то с железом (III) гексацианоферрат натрия образует берлинскую лазурь. Появляется голубое окрашивание.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, стакан, фильтровальная бумага, скальпель, пинцет.
Техника безопасности. Соблюдать правила работы со щелочными металлами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление анилина раствором дихромата калия
Окисление анилина дихроматом калия позволяет получить важный промышленный краситель – черный анилин. К насыщенному раствору дихромата калия прибавим раствор серной кислоты и эмульсию анилина. Жидкость окрашивается в зеленый цвет, который постепенно переходит в черный. Образуется черный анилин — нерастворимый в воде краситель.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление анилина раствором хлорной извести
Определить наличие анилина в растворе можно с помощью раствора хлорной извести. К сильно разбавленному раствору анилина добавим отфильтрованный раствор хлорной извести. Раствор становится синим. Реакция с хлорной известью – качественная реакция на анилин, она основана на легкой окисляемости анилина. Реакция очень чувствительна и позволяет определить даже следы анилина.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение гидроксида диметиламмония и изучение его свойств
Амины с водой образуют достаточно сильные основания. Приготовим раствор диметиламина в воде. Газ диметиламин хорошо растворяется в воде. При этом образуется гидроксид диметиламмония (гидрат диметиламина)
(СН3)2NH + H2O = [(СН3)2NH2]ОН
Пробу гидроксида диметиламмония (гидрата диметиламина) испытаем раствором фенолфталеина. Фенолфталеин приобретает малиновую окраску: среда раствора – щелочная. К следующей порции раствора прибавим раствор хлорида железа (III) – выпадает бурый осадок гидроксида железа.
3[(СН3)2NH2]ОН + FeCI3 = Fe(OH)3 ↓+ 3[(СН3)2NH2]CI
Вносим палочку, смоченную концентрированной соляной кислотой, в выделяющийся газ диметиламин, образуется густой белый дым. Дым – кристаллы гидрохлорида диметиламина.
(СН3)2NH + HCI = [(СН3)2NH2] CI
Оборудование: пробирки, штатив для пробирок, горелка.
Техника безопасности. Соблюдать правила работы со щелочами, кислотами. Правила работы нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение диметиламина и его горение
Получим диметиламин действием гидроксида натрия на хлорид диметиламина. Смешаем в пробирке хлорид диметиламина со щелочью и прибавим воды. При легком нагревании выделяется газ диметиламин.
[(СН3)2NH2] CI + NaOH = (СН3)2NH + NaCI + H2O
При поджигании диметиламин сгорает с образованием углекислого газа, водяных паров и азота.
4(СН3)2NH +15 O2 = 8CO2 + 14H2O + 2N2
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, газоотводная трубка.
Техника безопасности. Соблюдать правила работы со щелочами и нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Анилин и соляная кислота уравнение
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Если вы хотите узнать, почему при добавлении соляной кислоты происходит растворение анилина, смотрите видеоопыт о том, как эти вещества могут взаимодействовать друг с другом.
Анилин (С6Н5NH2) – простейший ароматический амин, представляет собой бесцветную маслянистую жидкость, плохо растворимую в воде.
В видеоопыте продемонстрирована способность анилина вступать в химическую реакцию с соляной кислотой.
Готовится смесь (эмульсия) анилина с водой и добавляется соляная кислота. Мутная эмульсия становится прозрачной — наблюдается растворение анилина. Почему при добавлении соляной кислоты происходит растворение анилина?
Анилин – слабое основание, так как в состав анилина входит группа ОН — . Гидроксильная группа может связываться с ионами Н + . Поэтому анилин может взаимодействовать с сильными кислотами с образованием солей. Также анилин вступает в реакции, как по аминогруппе, так и по ароматическому кольцу.
Анилин+соляная кислота= солянокислый анилин (хлорид фениламмония), который растворим в воде. Уравнение этой реакции выглядит так:
Реакция анилин+соляная кислота в результате дает растворение анилина. Поэтому мутная эмульсия воды и анилина превращается в прозрачный раствор воды с солянокислым анилином.
Анилин и соляная кислота уравнение
3764 дн. с момента
как существует сайт
Владельцы сайта
- Надежда Смирнова
Анилин
Анилин. Его свойства и применение .mp4
35 Анилин.mp4
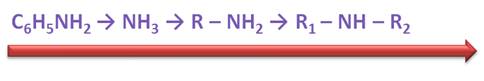
Анилин – это ароматический амин. Его называют так, потому что аминогруппа у него связана непосредственно с атомом углерода бензольного кольца.
Анилин, или фениламин, имеет формулу С 6 H 5 NH 2 .
Он представляет собой бесцветную маслянистую жидкость с характерным запахом, мало растворим в воде, но хорошо растворяется в этаноле и бензоле. (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Изучение физических свойств анилина.mp4
Свойства аминогруппы: Рассмотрим химические свойства анилина. Он реагирует с кислотами. Так, в реакции анилина с соляной кислотой образуется хлорид фениламмония.
Реакция анилина с соляной кислотой.mp4
Эта реакция подтверждает тот факт, что аммиак и амины – основания, причём амины более сильные основания.
Однако анилин – более слабое основание, чем алифатические амины. Это объясняется наличием в его молекуле бензольного кольца, которое оказывает влияние на неподелённую пару электронов атома азота. Электронная пара электронов атома азота также взаимодействует с электронным облаком бензольного кольца, что приводит к ослаблению основных свойств.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Раствор анилина, изучение среды.mp4
Таким образом, основные свойства у аммиака выражены сильнее, чем у анилина; у первичных аминов осно вные свойства выражены сильнее, чем у аммиака, а наиболее выраженными основными свойствами обладают вторичные амины.
Для анилина характерна реакция горения, при этом образуется оксид углерода (IV), азот и вода.
4C6H 5 NH 2 + 31O 2 → 24CO 2 ↑ + 2N 2 ↑ + 14H 2 O
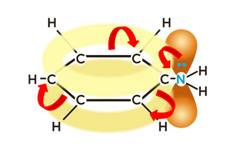
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
Для анилина характерны свойства бензольного кольца – действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях:
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
Бромирование анилина.mp4
Для анилина характерны реакции галогенирования. Так, в реакции анилина с бромной водой образуется белый осадок 2,4,6-триброманилина.
C 6 H 5 NH 2 + 3Br 2 → C 6 H 2 NH 2 Br 3 ↓ + 3HBr
Эту реакцию используют для обнаружения анилина. Эта реакция подтверждает влияние аминогруппы на бензольное кольцо. Аминогруппа активирует бензольное кольцо, поэтому реакция бромирования анилина идёт легче, чем в бензоле.
Окисление анилина раствором дихромата калия.mp4
Окисление анилина раствором хлорной извести.mp4
В реакции анилина с хлорангидридом уксусной кислоты получают ацетанилид, который использовали как первое синтетическое жаропонижающее средство.
В реакции анилина с серной кислотой образуется вещество, которое называют ещё сульфаниловой кислотой, это вещество используют как промежуточное вещество в синтезе лекарственных средств и красителей.
С древних времён люди использовали природный краситель синего цвета – индиго. Из-за того, что этот краситель стоил очень дорого, учёные давно пытались его синтезировать.
Адольф Байер − немецкий химик, профессор Страсбургского и Мюнхенского университетов. Ему принадлежат замечательные синтезы органических соединений, в том числе синтез индиго − важнейшего природного красителя. Исследовал реакции конденсации. Изучал многие классы органических соединений. Лауреат Нобелевской премии
В 1840 году Фрицше обнаружил, что при нагревании со щёлочью синяя окраска индиго исчезает и образуется вязкая масса. Очистив это вещество, Фрицше получил жидкость с характерным запахом и назвал её анилином (от арабского an-nil «синий»).
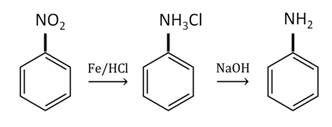
В 1841 г русский химик Зинин открыл способ восстановления нитробензола до ароматического амина – бензамида.
Николай Николаевич Зинин − выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества.
Анилин в лаборатории получают восстановлением нитробензола железом в присутствии соляной кислоты.
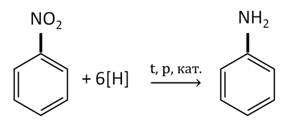
В промышленности анилин получают по реакции Зинина, то есть восстановлением нитробензола. Эта реакции идёт под давлением в присутствии катализаторов.
Анилин находит широкое применение. Его используют для синтеза красителей, лекарств и взрывчатых веществ. Таким образом, представителем ароматических аминов является анилин. Свойства анилина обусловлены наличием аминогруппы и бензольного кольца. Анилин реагирует с кислотами, вступает в реакцию с бромной водой. Получают анилин в промышленности по реакции Зинина. Анилин используют в производстве красителей, лекарств и взрывчатых веществ.
http://paramitacenter.ru/node/444
http://www.sites.google.com/site/foreverhimia/uroki-himii/uroki-himii-v-10-klasse-1/uroki-himii-v-10-klasse—3-cetvert/anilin