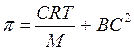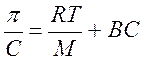Высокомолекулярные соединения
Классификация ВМС
1) по пространственной структуре:
линейные – целлюлоза, белки;
разветвленные – крахмал, гликоген;
сетчатые (пространственные) – резина, эбонит, фенолформальдегидные смолы. Из них жесткие – с большим числом поперечных связей – эбонит, мягкие – с небольшим – резина.
2) по природе: неорганические (силикаты) и органические (целлюлоза, белки, крахмал, гликоген);
гомоцепные (в макромолекуле одинаковые мономеры). Пример: полиэтилен, целлюлоза, крахмал, гликоген.
гетероцепные (в макромолекуле разные мономеры). Пример: сополимер стирола с α-метилстиролом, белки. Известны регулярные и нерегулярные сополимеры.
4) По способности к электролитической диссоциации ВМС делятся на неэлектролиты и полиэлектролиты. В свою очередь полиэлектролиты подразделяют на поликислоты, полиоснования и полиамфолиты (белки).
5) По происхождению: природные вещества (биополимеры), такие как, полисахариды, белки, нуклеиновые кислоты, каучук, шелк и т.д.; и синтетические вещества (полимеры), полученные реакциями поликонденсации, или полимеризации: синтетические каучуки, резины, пластические массы, искусственные волокна и т. д.
10. Особенности растворения ВМС как следствие их структуры. Механизм набухания и растворения ВМС.
Свойства ВМС зависят не только от состава структурных звеньев макромолекул, но и от их взаимного расположения, т.е. конфигурации. Между макромолекулами возникают водородные, диполь-дипольные и ван-дер-ваальсовые связи – образуются сложные комбинации макромолекул – надмолекулярные структуры. В растворе макромолекулы в результате теплового движения меняют взаимное расположение структурных звеньев, т.е. принимают различные конформации. Предельные конформации представляют собой либо вытянутую цепь, либо глобулу (плотный клубок).
Набухание – процесс увеличения объема и массы ВМС в результате поглощения высокомолекулярным соединением низкомолекулярной жидкости (НМС). Следует подчеркнуть, что набухание – это не простое механическое вхождение молекул НМС в пустоты полимера, а межмолекулярное взаимодействие, обусловленное, главным образом, сольватацией макромолекул. Молекулы ВМС отличаются от молекул НМС на несколько порядков по размерам и по подвижности. Поэтому переход макромолекул в фазу растворителя происходит очень медленно, в то время как молекулы растворителя быстро проникают в сетку полимера, раздвигая цепи и увеличивая его объем. Гибкость цепей облегчает проникновение малых молекул НМС в сетку полимера.
Степень набухания α – количественная характеристика способности полимера к набуханию:
αm = 

где mo и m – масса образца полимера до и после набухания;
V0 и V— объем образца полимера до и после набухания.
Стадии набухания
1. Исходная система – НМС и ВМС. Молекулы НМС при набухании проникают между молекулами ВМС.
2. Сольватация – межмолекулярное взаимодействие – теплота выделяется, объем полимера увеличивается, наблюдается контракция (уменьшение общего объема).
3. Полимерная сетка разрыхляется, макромолекулы теряют связь с образцом и переходят в раствор. Основное увеличение объема и массы полимера (теплота не выделяется, контракция отсутствует).
4. Выход некоторого числа макромолекул в раствор НМС.
5. Растворение полимера.
На стадии 3 или 4 завершается ограниченное набухание.
Возникающее давление набухания достигает больших величин (десятки атмосфер) и становится причиной разрыва емкостей, заполненных набухающими материалами. Может разорваться стальной корпус судна при набухании ВМС (горох, зерно и др.) при контакте с водой.
Процесс набухания всегда специфичен: полимер набухает в растворителе, с которым он взаимодействует. Так, полярные полимеры набухают в полярных жидкостях, например, белки в воде, а неполярные — в неполярных (каучук в бензоле). Набухание – физико-химический процесс.
11. Зависимость величины набухания от различных факторов.
Величина набухания ВМС зависит от:
– природы ВМС. У жестких полимеров (с большим числом поперечных связей между цепями) степень набухания невелика – ограниченное набухание. При уменьшении числа поперечных связей набухание неограниченное. Оно плавно переходит в растворение. На рис. 6 зависимость набухания в бензоле от жесткости полимерных цепей.
– природы растворителя. Полярные полимеры набухают в полярных жидкостях (белок в воде), неполярные – в неполярных (каучук в бензоле).
– температуры. Повышение температуры ускоряет набухание, но уменьшает степень набухания. Ограниченное набухание желатина в холодной воде сменяется неограниченным в горячей.
– давления. Увеличение внешнего давления вызывает увеличение степени набухания.
– присутствия посторонних веществ, особенно электролитов. Возрастание жесткости кислоты или основания подавляет набухание.
– рН среды. Влияние рН среды на набухание особенно значительно для амфотерных полиэлектролитов (к ним относятся важнейшие биополимеры — белки и нуклеиновые кислоты). Степень набухания белка минимальна в изоэлектрической точке.
– формы и степени измельченности образца.
 | Рис. 3. Зависимость набухания (a) в бензоле полимерных цепей различной жесткости от времени. 1 – неограниченное растворение (натуральный каучук); 2 – ограниченное растворение (резина); 3 – практически не растворяется (эбонит). |
12. Аномальная вязкость растворов ВМС.
Растворы ВМС не подчиняются законам Ньютона, Пуазейля, Эйнштейна.
Уравнение Штаудингера связывает молекулярную массу и характеристическая вязкость:
ηхар. = КМ α , где η (эта) – коэффициент вязкости, характеристическую вязкость;
К – коэффициент пропорциональности, определяется экспериментально;
М – молекулярная масса ВМС;
α – показатель степени, ½ ≤ α ≤ 1. α зависит от формы макромолекул, определяется экспериментально. ½ – гибкие (глобулы), 1 – жесткие (палочки).
Для измерения вязкости растворов ВМС можно использовать методы капиллярного истечения жидкости (с помощью вискозиметра), падающего шарика (метод Стокса) и вращающихся цилиндров.
1. Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики
| Название | 1. Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики |
| Анкор | gotovoe_1.docx |
| Дата | 28.01.2017 |
| Размер | 29.04 Mb. |
| Формат файла |  |
| Имя файла | gotovoe_1.docx |
| Тип | Документы #198 |
| страница | 9 из 9 |
| Подборка по базе: Методическая разработка урока по предмету кубановедение на тему_, Лекции по предмету.docx, Практические задания — методы принятия управленческих решений.do, ЛЕКЦИЯ Тема ПРЕДМЕТ, МЕТОД,, ИСТОЧНИКИ ТРУДОВОГО ПРАВА.docx, РП_Математические методы.doc, Ненаучные методы исследования.pdf, математические методы в психологии.doc, Диссертация на тему кишечнополостные; рекурсивные гены кишечнопо, Контрольная работа по предмету Финансовый учет.docx, Пр. методы принят. упр. реш. З О П с.docx Французкий химик Мишин предложил пазличать еще один вид устойчивости дисперсных систем – конденсационную. Конденсационная устойчивость характеризует способность дисперсных систем сохранять неизменной с течением времени удельную поверхность. Факторы устойчивости лиозолей:
61.Коагуляция. Порог коагуляции и его определение, правило Шульце-Гарди, явление привыкания. Взаимная коагуляция. Понятие о современных теориях коагуляции. Биологическое значение коагуляции. Коллоидная защита и пептизация. 62.Коллоидные ПАВ; биологически важные коллоидные ПАВ (мыла, детергенты, желчные кислоты). Мицеллообразование в растворах ПАВ. Определение критической концентрации мицеллообразования. Липосомы. Все поверхностно-активные вещества можно разделить на два класса — истинно растворимые и коллоидные. Истинно ра створимые ПАВ — дифильные органические соединения с небольшими углеводородными радикалами: низшие спирты, карбоновые кислоты и их соли, амины, фенолы. Коллоидные ПАВ — длинноцепочечные дифильные органические соединения с числом атомов углерода в р адикале о т 10 до 20. По способности к диссоциации в воде ко ллоидные ПАВ подразделяю т на ионогенные и неионогенные. В свою очередь ио ногенные ПАВ делятся на анио нные, катионные и амфо литные. Анионные — диссоциир уют с образованием повер хностно -активного анио на; это соли высших карбоновых кисло т (мыла), например, олеат натрия C17H33COONa; соли алкилс ерных кис лот CnH2n+1OSO3M, где n = 10 – 20, M = K, Na, например, додецилс ульфат натрия C12H25OSO3Na; соли алкиларил- сульфоновых кисло т CnH2n+1C6H4SO3M, где n = 8 – 22, M = K, Na, например, п-октилбензолсульфонат натрия C8H17C6H4SO3Na и ряд других. Катионные — диссоциир уют в воде с образованием повер хностно — активного катиона; это соли первичных, вторичных и третичных алифатических и ароматических аминов, например, октадециламмоний хлорид [C18H37NH3]+Cl–; соли алкилзамещенных аммониевых оснований, например, цетилпир идиний хлорид . Амфолитные — содержат две функциональные группы — одну кис лотного, другую основного хар актер а, например, карбоксильную и аминогруппу. В зависимости от pH среды амфолитные ПАВ обладают анионактивными или катионактивными свойствами. Неионогенные — не диссоциир уют в воде на ионы, например, оксиэтилиро — ванные спирты, амины, фено лы, аминоспир ты. Их по лучают присоединением оксида этилена к соответствующим исходным веществам по реакции: М и ц е л л о о б р а з о в а н и е в р а с т в о р а х к о л л о и д н ы х П А В Коллоидные ПАВ обладают невысокой истинной растворимостью. Растворы, в которых они молекулярно диспергированы, могут иметь максимальную концентрацию от 10–6 до 10–3 моль/л. Это следствие наличия у молекул ПАВ длинных углеводородных радикалов. 83 Малая растворимость ПАВ влечет за собой ассоциацию их молекул, с ростом концентрации переходящую в мицеллообразование. Концентрация раствора ПАВ, при которой начинают образовываться мицеллы, называется критической концентрацией мицеллообразования (ККМ). Изотермы поверхностного натяжения коллидных ПАВ отличаются от изотерм истинно растворимых ПАВ более резким понижением поверхностного натяжения с увеличением концентрации и наличием излома на изотерме (рис. 7.1). Концентрация в точке из лома соответствует критической концентрации мицеллообразования, выше которой в растворе самопроизвольно протекает процесс образования мицелл и истинный раствор переходит в ультрамикрогетерогенную систему — золь. Механизм термодинамики мицелообразования При дальнейшем росте концентраций ПАВ (выше ККМ) количество необъединенных в мицеллы мо лекул или ионов ПАВ в поверхностном слое остается постоянным, но увеличивается количество мицелл. Движущей силой образования мицелл являются гидрофобные взаимодействия. Энтальпия взаимодействий углеводородных радикалов ПАВ друг с другом меньше энтальпии взаимодействия их с водой. Для системы термодинамически выгоднее состояние с минимумом энтальпии, поэтому радикалы выталкиваются из водной среды в ядра мицелл, чтобы избежать, насколько это возможно, контакта с водой. В результате этого энтальпия уменьшается. Когда молекулы или ионы ПАВ находятся в неассоциированном состоянии, вокруг их углеводородных радикалов из молекул воды образуются льдоподобные упорядоченные структуры. Переход радикалов ПАВ из воды в мицеллы разупорядочивает структуру воды, вследствие чего повышается энтропия системы. Уменьшение энтальпии и увеличение энтропии приводит к снижению энергии Гиббса системы: G = H – TS Методы определения критической концентрации мицеллообразования Значение ККМ уменьшается с ростом длины углеводородного радикала ПАВ, так как при этом уменьшается истинная растворимость ПАВ. Введение электролитов снижает ККМ ионогенных ПАВ из-за уменьшения гидратируемости (а, следовательно, и ухудшения растворимости) полярных частей молекул ПАВ и слабо влияет на ККМ неионогенных ПАВ. Добавление в раствор органических полярных растворителей увеличивает ККМ вследствие усиления растворяющей способности среды. Все эти закономерности установлены на основании экспериментального определения ККМ коллоидных ПАВ. Возникновение мицелл в растворе ПАВ сопровождается резким экспериментально фиксируемым изменением физико-химических свойств системы, которое в большинстве случаев выражается в появлении характерных изломов на кривых зависимости физико-химических параметров от концентрации ПАВ (рис. 7.7). Более четко точка излома выявляется на кривых зависимости свойств ПАВ от концентрации в координатах «свойство – lg c«. Наиболее распространенными методами определения ККМ являются кондуктометрический и сталагмометрический.* Кондуктометрический метод определения ККМ применяется для ионогенных ПАВ. Он основан на концентрационной зависимости эквивалентной электропроводности растворов этих ПАВ. При концентрациях, соответствующих ККМ, на графике зависимости эквивалентной электропроводности наблюдается излом, так как при этих концентрациях начинают формироваться ионные мицеллы, окруженные диффузным слоем противоионов. Подвижность ионов при этом снижается и электропроводность с увеличением концентрации ПАВ уменьшается резче, чем до критической концентрации мицеллообразования (рис. 7.7, ). В сталагмометрическом методе определения ККМ измеряется поверхностное натяжение водных растворов ПАВ, которое резко уменьшается с ростом концентрации вплоть до ККМ, а затем остается практически постоянным (рис. 7.7., ). Этот метод применим для ионогенных и для неиногенных коллоидных ПАВ 63. Высокомолекулярные вещества (ВМВ). Классификация. Структура. Форма макромолекул и типы связей между ними. Гибкость макромолекул. Высокомолекулярные соединения (ВМС) получили свое название из-за очень большой относительной молекулярной массы (не менее 10000–15000). Если относительная молекулярная масса обычных низкомолекулярных веществ редко достигает нескольких сотен, например, воды – 18; диоксида углерода – 44; глюкозы – 180, то молекулярная масса натурального каучука (ВМС) находится в пределах от 7 10 4 до 2,5 10 6 . Молекулы ВМС из-за их большой молекулярной массы называют обычно макромолекулами. Высокомолекулярные соединения из-за их большой молекулярной массы нелетучи и не способны перегоняться, весьма чувствительны к воздействию внешних факторов. Макромолекулы легко распадаются под воздействием самых незначительных количеств кислорода и других деструктирующих агентов. Большинство ВМС при повышении температуры размягчаются постепенно и не имеют определенной температуры плавления. Температура разложения этих веществ ниже температуры кипения, т. е. ВМС могут находиться только в конденсированном состоянии. Свойства ВМС зависят не только от размера, но и от формы молекул. Так, ВМС с изодиаметрическими молекулами (гемоглобин, гликоген) – порошкообразные вещества, при растворении почти не набухают, а растворы их не обладают высокой вязкостью. ВМС с сильно асимметричными вытянутыми молекулами (желатин, целлюлоза, каучук) при растворении очень сильно набухают и образуют высоковязкие растворы. ВМС с линейными молекулами обладают волокнистой структурой, обусловливающей анизотропию свойств и высокую механическую прочность, поэтому они образуют волокна и пленки. Некоторые полимеры высокоэластичны. Природные и синтетические ВМС. К наиболее важным природным ВМС относятся белки, являющиеся главной составной частью всех веществ животного и растительного происхождения. Молекулы белков построены из различных аминокислот, содержащих ионогенные группы (СООН, NH3OH) и соединенных пептидными связями. Молекулярная масса различных белков колеблется в широких пределах и достигает нескольких миллионов. Белки используются в основном для пищевых целей. Однако ряд содержащих белки веществ (кожа, шерсть, шелк) находят и техническое применение. Природными ВМС являются и полисахариды – крахмал, целлюлоза. Целлюлоза – составная часть тканей растений. Наибольшее содержание целлюлозы (96–98 %) в хлопке. Молекулы целлюлозы имеют линейное строение и составлены из остатков глюкозы. Молекулярная масса колеблется от 500 тыс. до миллионов. Крахмал – составная часть всех злаков и картофеля. Макромолекулы крахмала состоят из звеньев глюкозы, и он является не индивидуальным веществом, а смесью полисахаридов, отличающихся размерами молекул и строением. Путем гидролиза из крахмала получают декстрин, патоку и глюкозу. К природным ВМС относится и натуральный каучук – материал, обладающий высокой эластичностью. Его добывают из млечного сока (латекса) некоторых растений – каучуконосов. Это углеводород, состоящий из изопентеновых (изопреновых) остатков. При нагревании с серой каучук подвергается вулканизации, образуя резину, эбонит. Помимо природных ВМС в технике и быту применяют синтетические ВМС. К ним относятся синтетические каучуки и различные синтетические полимеры. Эти продукты чрезвычайно разнообразны по химическому составу и свойствам, они являются заменителями природных ВМС, их используют для получения пластмасс, синтетических тканей и др. Производство синтетических ВМС значительно превысило производство конструкционных материалов (алюминиевых и магниевых сплавов и др.). К достоинствам синтетических ВМС относится то, что их можно получить с заранее заданными свойствами, подбирая необходимые исходные материалы и регулируя технологический процесс. Строение макромолекул и структура ВМС. Молекулы ВМС могут быть линейными и разветвленными. Именно линейной формой макромолекул определяются типичные свойства полимеров: эластичность, способность образовывать нити и пленки высокой прочности, набухать, давать при растворении вязкие растворы и т. д. Эти типичные для полимеров свойства определяются гибкостью их линейных молекул, способностью к колебательно-вращательному движению отдельных звеньев макромолекул вокруг соединяющих их отдельных связей. Благодаря вращению отдельных звеньев, макромолекула изгибается и может принимать различные конформации. Конформации – формы молекул, переходящие друг в друга без разрыва химической связи за счет свободного поворота звеньев. Гибкость макромолекул – одна из важнейших характеристик полимера, определяющая его основные макроскопические свойства. Гибкость макромолекул − это способность полимерных цепей изменять свою конформацию в результате внутримолекулярного теплового движения звеньев (термодинамическая гибкость) или же под действием внешних механических сил (кинетическая гибкость). Гибкость макромолекул обусловлена тем, что мономерные звенья цепи при тепловом движении или при внешних силовых воздействиях вращаются вокруг одинарных (s-) связей. 64.Свойства растворов ВМС. Особенности растворения ВМС как следствие их структуры. Форма макромолекул. Механизм набухания и растворения ВМС. Зависимости величины набухания от различных факторов. 65.Аномальная вязкость растворов ВМС. Уравнение Штаудингера. Вязкость крови и других биологических жидкостей.
67. Мембранное равновесие Доннана. Онкотическое давление плазмы и сыворотки крови, его биологическая роль. 68. Устойчивость р-ров биополимеров. Высаливание биополимеров из р-ра. Коацервация, ее роль. Застуневание. Св-ва студней: синерезис, тиксотропия. Примеры. Вязкость растворов ВМС. Осмотическое давление растворов ВМС. Уравнение Штаудингера и Галлера.
|