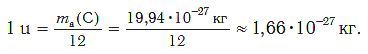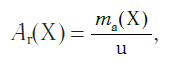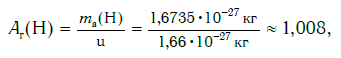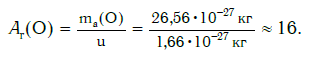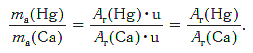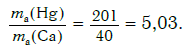Основные понятия и законы химии
Химия – это наука, которая сопутствует нам, где бы мы не находились: дома, в офисе, на природе или в городе. Трудно переоценить ее вклад в нашу жизнь, необходимость понимания и знания основных понятий и законов химии.
Итак, какие же основные понятия и законы включает химия? Сначала дадим определение науке: Химия — наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении.
Основные понятия химии
Основными в химии являются такие понятия, как атом, молекула, элемент, вещество, аллотропия и др.
У истока основных понятий химии стоит атомно-молекулярное учение, которое дает определение молекулы и атома:
Молекула
Это наименьшая частица определенного вещества, которая обладает его химическими свойствами. Состав и химическое строение молекулы определяют ее химические свойства. Все вещества состоят из молекул, а молекулы из атомов.
Атом
Это наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ, это электронейтральная частица, которая состоит из положительно заряженного ядра атома и отрицательно заряженных электронов, вращающихся вокруг ядра.
Молекулы и атомы находятся в постоянном движении.
Химический элемент
В настоящее время известно 118 элементов, 89 из которых найдены в природе, остальные получены искусственно (см. Интересные факты о химических элементах). Что же такое Химический элемент? Это такой вид атомов, который имеет определенный заряд ядра и строение электронных оболочек.
Теперь рассмотрим строение атомного ядра и следующее основное понятие химии.
Атомное ядро
Атомное ядро состоит из протонов (Z) и нейтронов (N), имеет положительный заряд, равный по величине количеству протонов (или электронов в нейтральном атоме) и совпадает с порядковым номером элемента в периодической таблице. Суммарная масса протонов и нейтронов атомного ядра называется массовым числом A = Z + N. Существуют химические элементы (изотопы), имеющие одинаковый заряд ядер, но при этом различные массовые числами, что достигается за счет разного числа нейтронов в ядре.
Вещество
Некая совокупность атомов и молекул, их ассоциатов и агрегатов, которые могут находиться в любом из трех агрегатных состояний, образуют вещество.
Простые вещества состоят из атомов одного вида, а сложные вещества (химические соединения) состоят из атомов разного вида и образуются при химическом взаимодействии атомов разных химических элементов.
Аллотропия
Встречается явление, при котором один химический элемент может образовывать нескольких простых веществ, различных по свойствам и строению. Это явление называется Аллотропией. Аллотропные модификации характерны, например, для кислорода (O2 и O3), фосфора (белый, красный, черный фосфор), углерода (алмаз, графит), серы (моноклинная, ромбическая, пластическая), олова (белое, серое, ромбическое олово).
Химическая формула
В 1814 г Й. Берцелиус предложил использовать химическую формулу — запись состава веществ с помощью химических знаков и индексов.
Химическое вещество характеризуется атомной массой, а молекулы — молекулярной массой.
Относительная атомная масса (Ar)
Это отношение средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1 /12 массы атома 12 C.
Относительная молекулярная масса (Mr)
Это величина, показывающая, во сколько раз масса молекулы данного вещества больше 1 /12 массы атома углерода 12 C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов.
Моль вещества (n)
Это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12 C.
Число структурных единиц, содержащихся в 1 моле вещества равно 6,02 • 10 23 .Эточисло называется числом Авогадро (NA)
Молярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества.
Химический эквивалент
Для более удобного сравнения способности различных элементов к соединению введено понятие химического эквивалента. Это одно из важнейших понятий химии, дадим ему определение:
Химическим эквивалентом вещества (Э) называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Масса 1 эквивалента вещества называется эквивалентной массой (mэкв). Масса одного моля эквивалента элемента — это молярная масса эквивалента MЭ(X).
Молярную массу эквивалента химического элемента, простых и сложных веществ (Mэкв(X)) рассчитывают по формуле:
где M(X) – молярная масса; вал – суммарная валентность.
Например, молярная масса эквивалента алюминия составляет Mэкв(Са) = 40/2 = 20 г/моль.
Молярные массы эквивалента кислорода и водорода постоянны и составляют:
Эквивалентную массу соединения можно определить по его химической формуле, например,
М экв(оксида) = М(оксида)/(число атомов кислорода ∙ 2);
М экв(основания) = М(основания)/число гидроксильных групп;
М экв(кислоты) = М(кислоты)/число протонов;
М экв(соли) = М(соли)/(число атомов металла ∙ валентность металла).
Пример, определим эквивалент (Э) и эквивалентную массу Мэкв (Х) фосфора, серы и брома в соединениях PHз, Н2S и HBr.
В PHз 1 моль атомов водорода соединяется с 1/3 моль фосфора, поэтому эквивалент фосфора равен Э(N) = 1/3 моль
В Н2S 1 моль атомов водорода соединяется с 1/2 моль серы, поэтому эквивалент серы равен Э(S) = 1/2 моль
В HBr 1 моль атомов водорода соединяется с 1 моль брома, поэтому эквивалент брома равен Э(Br) = 1 моль.
Найдем эквивалентные массы:
Мэкв (Р) = 31/3 = 10,33 г/моль;
Мэкв (S) = 32/2 = 16 г/моль;
Мэкв (Br) = 80/1 = 80 г/моль.
Аналогично можно дать определение понятию эквивалентный объем.
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль.
Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен.
Определить молярную массу эквивалента (эквивалентную массу) можно исходя из закона эквивалентов, который рассмотрен немного ниже.
Основные законы химии
Нижеперечисленные законы принято считать основными законами химии.
Закон эквивалентов
По закону эквивалентов химические элементы соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов:
где m1 и m2 — массы реагирующих или образующихся веществ, М экв1 и М экв2 — эквивалентные массы этих веществ.
Примеры расчета молярной массы эквивалента представлен в задачах 5-7 раздела Задачи к разделу Основные понятия и законы химии
Закон сохранения вещества
В 1756 г. М.В. Ломоносов, после длительных испытаний, пришел к важному открытию: вес всех веществ, вступающих в химическую реакцию, равен весу всех продуктов реакции.
Этот закон отражается в законе сохранения массы, который заключается в следующем: масса веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Вещества не исчезают и не возникают из ничего, а происходит химическое превращение. Закон является основой при составлении химических реакций и количественных расчетов в химии.
Закон постоянства состава
В 1808 Ж. Пруст сформулировал закон, который гласит, что независимо от способа получения все индивидуальные вещества имеют постоянный количественный и качественный состав.
Закон кратных отношений
В 1803 г Д. Дальтон открыл закон, заключающийся в том, что если два химических элемента образуют несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
Закон объемных отношений
В 1808 г Гей-Люссак сформулировал закон, который гласил:
«Объемы газов, вступающих в химические реакции, и объемы газов, являющихся продуктами реакции, соотносятся между собой как небольшие целые числа».
Газовые законы
Важную роль в развитии химической науки сыграли газовые законы (справедливы только для газов).
В 1811 г. Авогадро ди Кваренья (Закон Авогадро) доказал, что- в равных объемах любых газов при постоянных условиях (температуре и давлении) содержится одинаковое число молекул. В одинаковых условиях одно и то же число молекул занимают равные объемы, а 1 моль любого при T=273°К и p=101,3 кПа газа занимает объем 22,4 л, который называется молярным объемом газа (Vm).
Независимо друг от друг трое ученых вывели следующие законы:
закон Бойля-Мариотта при Т= const: P1V1 = P2V2;
закон Шарля при V = const:P1 / T1 = P2 / T2
При объединении этих трех законов получаем:
Если условия отличаются от нормальных, то применяют уравнение Клапейрона – Менделеева:
pV = nRT = (m/M)RT, где
p — давление газа, V — его объем, n — количество молей газа, R — универсальная газовая постоянная (8,314 Дж/(моль*К).
Количество газа при нормальных условиях рассчитывают по формуле:
Плотность газов при заданных давлении и температуре прямо пропорциональна их молярной массе:
ρ = m/V = pM/(RT) = (p/RT)M.
Относительная плотность газов показывает, во сколько раз один газ тяжелее другого. Плотность газа В по газу А определяется следующим образом:
Это основные законы химии. В заключение приведем Закон парциальных давлений (закон Дальтона). Парциальное давление в смеси равно тому давлению газа, которым он обладал бы, если бы занимал такой же объем, какой занимает вся смесь при той же температуре. При условии, что в газовой смеси нет химического взаимодействия, общее давление газовой смеси равно сумме парциальных давлений газов, входящих в эту смесь:
Состав газовых смесей может выражаться количеством вещества (n), массовыми (ωn), объемными (φn) и молярными (χ) долями:
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
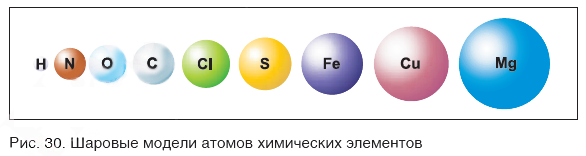
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
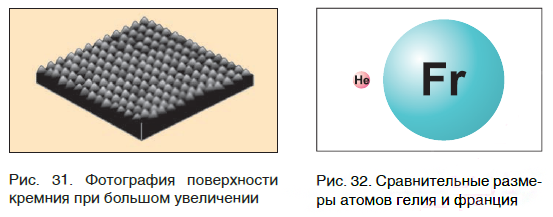
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u .
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Основные понятия и законы химии
Содержание:
Химия – одна из важнейших и обширных областей естествознания.
Химия – наука о веществах, их свойствах, строении и взаимных превращениях.
Предмет химии – химические элементы и их соединения, а также закономерности, которым подчиняются различные химические реакции.
Химические реакции – это процессы образования из простых по составу веществ более сложных, переход одних сложных веществ в другие и разложение сложных веществ на более простые вещества. Химия изучает и описывает эти процессы как в макромасштабе, на уровне макроколичеств веществ, так и в микромасштабе, на атомно-молекулярном уровне. Внешние проявления химических процессов, протекающих в макромасштабе, нельзя непосредственно перенести на микроуровень взаимодействия веществ и однозначно их интерпретировать, однако такие переходы возможны при правильном использовании специальных химических законов, присущих только микрообласти (атомам, молекулам, ионам, взятым в единичных количествах). Все это способствует развитию наших представлений о природе, поскольку научная истина всегда относительна и лишь все более может приближаться к бесконечной в познании абсолютной истине. Предмет химии неисчерпаем, как неисчерпаема природа в своих проявлениях.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Предмет и задачи химии
Химия относится к естественным наукам. Она изучает состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
Определение химии как науки впервые дал М. В. Ломоносов: «Химическая наука рассматривает свойства и изменения тел. состав тел. объясняет причину того, что с веществами при химических превращениях происходит». Как видим, понимание задач химии Ломоносовым близко к современному.
Оригинальное и наиболее точное определение химии дал Д. И. Менделеев в 1871 г. в своих знаменитых «Основах химии», предназначенных «для лиц, начинающих изучение этого предмета». По Менделееву, химия — это учение об элементах и их соединениях.
Химия тесно связана с физикой. «И эти две науки,— писал Ломоносов,— так соединены между собой, что одна без другой в совершенстве быть не могут». Химия соприкасается также с другими естественными науками и особенно с геологией и биологией. На границе между химией и геологией возникла наука геохимия, изучающая распространенность и миграцию химических элементов в различных системах Земли. Между химией и биологией сформировались науки — биохимия, бионеорганическая и биоорганическая химия,— изучающие химические процессы в живых организмах. Космохимия изучает состав космических тел и миграцию элементов во Вселенной.
Веществ очень много: в настоящее время известно более 4 млн. органических и свыше 100 тыс. неорганических. Для облегчения изучения их классифицируют по различным признакам. Так, все известные вещества можно разделить на три группы: простые, сложные и смеси. Существуют многие другие классификации веществ.
Важнейшая задача химии — получение веществ с заранее заданными свойствами и интенсификация промышленных производств, создание безотходных технологий. Не менее важная задача ее — использование энергии химических превращений.
Химию, изучаемую в средней общеобразовательной школе и в средних специальных учебных заведениях, можно разделить на три большие части: общую, неорганическую и органическую химию. Общая химия рассматривает основные закономерности, относящиеся ко всем химическим превращениям. Неорганическая химия изучает свойства и превращения неорганических (минеральных) веществ. Органическая химия изучает свойства и превращения органических веществ.
Значение химии
Химию можно назвать индустрией чудесных превращений. Она позволяет синтезировать материалы, которых нет в природе, использовать их для создания всевозможных машин и приборов, для строительства жилищ и производства товаров народного потребления.
Химическая промышленность выпускает синтетический каучук, пластические массы, искусственное волокно, искусственное топливо, красители, лекарственные вещества и многое другое.
В больших количествах производятся продукты основной химической промышленности — кислоты, щелочи, соли.
В сельском хозяйстве широко применяются минеральные удобрения, химические средства защиты растений и регуляторы их роста, химические добавки в корма животных и консерванты кормов, многие полимерные материалы.
С использованием химических методов получают металлы, являющиеся основой индустриализации страны, а также осуществляют их защиту от коррозии.
Возможности химии неисчерпаемы. Только из нефти можно получить свыше 20 тыс. органических веществ, а из каменного угля — еще больше. Безгранично ее применение для производства широкого и разнообразного ассортимента товаров народного потребления. В наше время химическая промышленность выпускает продукцию более 50 тыс. наименований.
Значение химии в развитии научно-технического прогресса ярко подчеркнуто первым космонавтом мира Ю. А. Гагариным: «Мы, космонавты, по характеру нашей профессии, может быть, раньше, чем кто-либо, сталкиваемся с химией во всех ее чудодейственных проявлениях. Возьмите, к примеру, топливо, которое двигает наши ракеты, сплавы и металлы, из которых они сделаны, возьмите скафандры, всю особую космическую продукцию — тысячи и тысячи больших и малых вещей, окружающих человека в его пути в космос. Всюду вы встретитесь с химией. На повестку дня освоения космического пространства становятся задачи более грандиозные, чем те, которые мы выполняли до сих пор. На повестку дня становится задача полетов к Луне, к другим планетам нашей Солнечной системы, выход за пределы Солнечной системы, установление связи с другими мирами. Но для этого нужны новые скорости, новые космические корабли, нужно новое оборудование, топливо и для создания всего этого опять-таки нужны химия и новые материалы, которые по своим качествам были бы выше, чем те, которые мы в настоящее время имеем. Все эти задачи ставятся перед химией, и мы уверены, что она обеспечит нас всем необходимым. » («Комсомольская правда» от 16 января 1964 г.)
В последнее время одной из важнейших задач, стоящих перед человечеством, стала охрана окружающей среды. В решении таких вопросов, как очистка сточных вод, контроль чистоты вод и атмосферы, создание безотходных производств и т. д., большая роль принадлежит химической науке и промышленности.
Исключительно велико значение химии в научном понимании картины мира. Химия подтвердила общие законы развития природы, общества и познания (см. §2.11).
Глубокое знание химии совершенно необходимо специалистам всех отраслей народного хозяйства. Химия наряду с физикой и математикой составляет основу профессиональной подготовки специалистов высокой квалификации.
Основные понятия и законы химии
Химия – это наука, которая сопутствует нам, где бы мы не находились: дома, в офисе, на природе или в городе. Трудно переоценить ее вклад в нашу жизнь, необходимость понимания и знания основных понятий и законов химии.
Атомно-молекулярное учение в химии
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М. В. Ломоносов. Основные положения этого учения изложены в работе «Элементы математической химии» (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям.
- 1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
- 2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
- 3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
- 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Через 67 лет после Ломоносова атомистическое учение в химии применил английский ученый Джон Дальтон. Он изложил основные положения атомистики в книге «Новая система химической философии» (1808). В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Следует отметить, что отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии.
Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX в. На международном съезде химиков в г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом н химическим строением.
Атом — это наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям:
атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов.
Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Например, органические вещества, неметаллы (за небольшим исключением), оксид углерода (IV), вода. Большинство же твердых неорганических веществ не имеет молекулярной структуры: их решетка состоит не из молекул, а из других частиц (ионов, атомов); они существуют в виде макротел (кристалл хлорида натрия, друза кварца, кусок меди и др.). Не имеют молекулярной структуры соли, оксиды металлов, алмаз, кремний, металлы.
Химическая связь между молекулами у вещества с молекулярной структурой менее прочная, чем между атомами, поэтому их температуры плавления и кипения сравнительно низкие. У веществ с немолекулярной структурой химическая связь между частицами весьма прочная, поэтому их температуры плавления и кипения высокие. Современная химия изучает свойства микрочастиц (атомов, молекул, ионов и др.) и макротел.
Химические элементы
Атомно-молекулярное учение позволило объяснить основные понятия и законы химии.
С точки зрения атомно-молекулярного учения химическим элементом называется каждый отдельный вид атомов. Важнейшей характеристикой атома является положительный заряд его ядра, численно равный порядковому номеру элемента (см. § 2.4). Значение заряда ядра служит отличительным признаком для различных видов атомов, что позволяет дать более полное определение понятия элемента:
химичесхий элемент — это определенный вид атомов с одинаковым положительным зарядом ядра.
Известно 107 элементов. В честь автора периодического закона Д. И. Менделеева 101-й химический элемент назван менделеевием Md. Название 104-го элемента — курчатовий Кu — дано в честь выдающегося советского физика И. В. Курчатова. Курчатовий синтезирован в 1964 г. в Объединенном институте ядерных исследований в г. Дубне. В том же институте в феврале 1970 г. синтезирован 105-й элемент. Коллективом физиков социалистических стран, работающих в г. Дубне, в 1977 г. завершен цикл экспериментов по синтезу 106-го и 107-го элементов. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы обычно делят на металлы и неметаллы. Однако это деление условно. Более подробно свойства неметаллов и металлов рассматриваются в § 8.1, 12.1—12.3.
Важной характеристикой элементов является их распространенность в земной коре, т. е. в верхней твердой оболочке Земли, толщина которой принята условно равной 16 км. Распределение элементов в земной коре изучает геохимия — наука о химии Земли. Советский геохимик А. П. Виноградов составил таблицу среднего химического состава земной коры. В дальнейшем распространенность химических элементов в земной коре (литосфере, без океана и атмосферы) дается по А. П. Виноградову.
Согласно этим данным самым распространенным элементом является кислород — 47,2% массы земной коры, затем следует кремний — 27,6, алюминий — 8,80, железо — 5,10, кальций — 3,6, натрий — 2,64, калий — 2,6, магний — 2,10, водород — 0,15%.
Из приведенных цифр видно, что элементы распространены в земной коре крайне неравномерно. Перечисленные 9 элементов составляют 99,79% массы земной коры, все остальные — лишь 0,21%. Как впервые установил Д. И. Менделеев, наибольшее распространение в природе имеют элементы «малого атомного веса (атомной массы), в организмах же исключительно преобладают легчайшие (Н, С, N, О)». В космосе также наиболее распространены самые легкие элементы — водород и гелий.
Простые и сложные вещества. Аллотропия
Атомы химических элементов могут существовать в свободном виде при очень высоких температурах — это одиночные атомы, или в составе простых и сложных веществ.
Простые вещества — это вещества, образованные из атомов одного элемента.
Например, простое вещество уголь образовано атомами элемента углерода, простое вещество железо — атомами элемента железа, простое вещество азот — атомами элемента азота.
Сложные вещества, или химические соединения,— это вещества, образованные атомами разных элементов.
Так, оксид меди (II) образован атомами элементов меди и кислорода, вода — атомами элементов водорода и кислорода.
Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент». Простое вещество характеризуется определенной плотностью, растворимостью, температурами плавления и кипения и т. п. Эти свойства относятся к совокупности атомов и для разных простых веществ они различны. Химический элемент характеризуется определенным положительным зарядом ядра атома (порядковым номером), степенью окисления, изотопным составом и т. д. Свойства элементов относятся к его отдельным атомам. Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ водорода и кислорода, а из элементов водорода и кислорода. Названия элементов обычно совпадают с названиями соответствующих им простых веществ (исключения: углерод и одно из простых веществ кислорода — озон).
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества — аллотропными видоизменениями или модификациями. Так, элемент кислород образует две аллотропные модификации — кислород и озон; элемент углерод — три: алмаз, графит и карбин; несколько модификаций образует элемент фосфор.
Явление аллотропии вызывается двумя причинами: 1) различным числом атомов в молекуле (например, кислород 

Относительная атомная масса
Современные методы исследования позволяют определить чрезвычайно малые массы атомов с большой точностью. Так, например, масса атома водорода составляет 


В химии традиционно используются не абсолютные значения атомных масс, а относительные. В 1961 г. за единицу атомной массы принята атомная единица массы (сокращенно а. е. м.), которая представляет собой 1/12 часть массы атома изотопа углерода 
Большинство химических элементов имеют атомы с различной массой (см. изотопы, § 2.4). Поэтому
относительной атомной массой 

Относительные атомные массы (вместо термина «относительная атомная масса» можно использовать исторически сложившийся термин «атомная масса») элементов обозначают 




Относительная атомная масса — одна из основных характеристик химического элемента. Современные значения атомных масс приведены в периодической системе элементов Д. И. Менделеева (см. первый форзац книги).
Относительная молекулярная масса
Относительной молекулярной массой 

Относительная молекулярная масса численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества. Она легко подсчитывается по формуле вещества. Если в состав молекулы входят атомы определенного изотопа, что всегда указывается (например, 

Например, 
Значит, относительная молекулярная масса воды равна 18,01534, или, округленно, 18.
Относительная молекулярная масса показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома 

Моль. Молярная масса
В Международной системе единиц (СИ) за единицу количест-в а вещества принят моль.
Моль — это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов или других), сколько атомов содержится в 0,012 кг изотопа углерода 
Зная массу одного атома углерода ( 

Это число называется постоянной Авогадро (обозначение 
Молярная масса — величина, равная отношению массы вещества к количеству вещества.
Она имеет размерность кг/моль или г/моль; обычно ее обозначают буквой М.
Молярную массу вещества легко вычислить, зная массу молекулы. Так, если масса молекулы воды равна 



Молярная масса может быть подсчитана для веществ как в молекулярном, так и в атомарном состоянии. Например, относительная молекулярная масса водорода 


Масса и количество вещества — понятия разные. Масса выражается в килограммах (граммах), а количество вещества — в молях. Между массой вещества (m, г), количеством вещества (n, моль) и молярной массой (М, г/моль) существуют простые соотношения:
По этим формулам легко вычислить массу определенного количества вещества, или определить число молей вещества в известной массе его, или найти молярную массу вещества (см. § 1.12 — решение типовых задач).
Химические знаки, формулы и уравнения
Элементы принято обозначать химическими знаками (символами). Символ элемента состоит из первой буквы или первой и одной из следующих букв латинского названия элемента; первая буква всегда прописная, вторая — строчная. Например, латинское название водорода Hydrogenium, обозначение — Н, кислорода — Oxygenium — О, алюминия — Aluminium — А!, железа — Ferrum — Fe, цинка — Zincum — Zn и т. д.
Состав сложных веществ изображается при помощи химических формул. Например, формула 
Формулами обозначаются и молекулы простых веществ, если известно, из скольких атомов состоит молекула. Например, 


Химические уравнения записывают с помощью химических формул и знаков. Они служат для изображения химических реакций и отражают закон сохранения массы веществ. В каждом уравнении имеется две части, соединенные знаком равенства. В левой части записывают формулы веществ, вступающих в реакцию, в правой — формулы веществ, образующихся в результате реакции. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым.
Составим, например, уравнение реакции взаимодействия хлорида железа (III) с гидроксидом натрия. Первоначально запишем схему этой реакции, т. е. формулы исходных и конечных веществ реакции, указав стрелкой ее направление:
Чтобы уравнять число атомов железа, натрия, хлора, кислорода и водорода в левой и правой частях уравнения, надо перед формулами NaCI и NaOH поставить коэффициент 3:
В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов в правой. Это означает, что это уравнение удовлетворяет закону сохранения массы веществ (см. § 1.9), следовательно, написано правильно. Коэффициенты перед формулами веществ в уравнениях химических реакций называют стехиометрическими коэффициентами.
Стехиометрия — раздел химии, в котором рассматриваются массовые и объемные отношения между реагирующими веществами. Стехиометрические количества — это количества веществ, которые соответствуют уравнению реакции или формуле. Стехиометрические расчеты — это расчеты по химическим формулам и уравнениям, а также вывод формул веществ и уравнений реакций.
Коэффициенты в обеих частях химического уравнения можно увеличивать или уменьшать в одно и то же число раз. Так, если уравнивать коэффициенты, исходя из одного моля гидроксида натрия, то уравнение примет вид
В этом случае оно также будет правильным, так как соблюдается закон сохранения массы веществ. Коэффициент 1 обычно опускается.
Таким образом, подбор коэффициентов в химическом уравнении осуществляется с помощью простых рассуждений после того, как записана схема реакции. При подборе коэффициентов для уравнений окислительно-восстановительных реакций удобно пользоваться другими приемами (см. § 7.3).
По химическим формулам и уравнениям производят различные количественные расчеты в промышленном и сельскохозяйственном производствах, а также в лабораторной практике (см. § 1.12).
Химические реакции. Классификация реакций
Вещества, взаимодействуя друг с другом, подвергаются различным изменениям и превращениям. Например, бериллий, взаимодействуя с кислородом воздуха при температуре свыше 500°С, превращается в оксид бериллия; уголь, сгорая, образует углекислый газ и т. п.
Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, и при этом не происходит изменения состава ядер атомов, называются химическими.
Окисление на воздухе, горение, получение металлов из руд, ржавление железа — все это химические явления. Иначе их называют химическими превращениями, химическими реакциями или химическими взаимодействиями.
Следует различать химические и физические явления.
При физических явлениях изменяется форма или физическое состояние веществ или образуются новые вещества за счет изменения состава ядер атомов.
Например, при взаимодействии газообразного аммиака с жидким азотом аммиак переходит вначале в жидкое, а затем в твердое состояние. Это не химическое, а физическое явление, так как состав веществ (и азота и аммиака) не меняется. Некоторые явления, приводящие к образованию новых веществ, относятся к физическим. Таковы, например, ядерные реакции (см. § 2.3), в результате которых из атомов одних элементов образуются атомы других. Такие явления изучает ядерная физика.
Физические явления, как и химические реакции, широко распространены: протекание электрического тока по металлическому проводнику (проволоке), ковка и плавление металла, выделение теплоты, превращение воды в лед или пар и т. д.
Химические явления всегда сопровождаются физическими. Например, при сгорании магния выделяются теплота и свет, в гальваническом элементе в результате химических реакций возникает электрический ток.
В соответствии с атомно-молекулярным учением и законом сохранения массы (см. § 1.9) при химических реакциях из атомов вступивших в реакцию веществ образуются новые вещества (как простые, так и сложные), причем общее число атомов каждого элемента всегда остается постоянным.
Химические реакции классифицируют по различным признакам.
1. По признаку выделения или поглощения теплоты. Реакции, протекающие с выделением теплоты, называют экзотермическими. Например, реакция образования хлороводорода из водорода и хлора:
Реакции, протекающие с поглощением теплоты из окружающей среды, называются эндотермическими. Например, реакция образования оксида [азота (II) из азота и кислорода, которая протекает при высокой температуре:
Количество выделенной или поглощенной в результате реакции теплоты называют тепловым эффектом процесса. Раздел химии, изучающий тепловые эффекты различных процессов, называется термохимией.
Химические уравнения, в которых приводятся тепловые эффекты реакций, называются термохимическими. В таких уравнениях коэффициенты при формулах означают число молей соответствующих веществ и поэтому могут быть дробными числами.
Так как тепловой эффект реакции зависит от температуры и давления, то условились его приводить для стандартных условий: температура 25°С (298 или, точнее, 298,15 К) и давление p = 101 325 Па 



Поясним смысл теплового эффекта реакции 



В этом физический смысл величины 

Если все конечные продукты реакции и исходные вещества находятся в стандартных состояниях (Т = 298 К, р 



Согласно сказанному термохимические уравнения экзотермической реакции образования хлороводорода и эндотермической реакции образования оксида азота (II) из соответствующих простых веществ при стандартных условиях запишутся так:
Уравнения (II) означают, что превращение 0,5 моль газообразного водорода и 0,5 моль, газообразного хлора в 1 моль газообразного хлороводорода при стандартных условиях сопровождается выделением 92,3 кДж теплоты, а превращение 0,5 моль газообразного азота и 0,5 моль газообразного кислорода в 1 моль газообразного оксида азота (II) при стандартных условиях сопровождается поглощением 90,4 кДж теплоты. В уравнениях (I) этих реакций слово «моль» опущено, так как 


Очевидно, что если реакция соединения протекает с выделением теплоты, то обратная ей реакция — реакция разложения — будет идти с поглощением теплоты. Если же реакция соединения протекает с поглощением теплоты, то обратная ей реакция разложения будет протекать с выделением теплоты. Так, в первом примере 



В школьных курсах химии и многих учебных пособиях тепловые эффекты реакций обозначают через Q и считают их положительными, если выделяется теплота, и отрицательными, если она поглощается. Очевидно, 
Тепловой эффект химических реакций измеряют с помощью специальных приборов — калориметров. Их устройство описывается в курсах физики и физической химии.
2. По признаку изменения числа исходных и конечных веществ реакции подразделяют на следующие типы: соединения, разложения, замещения и обмена.
Реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество, называются реакциями соединения. Например, взаимодействие хлороводорода с аммиаком:
или образование оксида магния из простых веществ:
Реакции, в результате которых из одного вещества образуется несколько новых веществ, называются реакциями разложения. Например, разложение иодида водорода:
или разложение перманганата калия:
Реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы одного из элементов сложного вещества, называются реакциями замещения. Например, замещение свинца цинком в нитрате свинца (II):
или вытеснение брома хлором:
Реакции, в результате которых два вещества обмениваются своими составными частями, образуя два новых вещества, называются реакциями обмена. Например, взаимодействие оксида алюминия с серной кислотой:
или взаимодействие хлорида кальция с нитратом серебра:
или взаимодействие основания с кислотой:
3. По признаку обратимости реакции делят на обратимые и необратимые (см. § 4.5).
4. По признаку изменения степени окисления атомов, входящих в состав реагирующих веществ, различают реакции, протекающие без изменения степеней окисления атомов, и окислительно-восстановительные реакции (с изменением степеней окисления атомов). Об окислительно-восстановительных реакциях см. §7.1.
Закон сохранения массы веществ
Рассмотрим в свете атомно-молекулярного учения основные законы химии: сохранения массы веществ, постоянства состава, объемных отношений и закон Авогадро. Эти законы подтверждают атомно-молекулярное учение — основу новой химии. Новая химия берет начало с работ М. В. Ломоносова — открытия закона сохранения массы веществ, развития и применения в химии атомно-молекулярного учения, современная химия — с открытия периодического закона и периодической системы элементов Д, И, Менделеевым. В свою очередь, атомно-молекулярное учение объяснило основные законы химии.
Закон сохранения массы веществ впервые сформулирован в 1748 г. М. В. Ломоносовым. Позднее (в 1756 г.) он экспериментально обосновал этот закон. Современная формулировка закона такова:
масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Независимо от Ломоносова этот закон сформулировал в 1789 г. французский химик Лавуазье. Он также получил экспериментальные доказательства закона, изучив многие реакции окисления металлов.
Закон сохранения массы веществ может быть объяснен с точки зрения атомно-молекулярного учения так: при химических реакциях атомы не исчезают и не могут возникнуть из ничего; общее число атомов остается постоянным до и после реакции. Например, при взаимодействии двухатомных молекул водорода и хлора должно образоваться столько молекул HCI, чтобы число атомов водорода и хлора осталось равным двум, т. е. две молекулы:
И, поскольку атомы имеют постоянную массу, не меняется и масса веществ до и после реакции.
Закон сохранения массы веществ М. В. Ломоносов связывал с законом сохранения энергии (количества движения). Он рассматривал эти законы в единстве как всеобщий закон природы, и сформулировал его (1748) следующим образом: «Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте. Сей всеобщий естественный закон простирается и в самые правила движения: ибо тело, движущее своею силою другое, столько же оные у себя теряет, сколько сообщает другому, которое от него движение получает».
Таким образом, законы сохранения массы веществ и сохранения энергии — это две стороны единого закона природы — закона вечности материи и ее движения.
Взгляды Ломоносова подтверждены современной наукой. Взаимосвязь массы и энергии (она рассматривается в физике) выражается уравнением Эйнштейна:
где Е — энергия, m — масса, с — скорость света в вакууме.
Закон сохранения массы веществ дает материальную основу для составления уравнений химических реакций. Опираясь на него, можно производить расчеты по химическим уравнениям (см. § 1.12).
Закон постоянства состава вещества
К основным законам химии относится закон постоянства состава:
всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный н количественный состав.
Рассмотрим, например, состав оксида углерода (IV) (углекислого газа) 

Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж. Пруст в 1808 г. Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н. С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например 












В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Состав соединений молекулярной структуры, т. е. состоящих из молекул, является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным н зависит от условий получения.
Например, состав оксида ванадия (II) зависит от температуры и давления кислорода, применяемого при синтезе. Надо также учитывать изотопный состав элементов: обычная вода, например, содержит 11,19% водорода, а тяжелая вода — 20% (см. §8.4).
Газовые законы. Закон Авогадро. Молярный объем газа
Поскольку газы являются наиболее простым объектсм для исследования, то их свойства и реакции между газообразными веществами изучены наиболее полно.
Французский ученый Ж • Л. Гей-Люссак установил закон объемных отношений:
объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как простые целые числа.
Например, 1 л хлора соединяется с I л водорода, образуя 2 л хлороводорода; 2 л оксида серы (IV) соединяются с 1 л кислорода, образуя 2 л оксида серы (VI).
Этот закон позволил итальянскому ученому А. Авогадро предположить, что молекулы простых газов (водорода, кислорода, азота, хлора и др.) состоят из двух одинаковых атомов. При соединении водорода с хлором их молекулы распадаются на атомы, а последние образуют молекулы хлороводорода. Но поскольку из одной молекулы водорода и одной молекулы хлора образуются две молекулы хлороводорода, объем последнего должен быть равен сумме объемов исходных газов, т. е.
Таким образом, объемные отношения легко объясняются, если исходить из представления о двухатомности молекул простых газов (



Изучение свойств газов позволило А. Авогадро высказать гипотезу, которая впоследствии была подтверждена опытными данными, а потому стала называться законом Авогадро:
в равных объемах различных газов при одинаковых условиях (температуре н давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие: при одинаковых условиях 1 моль любого газа занимает одинаковый объем. Этот объем можно вычислить, если известна масса 1 л газа. При нормальных условиях, т. е. температуре 273 К (0°С) и давлении 101 325 Па, масса 1 л водорода равна 0,09 г, молярная масса его равна 1,008∙2=2,016 г/моль. Тогда объем, занимаемый 1 моль водорода, равен
При тех же условиях масса 1 л кислорода 1,429 г; молярная масса 32 г/моль. Тогда объем равен
при нормальных условиях 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа. Точное значение 22,4135±0,0006 л/моль.
Молярный объем газа — это отношение объема вещества к количеству этого вещества:
где 


В I860 г. на международном съезде химиков в Карлсруэ учение Авогадро получило всеобщее признание. Съезд дал сильный толчок развитию атомно-молекулярного учения. Но особенно бурное развитие оно получило после открытия Д. И. Менделеевым периодического закона химических элементов.
На основании закона Авогадро определяют молярные массы газообразных веществ. Чем больше масса молекул газа, тем больше масса одного и того же объема газа. В равных объемах газов при одинаковых условиях содержится одинаковое число молекул, а следовательно, и молей газов. Отношение масс равных объемов газов равно отношению их молярных масс:
где 



Отношение массы определенного объема одного газа к массе такого же объема другого газа (взятого при тех же условиях) называется плотностью первого газа по второму (обозначается буквой D):
Обычно плотность газа определяют по отношению к самому легкому газу — водороду (обозначают 
Молекулярная масса вещества в газообразном состоянии равна его удвоенной плотности по водороду.
Часто плотность газа определяют по отношению к воздуху (
Среднюю молярную массу воздуха легко вычислить, если учесть, что воздух состоит приблизительно из 4 объемов азота (молярная масса 28 г/моль) и 1 объема кислорода (молярная масса 32 г/моль), т. е. 
В этом случае молярная масса определяется выражением
Определение молекулярных масс показало, что молекулы простых газов состоят из двух атомов (



На основании закона Авогадро осуществляют различные расчеты — вычисление объема, массы, плотности газов при нормальных условиях, молярной массы газообразных веществ, а также относительной плотности газов (см. § 1.12).
Для решения расчетных химических задач, связанных с газообразными веществами, часто приходится использовать газовые законы, которые изучаются в школьном курсе физики. Не рассматривая их здесь подробно, запишем лишь формулировки и формулы, необходимые для расчетов.
Закон Бойля — Мариотта: при постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится. Отсюда
где р — давление, V — объем газа.
Закон Гей-Люссака: при постоянном давлении вменение объема газа прямо пропорционально температуре, т. е.
где Т — температура в К (Кельвинах).
Объединенный газовый закон Бойля — Мариотта и Гей-Люссака:
Эта формула обычно употребляется для вычисления объема газа при данных условиях, если известен его объем при других условиях. Если осуществляется переход от нормальных условий (или к нормальным условиям), то эту формулу записывают следующим образом:
где 




Если известна масса или количество газа, а надо вычислить его объем, или наоборот, используют уравнение Менделеева — Клапейрона:
где п — число молей газа, m — масса (г), М — молярная масса газа (г/моль), R — универсальная газовая постоянная. R = 8,31 Дж/(моль-К). Это значение используют, если давление измерено в Па, а объем в 
Законы химии
Фундаментальные законы естествознания и химии, как части естественных наук, являются ,научно-теоретической базой вскрытия и количественного описания причинно-следственных связей химической формы движения. Фундаментальными следует считать законы сохранения массы-энергии, сохранения заряда, периодичности развития. Эти законы выполняются в любых условиях и масштабах. Множество других законов ограничено действием, они носят частный характер, но в пределах действия не должны противоречить законам фундаментальным.
Фундаментальные законы и законы стехиометрии
Законы сохранения массы — энергии, сохранения заряда, периодичности развития; законы эквивалентов, постоянства состава, кратных отношений, объемных отношений, удельных теплоемкостей.
Химия—одна из древних наук, которая в современном обществе, все больше смыкаясь с физикой и опираясь на математику и вычислительную технику, ускоренным темпом проникает в различные отрасли производства.
Одной из важнейших вех на пути развития химии явилось открытие Д. И. Менделеевым периодического закона элементов, ставшего основой химической систематики, развития учения о строении вещества и создания теории химических процессов. Большое значение для углубления представлений о природе химических превращений имело их энергетическое, точнее, термодинамическое описание. Именно термодинамика внесла в химию представление о количественной мере направления и глубине химических процессов, т. е. о химическом сродстве, или энергии Гиббса. Термодинамический метод позволил количественно связать химические превращения с влиянием температуры и давления, с изменением концентраций веществ. На этой основе периодический закон обрел прочную базу для количественного описания свойств еще неизученных, а иногда и несинтезированных веществ.
Успешно справляясь с задачей количественного описания химических превращений, термодинамика не вскрывает их причинно-следственные связи. В результате на принципиально новой основе возникла необходимость создания теоретического фундамента химии — квантовой механики. Так возникло учение о строении вещества, химической связи и валентности, которое в существующем виде играет важную роль в понимании химической формы движения. Химия как один из важнейших разделов естествознания в своем многообразии опирается на совокупность законов природы, обладающих огромной познавательной и преобразующей силой. Однако не все законы в равной степени всесторонне охватывают причинно-следственные связи описываемых ими явлений и фактов.
Одни из них, более частные, имеют ограниченную область действия, другие являются общими для всего естествознания и в связи с этим получили название фундаментальных—это законы сохранения заряда, сохранения массы-энергии, периодичности развития.
Имея в своей основе фундаментальные законы, химия на всех этапах развития остается наукой о веществах и их превращениях. Под веществом понимают атомы химических элементов и их соединения во всех состояниях: твердом, жидком, газообразном, плазменном (при сверхвысоких температурах или в электрических разрядах) и сверхметаллическом (при гигантских давлениях). Однако структура вещества чрезвычайно многообразна, поскольку сами атомы состоят из элементарных частиц сложной природы (см. приложение III). Эти частицы различны по массе, времени жизни, заряду и таким менее привычным характеристикам, как спин, странность, очарование и др. В 1964 г. М. Гелл-Манн и Дж. Цвейг ввели представления о кварках — первичных микрочастицах, из которых строятся все остальные.
Для химии наибольший интерес представляют стабильные элементарные частицы, такие, как электроны, протоны и нейтроны, которые энергично взаимодействуют между собой, образуя первичную форму вещества — атомы химических элементов. Атомы состоят из положительно заряженного чрезвычайно плотного протонно-нейтронного ядра и диффузной отрицательно заряженной электронной оболочки. Подчиняясь законам квантовой механики, статистики и электродинамики, атомы взаимодействуют между собой, образуя бесчисленное множество химических соединений. Атомы одного вида образуют гомосоединения, атомы разных видов — гетеросоединения, различные по составу и агрегатному состоянию. Все это и есть химическая форма материи — вещество.
Важнейшим свойством вещества является наличие массы, согласно второму закону Ньютона, определяемой как мера инерции. Однако это свойство вещества проявляется только под действием сил внешнего воздействия и поэтому является пассивным. К активным свойствам вещества следует отнести гравитацию и заряд, действие которых связано с явлениями тяготения масс, притяжения (отталкивания) зарядов. Эти свойства указывают на наличие связи между двумя формами материи—веществом и полем. Для характеристики химической природы веществ особенно важен заряд. Нейтрон имеет заряд.
равный нулю; электрон и протон обладают одинаковыми, но противоположными по знаку зарядами, величина которых равна 
Два точечных заряда 
где Е—энергия взаимодействия; 
Взаимодействие между атомными ядрами и электронными оболочками в атомах и химических соединениях осуществляется главным образом благодаря наличию у них зарядов и служит основой при возникновении химической связи и образовании химических соединений. В ядрах атомов между протонами и нейтронами действуют особые ядерные силы, которые во много раз больше сил взаимодействия зарядов. Именно поэтому в химических реакциях даже при самых высоких температурах 
Взаимосвязь массы и энергии, вскрытую А. Эйнштейном и отражающую фундаментальный закон сохранения массы-энергии, выражают соотношением

где Е и m—эквивалентные значения энергии и массы; с—скорость света в пустоте, равная
Это означает, что никакой химический процесс не осуществляется без изменения массы вещества.
Например, при сгорании водорода в кислороде с образованием водяного пара по схеме

выделяется и рассеивается в окружающей среде 241 835 Дж энергии. С этой энергией рассеивается масса вещества: 
Изменение массы в 

Понятие вещества теснейшим образом связано с понятием движения. Связь массы вещества с движением проявляется не только в пассивном сопротивлении изменению скорости, но и в прямой зависимости ее от скорости: 
здесь


не изменяется от формы движения (механическое, химическое и др.). В обычном так называемом макромире скорости движения существенно меньше скорости света, и поэтому релятивистский эффект практически равен нулю. Напротив, в отличие от неощутимых при химических реакциях изменений массы вещества эквивалентные им энергетические эффекты реакций изменяются в широких пределах. Так, 1 моль алюминия при окислении кислородом порождает 837 кДж теплоты, 1 моль жидкого бензола 
В настоящее время доказано, что любые движущиеся частицы одновременно проявляют корпускулярные и волновые свойства. В макромире при больших массах и малых скоростях движения волновая природа вещества остается незаметной. В случае же движения микроскопических частиц (электронов, атомов, молекул), движущихся с большими скоростями, волновая природа становится определяющей. Все сказанное свидетельствует о важности закона сохранения массы энергии, его универсальности, всеобщности и, следовательно, фундаментальности.
Третий фундаментальный закон естествознания — закон периодичности развития. Примерами периодичности развития могут служить системы элементарных частиц, ядер атомов, электронных оболочек атомов, химических соединений и т. д. Строгий закон периодичности свойств элементарных частиц до конца еще не открыт.
Хорошо изученным этапом усложнения структуры корпускулярной формы материи являются продукты ассоциации нуклонов—семейства атомных ядер. Расположенные в последовательности возрастания заряда, они представляют собой ряд периодических чередований устойчивости ядерных конфигураций. Это означает, что строение атомных ядер, все более усложняющееся по мере перехода от легких элементов к тяжелым, периодически повторяет некоторую структурную комбинацию протонов и нейтронов. Наиболее устойчивые ядра можно характеризовать так называемыми «магическими числами» — 2, 8, 20, 28, 50, 82, 126, которые представляют собой числа протонов (р) и нейтронов (n) в атомных ядрах, например:


Однако все, что связано со строением ядер, изучают в курсе ядерной физики. Химические же свойства определены строением и периодическим изменением свойств электронных оболочек атомов. Эта периодичность была обобщена Д. И. Менделеевым в 1869 г. в открытом и сформулированном нм периодическом законе, а периодическая система элементов явилась количественным воплощением этого закона. Периодичность изменения свойств атомов химических элементов, как известно, обязана своим происхождением послойному строению электронных оболочек и строго ограниченной емкости каждого электронного слоя. Так, первый электронный слой в атоме не. может содержать более 2 электронов, второй—более 8, третий—более 18, четвертый—более 32 и т. д. Последовательному заполнению каждого из этих слоев соответствуют семейства элементов, свойства которых изменяются монотонно. Каждый раз при переходе к новому электронному слою структура во многом повторяет строение предыдущего, представляя качественно прежнюю, но количественно иную монотонность изменения свойств элементов. Что касается периодичности изменения свойств различных классов химических соединений, то здесь вся химия, во всем ее многообразии являет собой торжество и всеобщность периодического закона.
Помимо фундаментальных законов химии, являющихся основой количественного описания и вскрытия причинно-следственных связей химических превращений, химическая форма движения материи подчиняется большому числу менее общих (частных) законов. Так, для химии чрезвычайно важны законы стехиометрии, устанавливающие количественные соотношения элементов в химических соединениях, и уравнения химических реакций. Открытый немецким физиком И. Рихтером (1792—1794) закон эквивалентов описывает количественные соотношения химически взаимодействующих веществ: его формулируют так: массы (т) реагирующих веществ пропорциональны их эквивалентам (Э), т. е.
Эквивалентом называют реальную или условную частицу вещества, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции—одному электрону. Фактором эквивалентности служит число, обозначающее долю реальной частицы вещества, эквивалентной одному нону водорода в данной кислотно-основной реакции, или одному электрону в данной окислительно-восстановительной реакции. Фактор эквивалентности может быть равен или меньше единицы. Молярная масса эквивалента (ММЭ) вещества — масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности на его молярную массу. В соответствии с законом эквивалентов массы взаимодействующих без остатка веществ пропорциональны их эквивалентам. Прокаливая, например, чистую металлическую медь 


откуда находим численное значение 
ММЭ сложных химических соединений (гидроксидов, солей и др.) вычисляют по данным реакций, идущих без изменения степени окисления элементов, входящих в состав реагирующих соединений. Например, ММЭ кислоты в реакции нейтрализации
можно найти по ММЭ щелочи:
В общем случае ММЭ кислот, оснований и солей в реакциях обменного разложения находят из соотношения
где М — молярная масса вещества; n — сумма зарядов функциональных групп, которые замещаются в процессе реакции.
ММЭ сложных веществ в окислительно-восстановительных реакциях находят из соотношения
где z—число элементарных зарядов (электронов), участвующих в данном окислительно-восстановительном процессе. Например, ММЭ перманганата калия в реакции
где 


Закон постоянства состава химических соединений, открытый в результате многолетнего (1801 —1808) научного спора французских химиков Ж. Пруста и К. Бер-толле, формулируют следующим образом: каждое химическое соединение, каким бы способом оно не было получено, имеет один и тот же постоянный состав.
Развитие химии в последующие годы привело к выгоду о том, что наряду с химическими соединениями постоянного состава существуют также соединения переменного состава, в силу чего закон имеет ограниченное приложение. По предложению акад. Н. С. Курнакова соединения переменного состава названы бертоллндамп, а постоянного—дальтонидами. Примерами соединений переменного состава могут служить карбиды титана 
Закон кратных отношений установлен Дж. Дальтоном (1803) и заключается в следующем: в двух соединениях, образованных из одних и тех же элементов, на одно и то же массовое количество одного элемента приходятся такие массовые количества другого элемента, которые относятся, как небольшие целые числа. Так, например, в оксидах углерода СО и 
Если в химических реакциях принимают участие газы, то, как установил Ж. Гей-Люссак (1808), вступает в силу закон объемных отношений: объемы вступающих в реакцию газов относятся между собой, а также к объемам образующихся газообразных продуктов, как небольшие целые числа.
Исходя из простоты объемных отношений в реакциях между газами, итальянский физик А. Авогадро сформулировал закон: в равных объемах различных газов при одинаковых внешних условиях содержится одинаковое число молекул. Из закона Авогадро следует:
1) одинаковое число молекул различных газов при равных условиях занимает одинаковый объем;
2) одни моль различных газов при температуре 273,16 К и давлении 


Один моль газа связан следующим соотношением с объемом, давлением и температурой:
где р—давление (Па); V—объем газа 
которое называют уравнением Клапейрона—Менделеева.
Закон удельных теплоемкостей предложен французскими учеными Дюлонгом и Пти (1819). По этому закону: произведение удельной теплоемкости (с) простого вещества в твердом состоянии на атомную массу (A) этого элемента является величиной приближенно постоянной:
удельную теплоемкость выражают количеством теплоты, необходимым для нагревания 1 моль простого вещества на 1° С. Использование этого закона позволило определить атомные массы ряда элементов, значения которых в дальнейшем уточнялись. Открытие законов кратных отношений и удельной теплоемкости сыграло важную роль в развитии атомной теории. Применение законов стехиометрии нашло свое отражение в составлении вещественного баланса химических реакций, эти вопросы достаточно подробно будут рассмотрены в последующих главах.
Классы химических соединений и типы реакций
Для понимания и простейшего количественного описания химических и фазовых превращений необходимо знание законов стехиометрии, т. е. законов, устанавливающих количественные соотношения масс элементов, входящих в состав химических соединений, а также соотношений масс простых и сложных веществ, участвующих в химических реакциях. В прикладной (инженерной) химии законы стехиометрии составляют основу вещественного (материального) баланса производственных процессов.
Основные классы простых и сложных соединений
Основной особенностью атомов химических элементов является их способность образовывать химические соединения. Причины, объясняющие эту особенность и способы ее количественного и качественного описания, будут раскрыты далее, поскольку это возможно лишь на основе данных о строении атома и современных представлений о химической связи. Следует лишь отметить, что такая тенденция для химических элементов чрезвычайно характерна. Исключение составляют лишь некоторые представители группы «благородных» газов—гелий, неон и аргон, которые при всех условиях атомарны и не проявляют химической активности. Все остальные элементы периодической системы в атомарном состоянии химически активны и образуют многочисленные гомо- и гетеросоеди-нения.
Гомосоединения, простые вещества
Гомосоединениями называют продукты взаимодействия атомов одного и того же элемента. Примерами гомосоединений могут служить молекулы газов—
Среди гомосоединений элементов периодической системы важную роль отводят простым веществам—термически наиболее устойчивым гомосоединениям данного эле-мента в характерном для него агрегатном состоянии при давлении 1 атм* и температуре 298 /(. Условимся, что термическую устойчивость определяют численным значением и знаком теплового эффекта химической реакции разложения или образования соединения. Тепловой эффект реакции обычно выражают числом джоулей (Дж), знак минус (—) перед тепловым эффектом соответствует
* В Международной системе единиц (СИ) давление рекомендовано измерять не в физических атмосферах, а в паскалях (I 
экзотермическому процессу, знак плюс (+)—эндотермическому.
Если атомы элемента химически пассивны и не образуют гомосоединений, то простым веществом будет одноатомный газ (благородные газы). Из двух молекулярных форм кислорода—
что свидетельствует об устойчивом существовании молекул 

простым веществом считают только графит (карбин не изучен). Исключением является фосфор, простым веществом для которого принято считать белый фосфор, хотя красный представляет более устойчивую модификацию.
Бинарные гетеросоединения
Гетеросоединениями называют продукты взаимодействия атомов различных элементов. Гетеросоединения, беспредельно разнообразные по составу и строению, делят на соединения стехиометрического состава (истинные или дальтониды, например 

Для водорода характерно простейшее строение атома, состоящего из ядра и электронной оболочки с одним электроном. Свободные атомы водорода обладают высокой реакционной способностью и экзотермически связываются в молекулы
Такой молекулярный водород при температуре 298 К и давлении 1,013 гПа считают простым веществом.
Молекулярный водород энергично взаимодействует с наиболее активными металлами и неметаллами (тепловой эффект в кДж):
Степень окисления * водорода в соединениях с металлами — 1, что соответствует способности атома водорода присоединять экзотермически один электрон

в связи с чем гидриды активных металлов (щелочных, щелочно-земельных) при обычных условиях представляют собой ионные кристаллы, состоящие из положительно заряженных ионов металла и отрицательно заряженных ионов водорода. В соединениях с неметаллами водород имеет степень окисления +1, что соответствует слабовы-раженной способности атомов водорода отдавать электрон:
Поскольку этот процесс эндотермичен, для водорода ионное состояние с зарядом 1+ в химических соединениях нехарактерно. Большинство соединений неметаллов с водородом— полярные.
Среди бинарных водородистых соединений следует отметить семейство углеводородов с безграничным разнообразием форм. Многочисленные представители углеводородов объединены в гомологические ряды с общими формулами 
Кислород образует множество соединений со всеми другими элементами периодической системы (кроме гелия, неона и аргона). В соединениях он обычно имеет степень окисления, равную —2. С водородом кислород образует несколько соединений — 
* В учебной литературе употребляют родственные термины: формальный заряд, окислительное число, значность, пользуясь которыми важно помнить различия между ними и понятием валентности.
указывают, что наиболее устойчивой формой среди них является вода, в молекулах которой отсутствует неустойчивая цепочка атомов кислорода. Для жидкой воды характерна собственная электролитическая диссоциация:
Однако процесс этот эндотермичен и количество продис-социмровавшей воды при 25° С составляет
Таким образом, в широком интервале температур наиболее энергетически устойчивое соединение водорода и кислорода — вода. Она образует на Земле океаны, моря, льды, пары и туман, в большом количестве содержится в атмосфере, в толщах пород вода представлена капиллярной и кристаллогидратной формами. Такая распространенность и необычность свойств (аномалия плотности воды и льда, полярность молекул, способность к электролитической диссоциации, к образованию гидратов, растворов и др.) делают воду активным химическим агентом, по отношению к которому обычно рассматривают свойства большого числа других соединений.
Сложные гетеросоединения
По своим кислотно-основным свойствам вода занимает промежуточное положение среди всех остальных соединений, а характер ее взаимодействия с ними чрезвычайно разнообразен. Так, при экзотермическом взаимодействии воды с оксидами щелочных металлов экзотермически образуются основания (щелочи)
которые представляют собой гидроксиды металлов, хорошо растворимые в воде и полностью диссоциирующие на ионы:
Символ «aq» обозначает весьма большое количество воды, в которой растворяется 1 моль NaOH с образованием ионов, гидратированных молекулами воды. Наличие избытка ионов гидроксида в растворе как раз и определяет его щелочные свойства.
При взаимодействии воды с оксидами неметаллов экзотермически образуются гидраты, именуемые кислотами: 
При растворении в избытке воды образовавшийся гидроксид, гидратируясь дальше, диссоциирует на ионы водорода и кислотного остатка:

Наличие большой концентрации ионов водорода в растворе и определяет его кислотные свойства.
Кислотой называют соединение, которое, подвергаясь электролитической диссоциации при растворении в воде, образует раствор, содержащий избыток ионов водорода.
Основанием называют гидроксид, который, подвергаясь электролитической диссоциации при растворении в воде, образует раствор, содержащий избыток ионов гидроксила.
Силу кислот и оснований определяют степенью их электролитической диссоциации в водных растворах на ионы. Практически полностью диссоциирующие хорошо растворимые кислоты и основания называют сильными, в малой степени диссоциирующие малорастворимые кислоты и основания—слабыми. В соответствии с этим оксиды, образующие с водой кислоты, будут кислотными, а оксиды, образующие щелочи, —основными.
Рассмотрим в качестве примера отношение к воде высших оксидов элементов третьего периода системы Д. И. Менделеева. Ниже приведены тепловые эффекты (в кДж) реакций взаимодействия оксидов с 1 моль воды: 
Из этого примера видно, что большие экзотермические тепловые эффекты наблюдаются при образовании хорошо растворимых гидроксидов, которые в водных растворах проявляют свойства сильных электролитов—щелочей (NaOH) и кислот 

Отношение гидроксидов различной кислотно-основной природы к процессам электролитической диссоциации иллюстрируют следующие примеры (кДж): .
Так, сильные основания и кислоты 

Однако приведенные примеры не дают ответа на вопрос, почему в одних случаях при растворении гидроксида гидратация приводит к образованию кислогы

а в других случаях — к образованию основания

Это связано с тем, что гидратация по схеме (2.1) преимущественна в том случае, если связь Н—О в гидроксиде будет более полярной, чем связь R—О. Гидратация же по схеме (2.2) преимущественна в том случае, когда связь R—О гидроксида полярнее связи Н—О. Когда же полярности обеих связей в соединении ROH сравнимы по величине, гидроксид приобретает свойства и слабого основания и слабой кислоты. Это свойство электролитов называют амфотерностью. Амфотерный гидроксид в кислой среде ведет себя как основание 
а в щелочной—как кислота

Например, слабоосновный гидроксид алюминия растворяется как в растворах кислот, так и щелочей, причем в
растворах кислот активней (тепловой эффект в кДж):
Напротив, слабокислый гидроксид кремния со щелочью взаимодействует экзотермически, с кислотой процесс эндо-термичен и практически не идет:
Следовательно, гидроксид кремния неамфотерен и может быть только кислотой, соответственно оксид 
Изменение кислотных и основных свойств можно наблюдать у оксидов одного и того же элемента. Так, у металлов низшие кислородные формы являются основными, высшие—кислотными, а промежуточные—амфотерными, например:
В этом семействе слева направо убывают основные и нарастают кислотные свойства, в результате чего основный оксид МnО экзотермически взаимодействует с кислотой
а кислотный оксид 
Если подобное семейство оксидов образует неметалл (например, азот), то общая тенденция сохраняется, но свойства оксидов смещены в направлении увеличения кислотности в последовательности
Помимо оксидов основного, кислотного и амфотерного типа, можно выделить так называемые несолеобразующие оксиды, которые не образуют с водой гидратных форм и не могут быть ни основными, ни кислотными. Примером таких соединений служит N0. Обычно к несолеобразующим оксидам относят СО, хотя при высоких давлениях оксид углерода может взаимодействовать со щелочами, образуя соли муравьиной кислоты, например:
Перейдем к характеристике солей, которые представляют собой продукты полного или частичного замещения атомов водорода в кислотах на атомы металлов или продукты замещения гидроксильных групп оснований на кислотные остатки. Соли образуются при взаимодействии кислотных и основных оксидов
кислот и оснований
металлов с кислотами и щелочами
Если кислота имеет более одного атома водорода, способного замещаться на металл, ее называют многоосновной. Так, 



Гидросульфат натрия может существовать в виде индивидуального кристаллического соединения, но при растворении в воде подвергается электролитической диссоциации
и при достаточном большом разбавлении диссоциация идет до конца
Если основание содержит более одной гидроксильной группы, способной замещаться на кислотный остаток, то его называют многокислотным. Так, NaOH—однокнслот-ное, 

Гидроксосоли при растворении в воде электролитически диссоциируют, образуя гидроксоионы:
Полное замещение атомов водорода в кислотах на металл или гидроксильных групп в основаниях на кислотный остаток приводит к образованию средних солей.
Соединения, образованные хлором с другими элементами периодической системы, также многочисленны. В отличие от кислорода хлор может иметь степень окисления от —1 до +7. Однако диагональным аналогом кислорода в хлористых соединениях является лишь однозарядный хлор—
Однако при взаимодействии хлорида водорода с полярными молекулами воды в растворе образуются гидратированные ионы 
В результате электролитической диссоциации водный раствор хлорида водорода обогащается ионами водорода и приобретает свойства кислоты—это бескислородная, сильная, хлористоводородная или соляная кислота.
При взаимодействии с другими элементами периодической таблицы хлор образует многочисленные соединения— хлориды, которые в зависимости от свойств партнера (металла или неметалла) могут быть либо солями хлористоводородной кислоты, либо несолеобразными хлоридами. Примером монотонного изменения физических и химических свойств от основных к кислотным и от солей к несолеобразующим формам может служить семейство хлоридов, образуемых элементами третьего периода периодической системы:

Остановимся на растворимости и взаимодействии этих соединений с водой. Хлорид натрия представляет типичную соль, которая при растворении в воде образует нейтральный раствор гидратированных ионов натрия и хлора:
Водные же растворы 


Растворение 

Следовательно, из приведенных реакций видно, что в рассматриваемом ряду хлоридов при переходе от натрия к сере взаимодействие с водой все более приобретает характер гидролиза и становится наиболее энергетически выгодным. Последнее обстоятельство, а также аналогия между кислородными и хлористыми соединениями позволяют считать, что 

Таким образом, при переходе от оксидов к хлоридам кислотно-основное взаимодействие сохраняется, оно лишь меняет свои привычные формы.
Процессы замещения кислорода на хлор в бинарных соединениях служат характеристикой их химической
Из этого примера видно, что замещение кислорода в оксидах при переходе от основных к кислотным становится энергетически менее выгодным. Отмеченные выше особенности кислорода и хлора и их соединений как раз и отражают их диагональное сходство и связанную с этим конкуренцию в химических превращениях. Как диагональные аналоги кислород и хлор могут не полностью, а частично замещать друг друга в оксидах и хлоридах, в результате чего образуется особый класс смешанных соединений, именуемых оксохлоридами. Например, возможна экзотермическая реакция с образованием оксотри-хлорида фосфора:
В то же время тенденция к образованию оксохлоридов уменьшается по мере перехода от кислотных к основным формам оксида и хлорида. Так, Ыа20 и NaCl не взаимодействуют между собой.
Типы химических реакций
Фазовые и химические превращения. Реакции обменного разложения. Реакции окислительно-восстановительные.
Фазовые и химические превращения. Превращения индивидуального вещества, в результате которых изменяются структура или агрегатное состояние, но неизменным остается его химический состав, называют фазовыми. К таковым относят процессы сублимации, испарения, плавления веществ, а также их полиморфные превращения. Фаза—это однородная часть системы индивидуальных веществ, она отличается от других фаз системы либо агрегатным состоянием, либо строением. Систему, состоящую из одной фазы, называют гомогенной, из двух или большего числа фаз—гетерогенной.
Фазовые превращения осуществляются только в гетерогенных системах, где химический состав всех фаз одинаков. Например, в гетерогенной системе «вода—лед—пар» при 0°С сосуществуют три фазы. Они различаются между собой состоянием (твердое, жидкое и газообразное) и структурными характеристиками молекулы 



При температурах выше 0°С в системе могут сосуществовать только две фазы вода — пар и сохраняется только одно фазовое превращение

При температуре ниже 0°С вода замерзает, сосуществуют фазы лед—пар и сохраняется также одно фазовое превращение:

Примером фазового превращения одной кристаллической модификации в другую (полиморфный переход) может служить превращение алмаза в графит при температуре выше 1000°С:
Эти различные формы гомосоединений одного элемента получили название аллотропных модификаций. К подобным фазовым превращениям относятся и самопроизвольный полиморфный переход белого фосфора в красный, очень медленный при обычной температуре и ускоряющийся при нагревании или под действием света:
Превращения, при которых изменяется химический состав и структура соединений, называют химическими. Изменение агрегатного состояния может только сопровождать химический процесс, но не быть определяющим.
Примерами химических превращений могут служить термическое разложение гидрокарбоната натрия
и взаимодействие перманганата щелочного металла с хлористоводородной кислотой в водном растворе
Различие в фазовых превращениях для этих двух реакций несущественно. Принципиальное различие заключается в том, что первая реакция идет без изменения степени окисления элементов в реагирующих соединениях, а вторая—с изменением степени окисления 
1. Если в соединении связаны между собой атомы одного и того же элемента, то их степень окисления принимают равной нулю, примером служат простые вещества
2. Атомы элементов IA- и 
3. Атомы кислорода в гетеросоединениях относительно атомов других элементов (кроме фтора) имеют степень окисления, равную —2 

4. Атомы водорода в гетеросоединениях с атомами неметаллов (углерод, кремний, элементы подгруппы азота, кислорода, галогенов) имеют степень окисления
5. Атомы водорода в соединениях с элементами IА- и llА-подгрупп имеют степень окисления, равную—1 (NaH,
Понятие степени окисления чрезвычайно важно для составления уравнений химических реакций, поскольку основой для таких уравнений служит фундаментальный закон сохранения заряда. Это означает, что какими бы путями ни шла реакция, какие бы промежуточные и конечные продукты при этом ни образовывались, суммарный заряд системы веществ до и после реакции остается неизменным. При этом для выполнения закона безразлично, идет ли речь об истинном заряде ионов или о формальном заряде атомов элементов, входящих в состав соединений. Рассмотрим каждый из указанных видов химических реакций на конкретных примерах.
Реакции обменного разложения
Реакции обменного разложения идут без изменения степени окисления элементов в соединениях. Примерами таких реакций могут служить процессы кислотно-основного взаимодействия оксидов различных элементов:
Приняв степени окисления атомов кислорода и водорода равными —2 и +1 соответственно, для остальных атомов получаем заряды неизменными как до, так и после реакции. Тог же тип реакции имеет место и в случае процессов
нейтрализации кислот основаниями:
К реакциям обменного разложения относят процессы образования и разрушения газообразных многоатомных гомосоединений. Известно, что подавляющее большинство элементов периодической системы в газообразном состоянии существует не только в атомарном, но и в молекулярном состояниях. Так, известны формы кислорода— 

Разновидностью реакций обменного разложения являются химические превращения, идущие с участием комплексных соединений, которые образуются за счет внедрения одной или нескольких молекул (ионов) некоторых соединений 
Химические свойства комплексных соединений зависят от его молекулярной структуры, которая может быть различной у соединений одного и того же состава. Например, соединение 


Растворы этих трех изомеров различны по электрической проводимости, по физическим и химическим свойствам.
Химические превращения комплексных соединений наиболее интересно и разнообразно осуществляются в растворах. Если слить растворы с ионами 



Другим примером может служить почти бесцветный раствор соли железа со степенью окисления +2. Если к этому раствору добавить цианистый калий, то первоначально выпадет коричневый осадок цианида железа
но при дальнейшем прибавлении KCN осадок растворится:
Из такого раствора железо (его степень окисления не меняется) не осаждается ни аммиаком, ни щелочью. Окисление железа в комплексном ионе 

Реакции окислительно-восстановительные
Реакции окислительно-восстановительные идут с изменением степени окисления одного или нескольких элементов, входящих в состав реагирующих соединений. В этих реакциях окислителями называют элементы, которые, восстанавливаясь, понижают свою степень окисления; восстановителями—элементы, которые, окисляясь, повышают свою степень окисления. Эти изменения степени окисления атомов можно условно связать с процессами присоединения или отдачи электронов.
К реакциям окисления — восстановления следует прежде всего отнести процессы, идущие с участием простых
Здесь окислителем является молекулярный кислород со степенью окисления, равной нулю, а восстановителем — атом иода в HI, имеющий степень окисления —1. Процесс окисления-восстановления можно изобразить схематически:
Суммируя эти две полуреакции так, чтобы результирующий заряд полной реакции был равен нулю, получаем полную окислительно-восстановительную реакцию (3.1). Такой метод расчета стехиометрических коэффициентов окислительно-восстановительных реакций получил название метода молекулярно-электронного баланса.
Рассмотрим окислительно-восстановительные реакции с участием пероксида водорода 


1. Пероксид водорода в качестве окислителя

восстановление +3 +6

В качестве коэффициентов в левую часть реакции (3.2) вводим полученные из баланса зарядов окислительно-восстановительные множители I и 3, получая
Здесь окислителем является молекулярный кислород со степенью окисления, равной нулю, а восстановителем —атом иода в HI, имеющий степень окисления —1. Процесс окисления-восстановления можно изобразить схематически:

Суммируя эти две полуреакции так, чтобы результирующий заряд полной реакции был равен нулю, получаем полную окислительно-восстановительную реакцию (3.1). Такой метод расчета стехиометрических коэффициентов окислительно-восстановительных реакций получил название метода молекулярно-электронного баланса.
Рассмотрим окислительно-восстановительные реакции с участием пероксида водорода Н 


1. Пероксид водорода в качестве окислителя

В качестве коэффициентов в левую часть реакции (3.2) вводим полученные из баланса зарядов окислительно-восстановительные множители 1 и 3, получая
высокотемпературной оксидной н галогенндной металлотермии
Иначе рассчитывают коэффициенты ионных окислительно-восстановительных реакций в водных растворах с помощью метода ионно-электронного баланса.
Рассмотрим в качестве примера окисление сульфида мышьяка 

Условно разделим весь процесс на две ионные полуреакции окисления И восстановления. Полуреакция окисления 

Поскольку в правой части схемы имеется 20 атомов кислорода, в левой части перед 
Введением этих коэффициентов получают баланс по числу атомов, но не по зарядам ионов, так как суммарный заряд левой части равен нулю, а правой +28. Следовательно, полный баланс этой полуреакции будет иметь место, если из левой части вычесть 28 единичных зарядов:
Полуреакция восстановления азотной кислоты HNO3 может быть записана аналогичным образом:

Сложение этих двух полуреакций следует производить так, чтобы суммарный заряд системы веществ стал равен нулю:
Полученное уравнение полностью отвечает требованиям баланса по числу атомов и по зарядам.
В качестве второго примера расчета стехиометрических коэффициентов ионных окислительно-восстановительных реакций методом ионно-электронного баланса рассмотрим следующий процесс:
Записываем в ионной форме две полуреакции окисления 
Полученное ионное уравнение является сбалансированным и по числу атомов, и по зарядам.
Для реакций окисления — восстановления с участием органических соединений характерно то, что в одних и тех же соединениях атому углерода по отношению к различным элементам следует приписывать различные степени окисления. Степень окисления углерода в соединениях с азотом, серой, кислородом, галогенами принимается равной +4, в оксиде углерода СО равна +2, а в соединении с водородом от —4 до —1, в соединениях атомов углерода друг с другом—0.
В ряду хлорпроизводных метана степень окисления углерода может изменяться от —4 до +4 (считая степень окисления хлора —1, а водорода -1):
В гомологическом ряду замещенных метана формальный заряд атома углерода в этане 






Следует отметить, что степень окисления углерода в органических соединениях определяет только соотношение атомов элементов в формуле (углерода, водорода, кислорода и др.) и не связана с их взаимным расположением. Поэтому степень окисления углерода в изомерах не изменяется при переходе от одной структуры к другой. Примером могут служить одинаковые по составу, но разные по строению и химической природе молекулы этилового спирта 

Рассмотрим в качестве примера процесс окисления этилового спирта до уксусной кислоты перманганатом ’калия, используя для расчета коэффициентов метод молекулярно-электронного баланса:

Расставив окислительно-восстановительные коэффициенты, получим уравнение реакции


Расставим окислителыю-восстановительные коэффициенты
и закончим решение расчетом коэффициентов процессов обменного разложения (с учетом образования воды):
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://himi4ka.ru/arhiv-urokov/urok-2-otnositelnaja-atomnaja-massa-himicheskih-jelementov.html
http://natalibrilenova.ru/osnovnyie-ponyatiya-i-zakonyi-himii/