Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
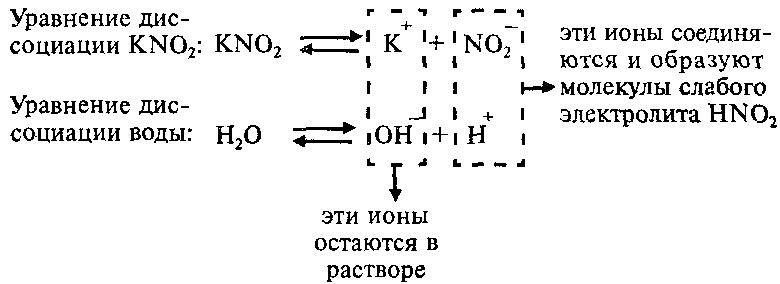
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
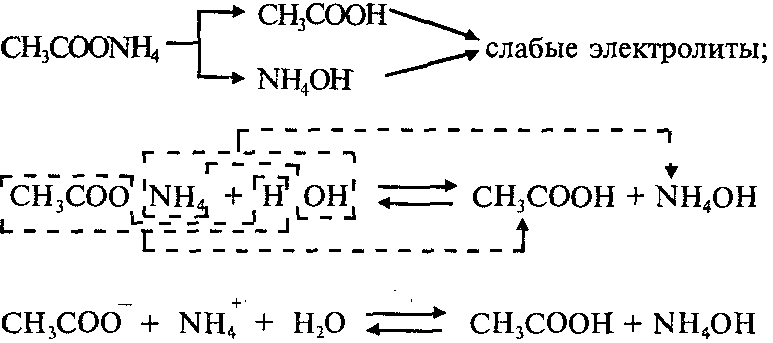
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
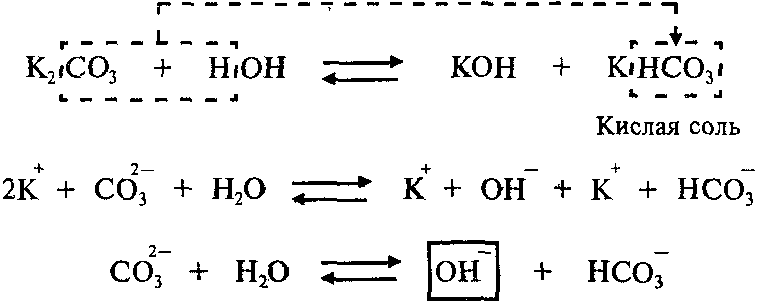
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Ацетат аммония уравнение реакции гидролиза
Ответ:
Ацетат аммония (CH3COONH4) — является средней солью, образованной слабым основанием (NH4OH) и слабой кислотой (CH3COOH) ⇒ гидролизуется по катиону и аниону. Характер среды — нейтральный.
CH3COONH4 + H2O ⇄ NH4OH + CH3COOH
NH4⁺ +H2O ⇄ NH4OH + H⁺ (по катиону)
CH3COO⁻ + H2O ⇄ CH3COOH + OH⁻ (по аниону)
CH3COONH4 ⇄ NH4⁺ + CH3COO⁻
Сульфид натрия (Na2S) — является средней солью, образованной сильным основанием (NaOH) и слабой кислотой (H2S) ⇒ гидролизуется по аниону. Характер среды — щелочной.
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7/2004
§ 7.3. Соли. Гидролиз
2. Соль образована слабой кислотой и сильным основанием, например ацетат натрия NaCH3COO, карбонат натрия (сода) Na2CO3, нитрит натрия NaNO2, сульфит натрия Na2SO3, сульфид натрия Na2S, цианид натрия NaCN.
Карбонат натрия диссоциирует:
Na2CO3 = 2Na + + 
Гидролизу подвергается карбонат-ион. Гидролиз проходит в две ступени:



В водном растворе гидролиз по второй ступени не проходит – из раствора соды углекислый газ не выделяется. Чтобы гидролиз прошел по второй ступени, равновесие следует сместить вправо добавлением в раствор кислоты (ионов водорода). Образующаяся при этом неустойчивая угольная кислота распадается на углекислый газ и воду:
Обычно приводимое в учебниках химии уравнение реакции между карбонатом натрия и кислотой с образованием углекислого газа
представляет собой смещенную вправо реакцию гидролиза. Кроме того, это не реакция обмена, а реакция гидролиза, проходящая по второй ступени. Как реакция обмена она протекает при действии газообразного хлороводорода на кристаллический карбонат натрия.
Пример. Рассчитать рН 0,1М раствора карбоната натрия.
Будем считать, что гидролиз проходит только по первой ступени:


После преобразований константы гидролиза получаем:
В этом выражении Ккисл есть константа диссоциации иона 


Обратите внимание, что в расчете используется константа диссоциации кислоты H2CO3 по второй ступени!
Для угольной кислоты из справочных данных находим:
Н2СО3 =  + Н + + Н + | К1 = 4,31•10 –7 , |
 = =  + Н + + Н + | К2 = 5,61•10 –11 . |
Эти данные подставляем в формулу:
рОН = –lg 4,22•10 –3 = 2,4,
рН = 14 – рОН = 11,6.
При какой концентрации раствора гидроксида натрия в воде достигается то же значение рН? Рассчитайте. Можно дать приблизительный ответ.
А как быть, если вас попросят написать уравнение гидролиза кислой соли, например гидрокарбоната натрия NaHCO3? Если вы сразу же напишите уравнение диссоциации соли
NaHCO3 = Na + + 
то, очевидно, гидролизу подвергается ион 

Образование неустойчивой угольной кислоты приводит к тому, что уже при слабом нагревании начинается выделение из раствора углекислого газа (тесто с добавленным в него пекарским порошком «поднимается»).
По теории кислот и оснований И.Н.Брёнстеда кислотный ион может быть и кислотой, и основанием в зависимости от того, записано ли уравнение реакции гидролиза или уравнение взаимодействия с ионом водорода:
3. Соль образована слабым основанием и слабой кислотой, например ацетат аммония NH4CH3COO, гидрокарбонат аммония NH4HCO3, гидросульфит аммония NH4HSO3, нитрит аммония NH4NO2. Гидролиз такой соли рассмотрим на примере ацетата аммония, диссоциирующего в водном растворе по уравнению
NH4CH3COO = 
Оба иона этой соли образуют с водой слабые электролиты – гидроксид аммония и уксусную кислоту, поэтому реакцию гидролиза можно описать одним общим уравнением:

В связи с тем, что константы диссоциации уксусной кислоты СН3СООН и гидроксида аммония NН4ОН примерно одинаковы, концентрации ионов водорода и гидроксид-ионов также примерно равны, и поэтому раствор ацетата натрия имеет примерно нейтральную среду, рН 
Гидролиз соли (NH4)2S, диссоциирующей по уравнению
(NH4)2S = 2 
проходит по двум ступеням:


В отличие от двух предыдущих вариантов гидролиза (соль образована сильной кислотой и слабым основанием или слабой кислотой и сильным основанием) в данном случае рН раствора не зависит от концентрации соли (но зависит от того, какой из одноименных ионов дополнительно введен в раствор).
4. Соль образована сильным основанием и сильной кислотой. Такая соль и ее ионы гидролизу не подвергаются. Примеры таких солей: хлорид натрия NaCl, сульфат натрия Na2SO4,
нитрат натрия NaNO3.
Растворы таких солей почти нейтральны, рН 
Выражения константы гидролиза включают ионное произведение воды и константы диссоциации образующихся слабых электролитов. При повышении температуры ионное произведение воды в значительно большей степени возрастает по сравнению с константами диссоциации слабых кислот и оснований. В связи с этим константа гидролиза должна возрастать, показывая, что равновесие гидролиза смещается вправо, в сторону продуктов (гидролиз сопровождается поглощением теплоты, 
Часто смещение равновесия гидролиза вправо можно вызвать удалением продуктов реакции. При нагревании раствора сульфида аммония (NH4)2S растворимость аммиака NH3 и сероводорода H2S в воде понижается, они уходят из сферы реакции (в лабораторной практике гидролиз проходит в открытых системах), и равновесие гидролиза резко смещается вправо.
Гидролиз, сопровождающийся удалением продуктов из зоны реакции (газ или осадок), часто условно называют необратимым гидролизом (не в термодинамическом смысле!).
Сульфид алюминия Al2S3 в водном растворе существовать не может, получить его взаимодействием ионов алюминия и сульфид-ионов не удается. При сливании растворов хлорида алюминия и сульфида натрия выпадает осадок гидроксида алюминия Al(OH)3 и выделяется сероводород H2S. Сульфид алюминия можно получить реакцией между металлическим алюминием (опилки, порошок) и серой (порошок). Если полученное кристаллическое вещество Al2S3 поместить в воду, то протекает реакция гидролиза:
При сливании растворов хлорида алюминия и сульфида натрия проходит реакция
Примером необратимого гидролиза можно считать реакции карбидов кальция и алюминия с водой при получении ацетилена и метана соответственно:
С практической и теоретической точек зрения важно обсудить вопрос о среде фосфатов натрия. Раствор фосфата натрия Na3PO4 (0,1М) имеет основную реакцию с рН 


Раствор Na2HPO4 (0,1М) также имеет основную среду с рН 
1) гидролиз иона:


2) диссоциация иона 


Количества ионов Н + и ОН – , образующихся по этим двум реакциям, примерно одинаковы, поэтому среда раствора близка к нейтральной.
Раствор NaH2PO4 (0,1М) имеет кислотную среду раствора с рН 



Следовательно, при объяснении среды таких растворов, как по-разному замещенные фосфаты натрия, необходимо учитывать и гидролиз соли, и ее диссоциацию.
Рассмотренный выше сокращенный молекульно-ионный способ написания уравнений гидролиза, например:
Al 3+ + H2O = AlOH 2+ + H + ,
удобен для вычисления константы гидролиза, рН раствора и концентраций ионов. Однако в водном растворе все катионы гидратированы, причем связи шести ближайших молекул воды с катионом довольно прочные, уравнение реакции гидролиза правильнее записывать так:
Координационное число иона алюминия, равное шести, в этом процессе сохраняется. Можно записать это уравнение по-другому, если ион гидроксония заменить на ион водорода:
Это уравнение отражает не гидролиз, а диссоциацию комплексного иона [Al(H2O)6] 3+ как слабой кислоты.
Этот пример ярко показывает, что одно и то же явление может быть объяснено по-разному, в зависимости от уровня наших знаний и целей описания.
Напишите уравнения дальнейшей диссоциации иона [Al(H2O)6] 3+ , помня, что гидроксид алюминия Al(ОН)3 выпадает в осадок.
Список новых и забытых понятий и слов
http://megamozg.com/task/12981352
http://him.1sept.ru/article.php?ID=200401103