Используя метод электронного баланса, составьте уравнение реакции I2 + HNO3 → HIO3 + NO + H2O Определите окислитель и восстановитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Реакция взаимодействия йода и азотной кислоты
Реакция взаимодействия йода и азотной кислоты
Уравнение реакции взаимодействия йода и азотной кислоты:
Реакция взаимодействия йода и азотной кислоты.
В результате реакции образуются йодноватая кислота, оксид азота (IV) и воды.
Для проведения реакции используется концентрированный раствор (60 %) азотной кислоты.
Реакция протекает при нормальных условиях.
Формула для поиска по сайту: I2 + 10HNO3 → 2HIO3 + 10NO2 + 4H2O.
Реакция взаимодействия фторида иттрия (III) и кальция
Реакция взаимодействия гидроксида натрия и хлора
Реакция взаимодействия оксида натрия и оксида алюминия
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
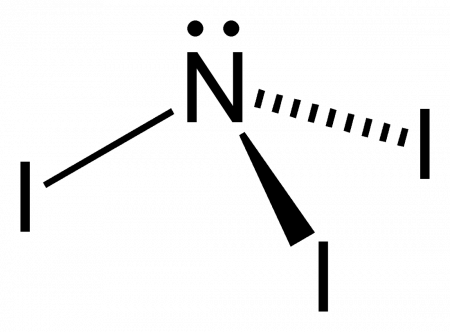
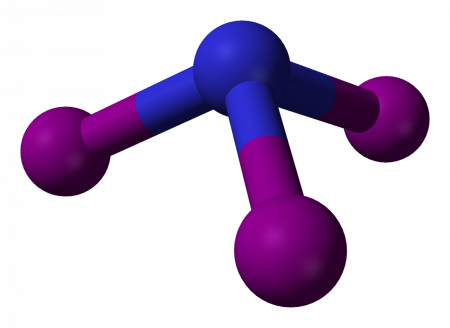
Нитрид трийода
| Нитрид трийода | |||
|---|---|---|---|
| |||
| Систематическое наименование | Йодид азота | ||
| Хим. формула | NI3 | ||
| Состояние | кристаллы | ||
| Молярная масса | 394.77 г/моль | ||
| Температура | |||
| • кипения | возгоняется при — 20 °C | ||
| • разложения | от 0 до 25 С | ||
| Рег. номер CAS | 13444-85-4 | ||
| PubChem | 61603 | ||
| SMILES | |||
| ChemSpider | 55511 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
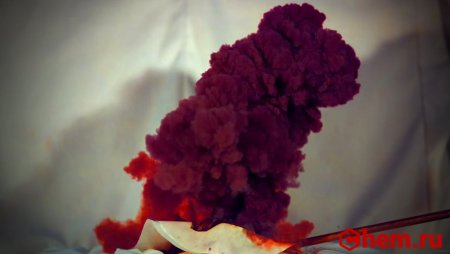
Нитрид трийода (иногда йодистый азот, ошиб. азид йода) — чрезвычайно взрывчатое неорганическое соединение с формулой NI3. Обычно известен в виде чёрно-коричневых кристаллов — аддукта с аммиаком NI3· n NH3 (аммиаката), но был получен и в индивидуальном виде реакцией BN с IF при низких температурах.
Представляет собой чёрные кристаллы, очень чувствительные к механическим воздействиям. В сухом виде взрывается от прикосновения, образуя розовато-фиолетовое облако паров йода. Это единственное вещество, которое взрывается под воздействием альфа-частиц и других продуктов ядерного распада.
Содержание
Свойства
Аддукт нитрида йода разлагается при взаимодействии с диэтилцинком:
Благодаря именно этой реакции установлено строение аддукта йодида азота с аммиаком http://pubs.rsc.org/en/content/articlepdf/1905/ct/ct9058700055 [2]
Во влажном виде при наличии избытка аммиака в растворе сравнительно устойчив. Единственное известное взрывчатое вещество, способное сдетонировать от альфа-излучения. Из-за крайней нестабильности применяется исключительно как эффектный химический фокус.
Нестабильность вещества вызвана большой длиной связи N−I и огромными размерами трёх атомов йода, приходящихся на один атом азота, и соответственно низкой энергией активации реакции разложения.
Нерастворим в этаноле. Разлагается горячей водой, кислотами-окислителями, щелочами.
Разложение чистого вещества протекает по следующей реакции:
Аммиак, который присутствует в аддукте, является восстановителем для образующегося йода:
Нитрид трийода подвергается гидролизу с образованием оксида азота III и йодоводородной кислоты:
Получение
Получают взаимодействием водного раствора аммиака (нашатырный спирт) — обычно 25 % и спиртового раствора йода в соотношении 1:2. При смешивании выпадает чёрный или бурый осадок, представляющий собой продукт присоединения аммиака к нитриду трийода.
Возможно использование кристаллического йода вместо раствора, в этом случае кристаллы йода поливают раствором аммиака. При реакции с безводным аммиаком в условиях низких температур образующийся продукт имеет состав NI3 ⋅ (NH3)5 , при нагревании он начинает терять часть аммиака.
Осадок может быть очищен от примеси аммиака промыванием спиртом, но при этом его детонационная чувствительность сильно возрастает.
Биологическая роль
Йодид азота III — потенциально опасное вещество. Является ирритантом (в очень больших количествах), взрывоопасен.
http://chemicalstudy.ru/reaktsiya-vzaimodejstviya-joda-i-azotnoj-kisloty/
http://chem.ru/nitrid-trijoda.html