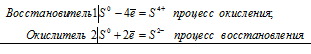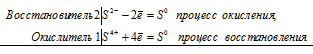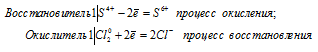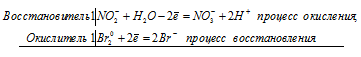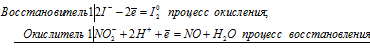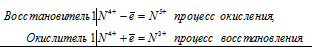Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составьте уравнения реакций HNO2: а) с бромной водой
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e19fc53eca20095 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Реакции диспропорционирования (самоокисления-самовосстановления)
Задание 370
Почему атомы большинства р-элементов способны к реакциям диспропорционирования (самоокисления-самовосстановления)? На основании электронных уравнений напишите уравнение реакции серы в концентрированном растворе щелочи. Один из продуктов содержит серу в степени окисления +4.:
Решение:
Атомы р-элементов имеют конфигурацию внешнего электронного слоя ns 2 np (1-6) . Большинство из них способны к диспропорционированию, потому что атомы многих из них содержат на внешнем электронном слое такое количество электронов, что могут их отдавать или же присоединять, т. е. одновременно уменьшать и увеличивать свою степень окисления. Например, сера содержит на внешнем электронном слое шесть электронов два s-электрона и четыре р-электрона. Благодаря наличию свободных d-орбиталей степень окисления серы меняется от -2 до +6. Сера может одновременно менять свою степень окисления от 0 до -2 и от 0 до +6.
Уравнение реакции серы в концентрированном растворе щелочи:
3S 0 = S 4+ + 2S 2-
Задание 371
Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций Н2SO3: а) с сероводородом; б) с хлором.
Решение:
Поскольку в Н2SO3 атом серы находится в своей промежуточной степени окисления +4, то возможны процессы восстановления и окисления, т. е. сера в сернистой кислоте может присоединять электроны, понижая свою степень окисления, а также отдавать электроны, повышая свою степень окисления. Например, легко протекает реакция H2SO3 с сероводородом и с хлором:
а) реакция сернистой кислоты с сероводородом:
2S 2- + S 4+ = 3S 0
б) реакция сернистой кислоты с хлором
Cl2 0 + S 4+ = S 6+ + 2Cl —
З адание 373
Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций НNO2: а) с бромной водой; б) с HI.
Решение:
Поскольку в НNO2 азот находится в своей промежуточной степени окисления +3, то азотистая кислота в окислительно-восстановительных реакциях может быть как восстановителем, так и окислителем. Сильные окислители переводят NO 2- в NO3 — . Сильные восстановители обычно восстанавливают НNO2 до NO. Азотистая кислота способна также к реакциям самоокисления-самовосстановления, которых азот как уменьшает, так и увеличивает свою степень окисления.
Уравнения реакций НNO2 с бромной водой и с HI:
а) реакция азотистой кислоты НNO2 с бромной водой
б) реакция НNO2 с HI:
NО 2- + 2I — +4H + = NО + I2 0 + 2H2O
Задание 374
Почему диоксид азота способен к реакциям самоокисления-самовосстановления (диспропорционирования)? На основании электронных уравнений напишите уравнение реакции растворения NO2 в гидроксиде натрия.
Решение:
Поскольку в NO2 азот находится в своей промежуточной степени окисления +4, то диоксид азота может вступать в реакции самоокисления-самовосстановления, в которых атом азота одновременно уменьшает и увеличивает свою степень окисления.
Уравнение реакции растворения NO2 в гидроксиде натрия:
Задание 377
Почему фосфористая кислота способна к реакциям самоокисления — самовосстановления диспропорционирования)? На основании электронных уравнений составьте уравнение процесса разложения Н3РО3, учитывая, что при этом фосфор приобретает низшую и высшую степени окисления.
Решение:
Поскольку в молекуле Н3РО3 атом фосфора находится в своей промежуточной степени окисления +3, то фосфористая кислота диспропорционирует, т. е. атомы фосфора в реакции самоокисления-самовосстановления одновременно могут, как увеличивать свою степень окисления, так и уменьшать её. Так при нагревании Н3РО3 диспропорционирует с образованием Н3РО4 и РН3:
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/373.html
http://buzani.ru/zadachi/khimiya-shimanovich/981-reaktsii-disproportsionirovaniya-zadaniya-370-371-373-374-377