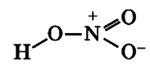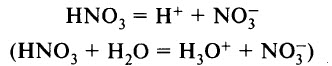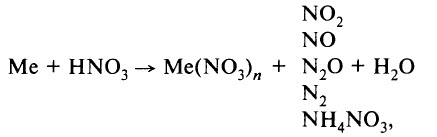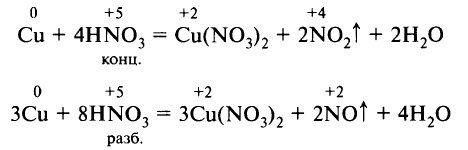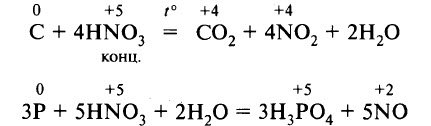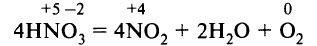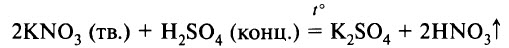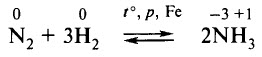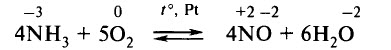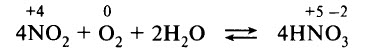Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
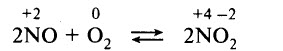
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
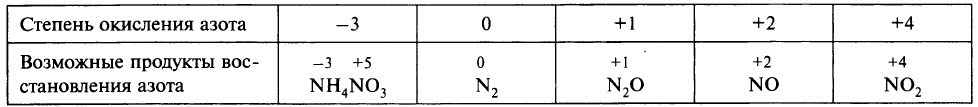
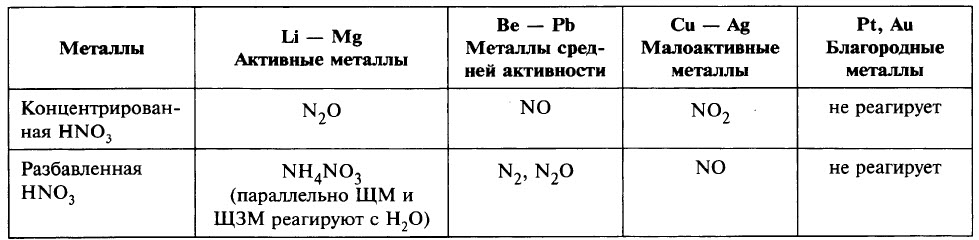
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотная кислота (HNO3)
Строение молекулы азотной кислоты:
Связь N + -O — образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Физические свойства азотной кислоты:
- бесцветная маслянистая жидкость с резким запахом;
- температура кипения 83°C
- плотность 1,4 г/см 3 (63% HNO3);
- с водой смешивается в любых пропорциях, проявляя в водных растворах свойства сильной кислоты;
- легко разлагается на свету при длительном хранении, приобретая при этом желтый оттенок, в который ее окрашивает газ NO2, выделяющийся при разложении:
4HNO3 ↔ 2H2O+4NO2↑+O2↑
Химические свойства азотной кислоты
HNO3 является одной из самых сильных кислот — в водных растворах полностью диссоциирует на катионы водорода и нитрат-ионы:
HNO3 ↔ H + +NO3 —
Азотная кислота вступает в реакции:
Следует обратить внимание, что азотная кислота в обменных реакциях может взаимодействовать далеко не со всеми солями, а лишь только с теми, при реагировании с которыми образуются нерастворимые, слабодиссоциирующие и газообразные вещества, которые, по мере их образования, более не участвуют в реакции обмена. В обменных реакциях солями, при взаимодействии с которыми образуются растворимые в воде соли азотной кислоты, азотная кислота не участвует.
В окислительно-восстановительных реакциях азотная кислота выступает в роли сильного окислителя. Высокие окислительные свойства HNO3 объясняются тем, что в молекуле азотной кислоты атом азота в составе кислотного остатка NO3 — имеет максимально возможную степень окисления +5. По этой причине окислительные свойства NO3 — значительно превосходят «возможности» катионов водорода H + , из-за чего азотная кислота реагирует практически со всеми металлами за исключением золота,платины, родия, рутения, иридия и тантала, стоящими в конце ряда напряжений.
Характерной особенностью взаимодействия азотной кислоты с металлами является отсутствие выделения водорода, поскольку окислителями являются не катионы водорода, а нитрат-ионы NO3 — , которые, при взаимодействии азотной кислоты с металлами восстанавливается тем полнее, чем более активным является металл и чем более разбавленной является HNO3.
По этой причине образование тех или иных продуктов реакции азотной кислоты и металла зависит от концентрации кислоты и активности металла.
Атом азота в молекуле азотной кислоты имеет степень окисления +5, и может принимать 1, 2, 3, 4, 5 или 8 электронов:
Чем более концентрированной является азотная кислота, тем меньшей окислительной способностью по отношению к металлам она обладает.
С другой стороны, чем более активным является металл, тем в большей степени он восстанавливает азотную кислоту.
Примеры реакций азотной кислоты:
- концентрированная HN +5 O3 с активными металлами (до алюминия в ряду напряжений) восстанавливается до N2O
10HN +5 O3+4Ca 0 = 4Ca +2 (NO3)2+N2 +1 O↑+5H2O - концентрированная HN +5 O3 с неактивными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN +5 O3+Ni 0 = Ni +2 (NO3)2+2N +4 O2↑+2H2O - концентрированная HN +5 O3 с неметаллами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN +5 O3+P 0 = HP +5 O3+5N +4 O2↑+2H2O - разбавленная HN +5 O3 с активными металлами (до алюминия в ряду напряжений) образует аммиак или нитрат аммония
10HN +5 O3+4Mg 0 = 4Mg +2 (NO3)2+N -3 H4N +5 O3+3H2O - разбавленная HN +5 O3 с неактивными металлами образует оксид азота (II)
8HN +5 O3+3Cu 0 = 3Cu +2 (NO3)2+2N +2 O↑+4H2O - разбавленная HN +5 O3 с неметаллами образует оксид азота (II)
2HN +5 O3+S 0 = H2S +6 O4+2N +2 O↑
Концентрированная азотная кислота пассивирует алюминий, железо и хром, образуя на их поверхности очень прочную нерастворимую оксидную пленку:
2Al+6HNO3 = Al2O3+6NO2+3H2O
«Царская водка» (смесь концентрированной азотной кислоты с соляной в соотношении 1:3) окисляет золото и платину:
Au+3HNO3+3HCl = AuCl3+3NO2+3H2O
Получение и применение азотной кислоты
Промышленный способ получения азотной кислоты:
- окислением аммиака на платиновом катализаторе до оксида азота (II):
4N -3 H3+5O2 0 = 4N +2 O -2 +6H2O - окислением оксида азота (II) до оксида азота (IV):
2N +2 O -2 +O2 0 = 2N +4 O2 -2 - растворением оксида азота (IV) в воде в присутствии кислорода (автор способа И.И.Андреев, 1916 г.):
4N +4 O2+2H2O+O2 0 = 4HN+5O3 -2
Лабораторный способ получения азотной кислоты:
- взаимодействием безводных нитратов с концентрированной серной кислотой:
NaNO3+H2SO4 = NaHSO4+HNO3
Применение азотной кислоты:
- производство азотных удобрений;
- в фармакологии для производства лекарственных препаратов;
- в производстве взрывчатых веществ.
Соли азотной кислоты
О солях азотной кислоты, наверняка, слышали многие, ведь в последнее время так много говорят о вреде нитратов в овощах и фруктах.
Нитраты калия, натрия, аммония и кальция называются селитрами (калийная селитра, натриевая селитра, аммонийная селитра, известковая селитра). Селитры нашли широкое применение в сельском хозяйстве в качестве минеральных азотных удобрений, что вполне логично, ибо азот является одним из основных элементов растений.
Нитраты хорошо растворяются в воде, при этом такие растворы не обладают окислительными свойствами, а вот расплавы нитратов являются хорошими окислителями.
Те нитраты, которые были образованы слабыми основаниями, гидролизуются, их водные растворы являются кислыми:
Cu 2+ (NO3)2+ H2O ↔ CuOH + NO3+ H + NO3
Соли азотной кислоты являются сильными окислителями.
Все нитраты, за исключением нитрата аммония разлагаются с выделением кислорода, при этом образующиеся продукты разложения зависят от электроотрицательности металла (см. таблицу выше):
- соли металлов, расположенных в ряду напряжений левее магния, при разложении образуют кроме кислорода еще и нитриты:
MeN +5 O3 → MeN +3 O2+O2 0 ↑
2KNO3 = 2KNO2+O2 - соли металлов, расположенных от магния до меди — образуют оксиды металла и азота (IV):
MeN +5 O3 → MeO+N +4 O2↑+O2 0 ↑
2Pb(NO3)2 = 2PbO+4NO2+O2 - соли металлов, расположенных правее меди — образуют свободный металл и оксид азота (IV):
MeN +5 O3 → Me+N +4 O2↑+O2 0 ↑
2AgNO3 = 2Ag+2NO2+O2 - нитрат аммония разлагается с образованием оксида азота (I) и воды:
NH4NO3 = N2O+2H2O
Нитраты вступают в реакции, типичные для всех солей:
Получение и применение нитратов
Нитраты получают реакцией азотной кислоты:
- Селитры используются в качестве минеральных удобрений:
- KNO3 — калийная или индийская селитра;
- NaNO3 — натриевая или чилийская селитра;
- NH4NO3 — аммонийная селитра;
- Ca(NO3)2 — известковая или норвежская селитра.
- Калийная селитра используется для изготовления «черного пороха».
- Аммонийная селитра используют для изготовления взрывчатого вещества — аммонала.
Другие соединения азота:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Азотная кислота физические свойства уравнение реакции
Ключевые слова конспекта: азотная кислота, строение молекулы, физические и химические свойства, получение, применение азотной кислоты.
СТРОЕНИЕ МОЛЕКУЛЫ И
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
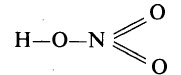
Высшим гидроксидом азота является азотная кислота HNO3. Азотная кислота – вещество молекулярного строения. В молекуле HNO3 химические связи ковалентные полярные. Графическая формула азотной кислоты:
В азотной кислоте степень окисления азота равна +5, а его валентность – IV. Азот не может быть пятивалентным, так как на втором энергетическом уровне нет вакантных орбиталей, необходимых в этом случае для возбуждения атома. Одна из электронных пар атома азота принадлежит одновременно трём атомам: двум атомам кислорода и атому азота – трёхцентровая связь.
При обычных условиях азотная кислота – бесцветная жидкость, примерно в 1,5 раза тяжелее воды, летуча, «дымит» на воздухе, смешивается с водой в любых соотношениях. Часто концентрированный раствор азотной кислоты окрашен в жёлтый цвет, который придаёт раствору оксид азота (IV) NO2, выделяющийся вследствие частичного разложения HNO3.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота является сильной одноосновной кислотой, в водном растворе диссоциирует на ионы:
Ион Н3O + можно обнаружить в растворе с помощью индикатора: лакмус меняет цвет с фиолетового на красный, метиловый оранжевый – с оранжевого на красный.
Азотная кислота проявляет общие свойства кислот. Она реагирует:
- а) со щелочами (реакция нейтрализации):
КОН + HNO3 = KNO3 + H2O
OH – + Н + = H2O
- б) с нерастворимыми в воде основаниями:
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Mn(OH)2 + 2Н + = Mg 2+ + 2H2O
- в) с амфотерными гидроксидами:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2Н + = Zn 2+ + 2H2O
- г) с основными и амфотерными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + 2H2O
CuO + 2Н + = Cu 2+ + H2O
- д) с солями слабых и летучих кислот:
К2СO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
СО3 2– + 2Н + = CO2↑ + H2O
В то же время в молекуле азотной кислоты содержится атом азота в высшей степени окисления, что обусловливает специфические свойства азотной кислоты.
- Реакция с металлами. Азотная кислота взаимодействует со многими металлами, окисляя их не за счёт Н + , а за счёт азота в высшей степени окисления (+5). В результате таких реакций водород не образуется. Продуктами реакции являются нитрат металла, продукт восстановления азота и вода. Реакция идёт по схеме:
где Me – металл.
В ходе реакции обычно образуется смесь продуктов восстановления азота, и, как правило, один из них преобладает. Глубину восстановления азота иллюстрирует схема:
Восстановление азота до NO2 является менее глубоким по сравнению с восстановлением до NO и т. д.
Глубина восстановления азота зависит:
- от природы металла (от восстановительной способности металла; чем левее положение металла в электрохимическом ряду напряжений металлов, тем глубже восстановление азота);
- от концентрации азотной кислоты (в более концентрированных растворах происходит менее глубокое восстановление азота);
- от температуры (понижение температуры способствует более глубокому восстановлению);
- от чистоты азотной кислоты.
С азотной кислотой не реагируют:
- а) благородные металлы Au, Ru, Rh, Os, Ir, Pt вследствие слишком малой их восстановительной способности;
- б) некоторые металлы (Al, Сг, Fe) не реагируют с концентрированной (> 68%) азотной кислотой вследствие образования на поверхности металла плотной защитной оксидной плёнки – эти металлы пассивируются. Тем не менее при нагревании может происходить реакция окисления данных металлов.
Чтобы определить, какой из продуктов восстановления азота преобладает, при записи уравнения реакции можно ориентироваться данными таблицы.
Ещё раз обратим внимание, что в ходе реакции образуется смесь продуктов восстановления и преобладание того или иного продукта зависит от многих факторов.
Классическими примерами взаимодействия азотной кислоты с металлами является растворение меди в азотной кислоте:
- Реакции с неметаллами. Азотная кислота реагирует с некоторыми неметаллами, способными проявлять восстановительные свойства. Например, концентрированная азотная кислота реагирует с углём, фосфором, йодом. В результате восстановления образуются NO или NO2:
- Реакции со сложными веществами-восстановителями. Концентрированная азотная кислота является сильным окислителем, вступает в реакции с различными веществами, обладающими восстановительными способностями.
- Разложение при нагревании. При хранении, на свету или при нагревании концентрированная азотная кислота разлагается:
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТНОЙ КИСЛОТЫ
В лаборатории чистую азотную кислоту получают нагреванием кристаллической натриевой или калиевой селитры (KNO3, NaNO3) с концентрированной серной кислотой:
Образующиеся пары HNO3 конденсируют и собирают полученный продукт.
В основе промышленного получения азотной кислоты находится цепь синтезов:
Сырьём является азот, получаемый разделением жидкого воздуха на фракции. Сначала осуществляется синтез аммиака:
Аммиак окисляют кислородом на платиновом катализаторе:
Оксид азота (II) легко окисляется кислородом воздуха:
В заключение проводят поглощение диоксида азота водой в присутствии избытка кислорода:
Азотная кислота является одной из важнейших неорганических кислот. Её мировое производство достигает десятков миллионов тонн в год. Азотная кислота применяется для производства минеральных удобрений, нитрования органических веществ во многих органических синтезах (чаще всего для синтеза взрывчатых веществ, красителей и лекарств). Примерами органических продуктов нитрования являются нитробензол (требуется для синтеза анилина), тринитротолуол (тротил, тол), тринитроглицерин (для получения динамита), тринитрофенол (пикриновая кислота – взрывчатое вещество), тринитроцеллюлоза и т. д. Азотная кислота используется для травления металлов.
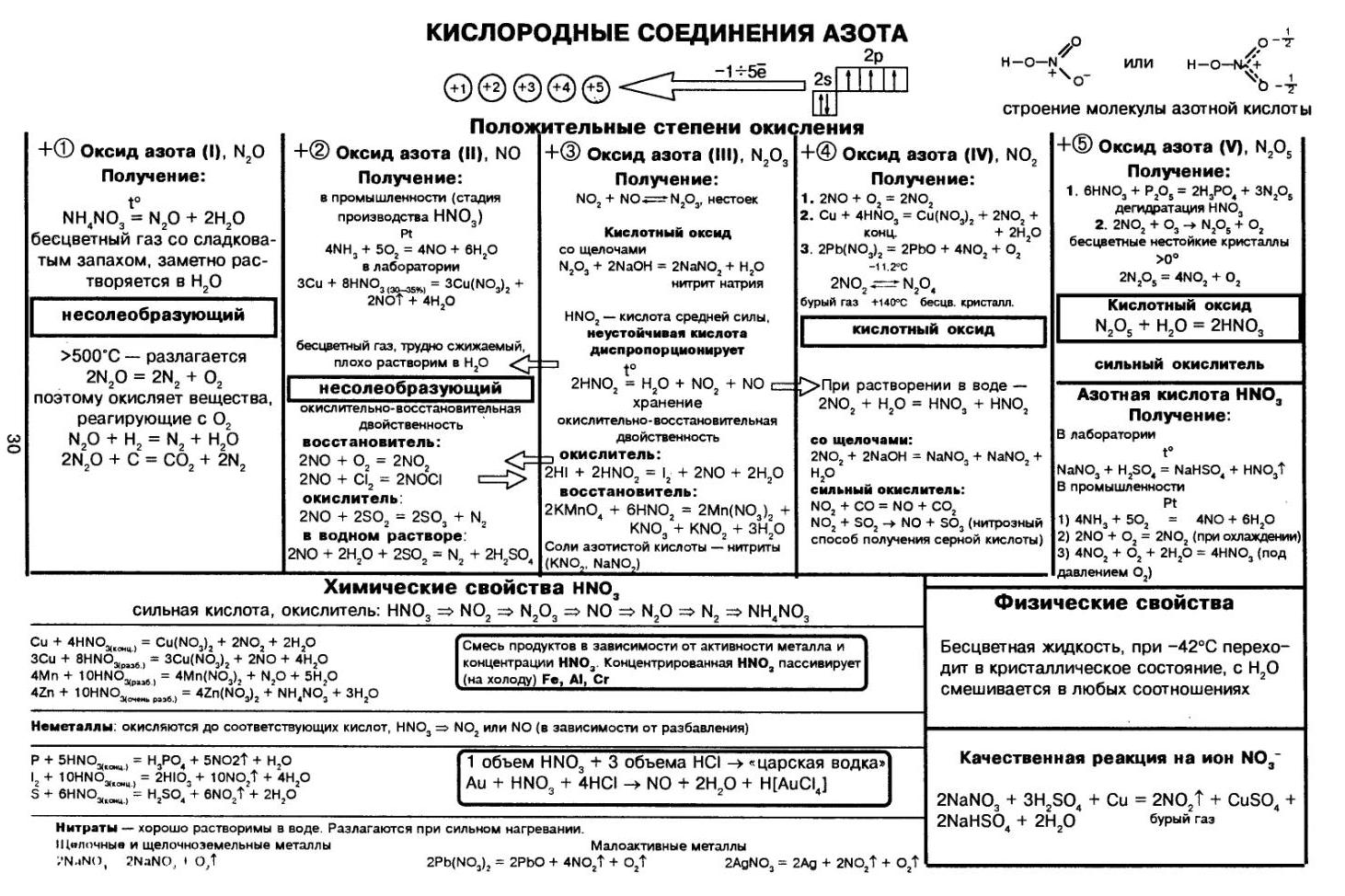
Всё про азотную кислоту кратко в одной таблице
Всё про азотную кислоту кратко в одной таблице
Конспект урока «Азотная кислота: строение, свойства, получение, применение».
http://prosto-o-slognom.ru/chimia/504_azotnaya_kislota_HNO3.html
http://uchitel.pro/%D0%B0%D0%B7%D0%BE%D1%82%D0%BD%D0%B0%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0/