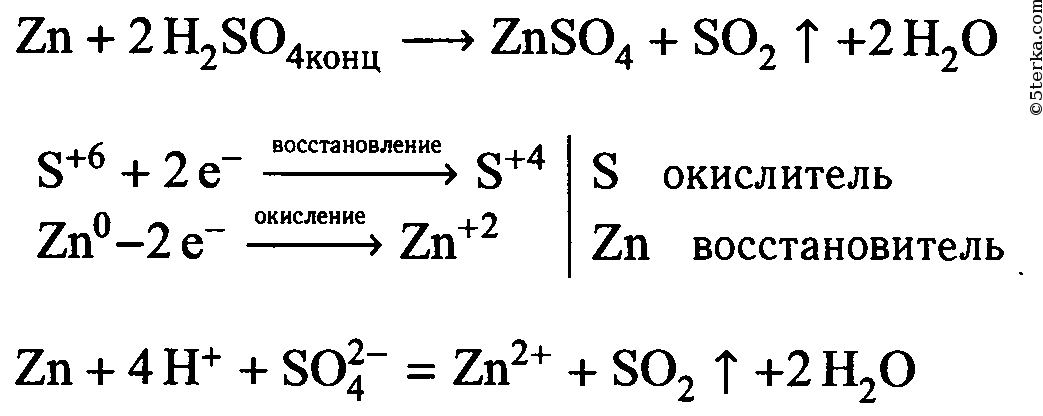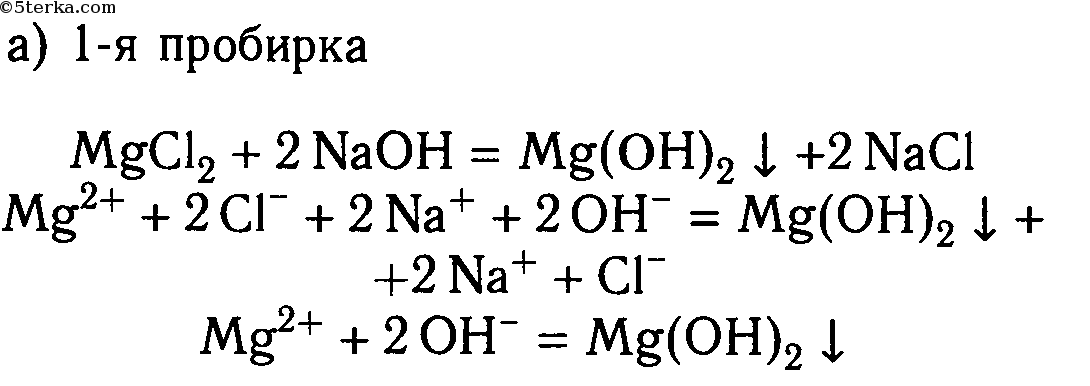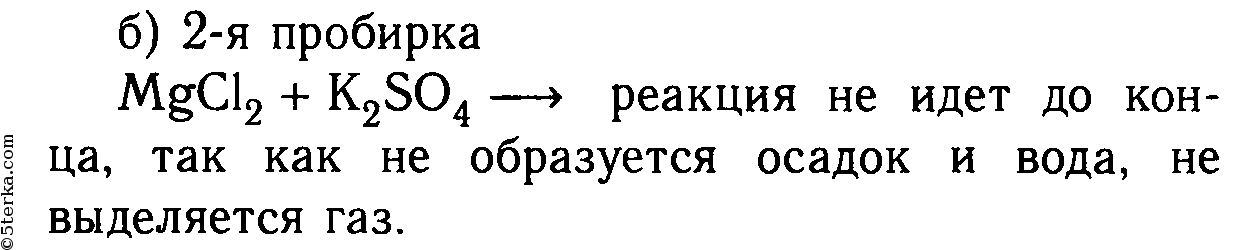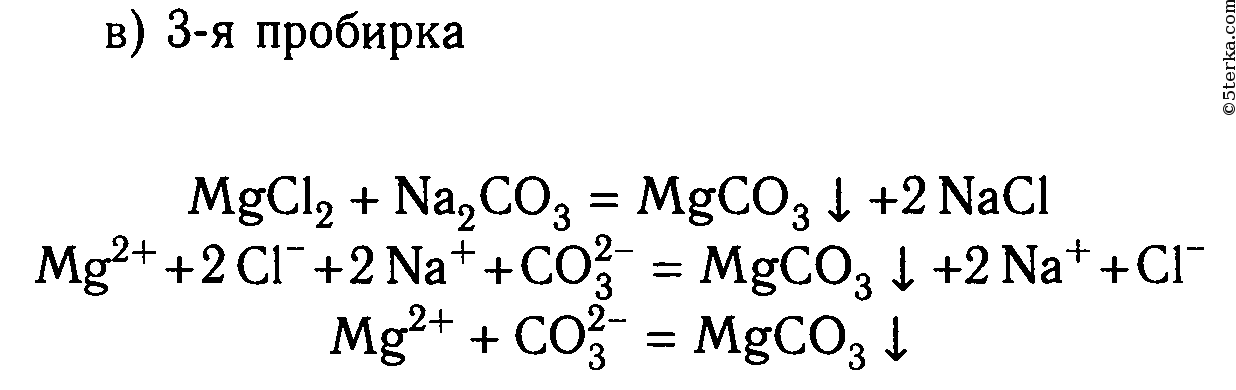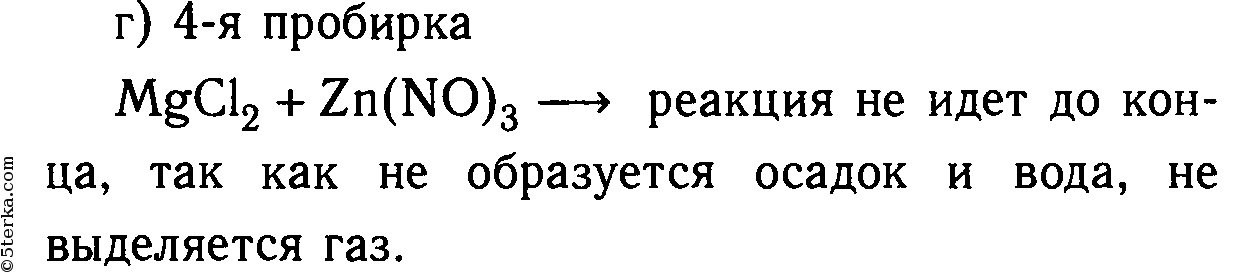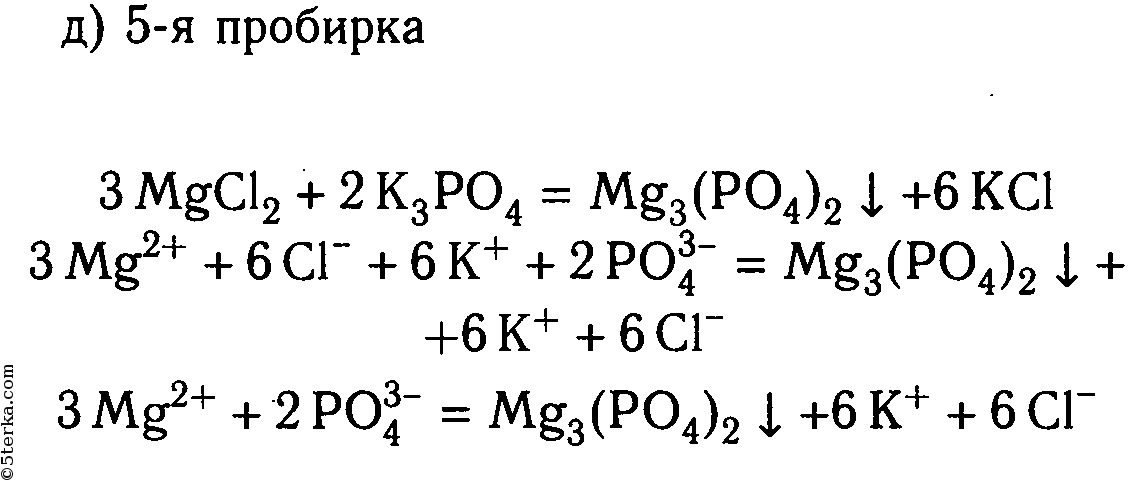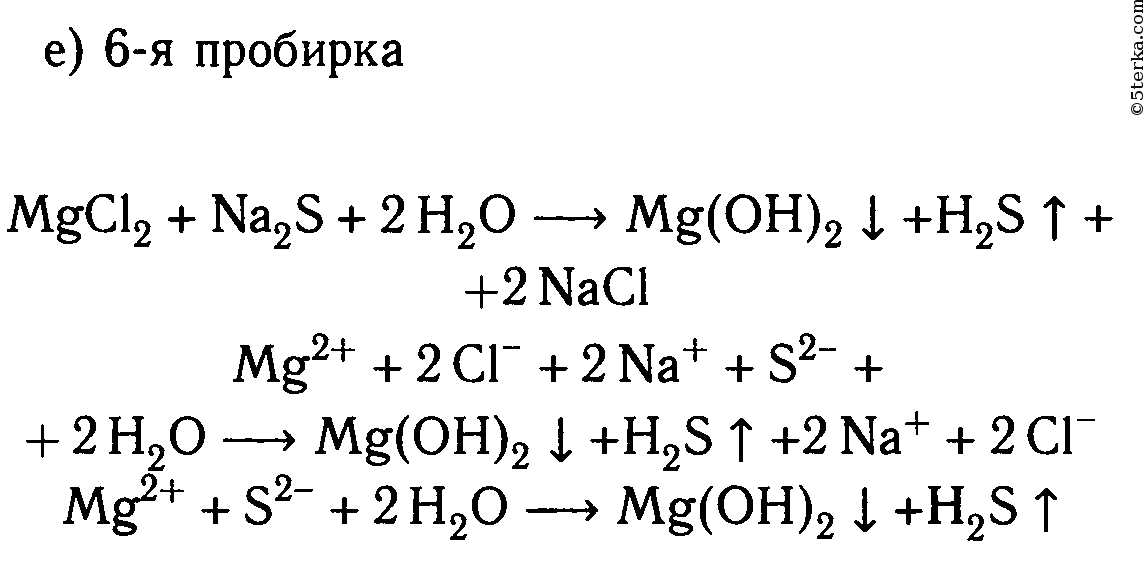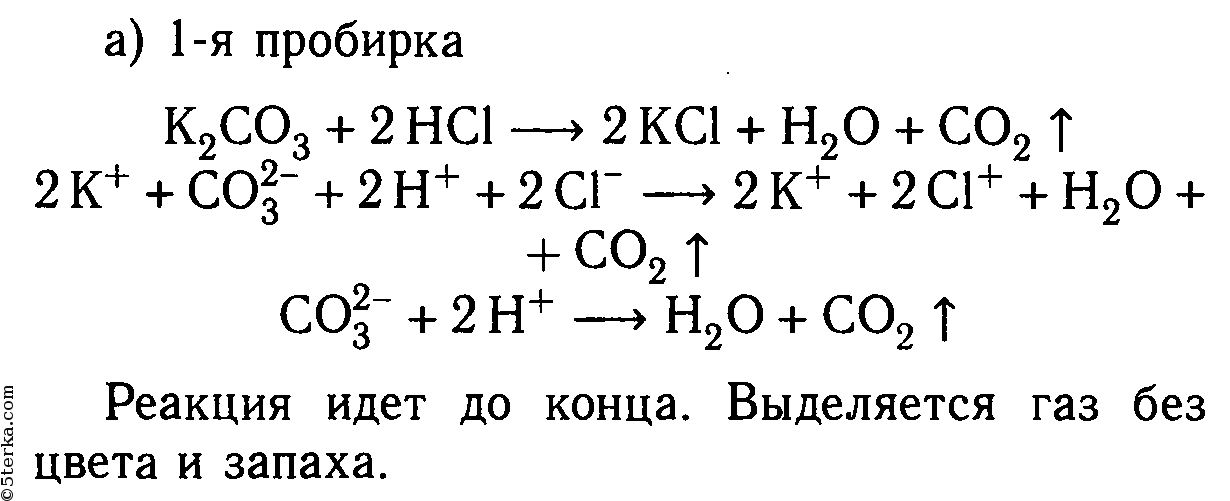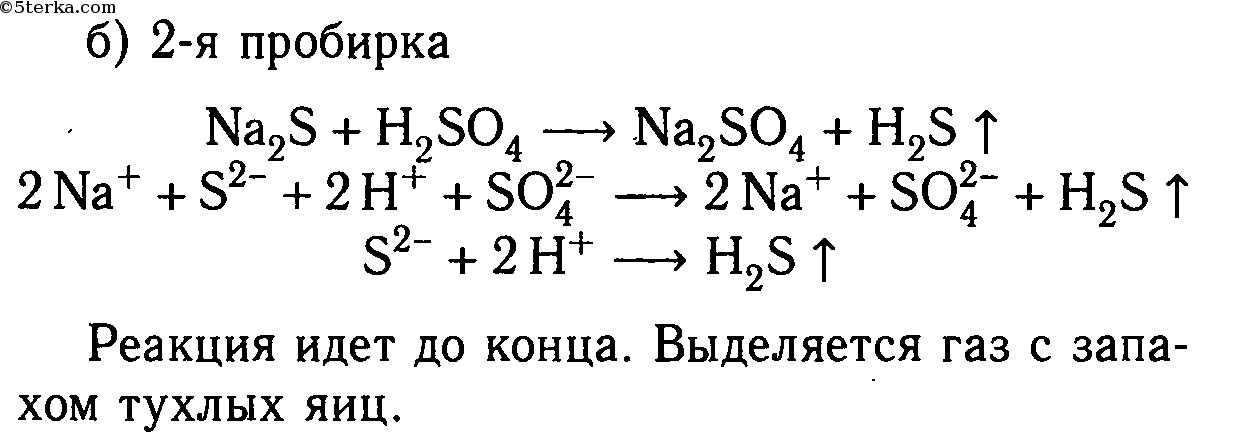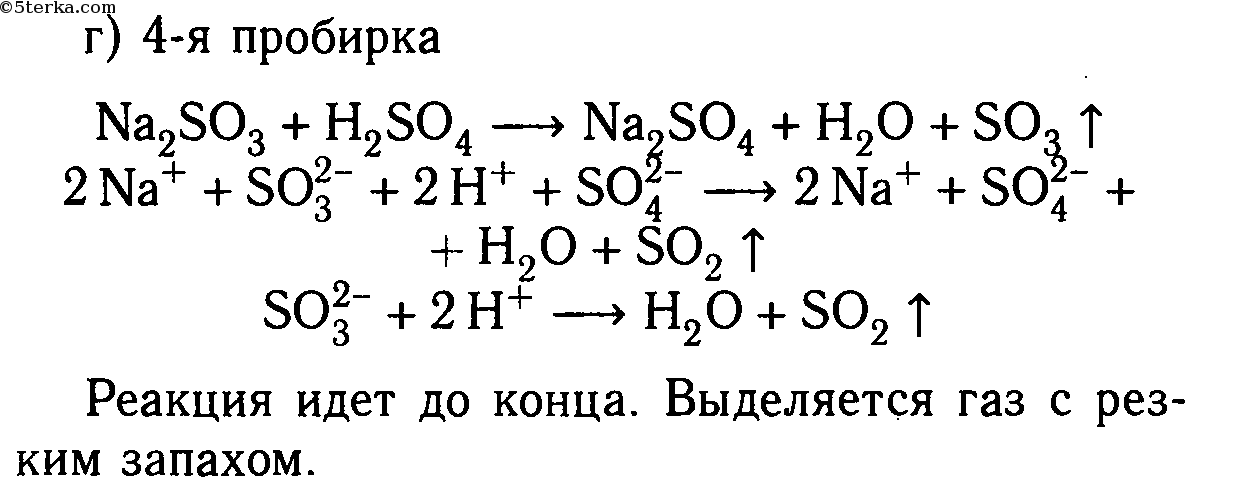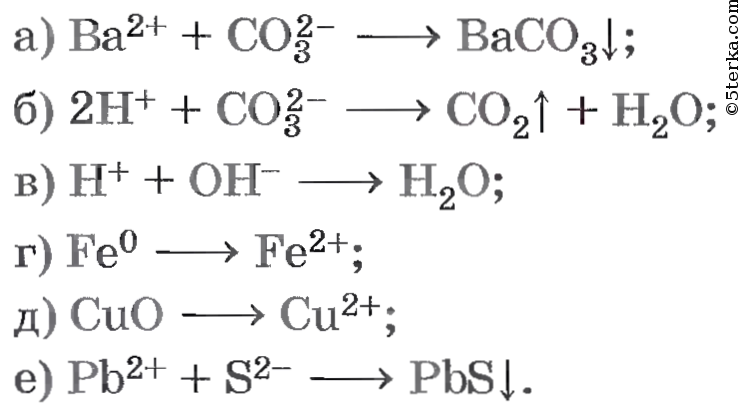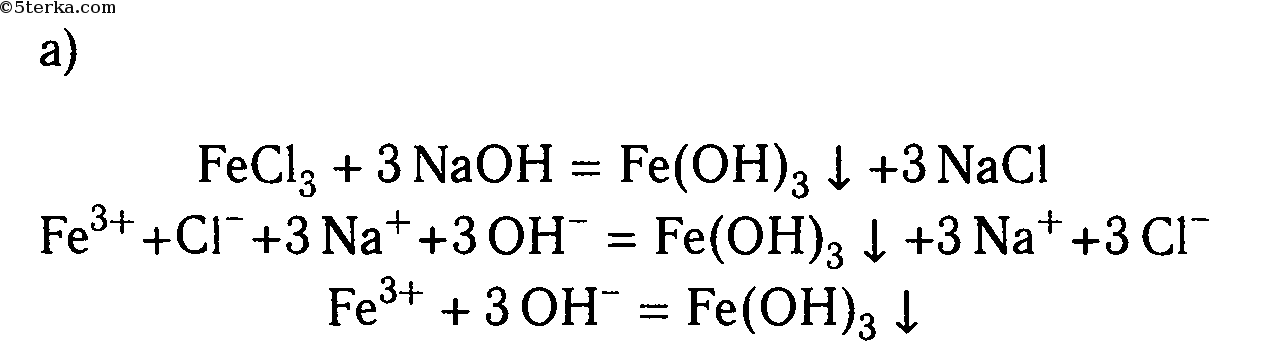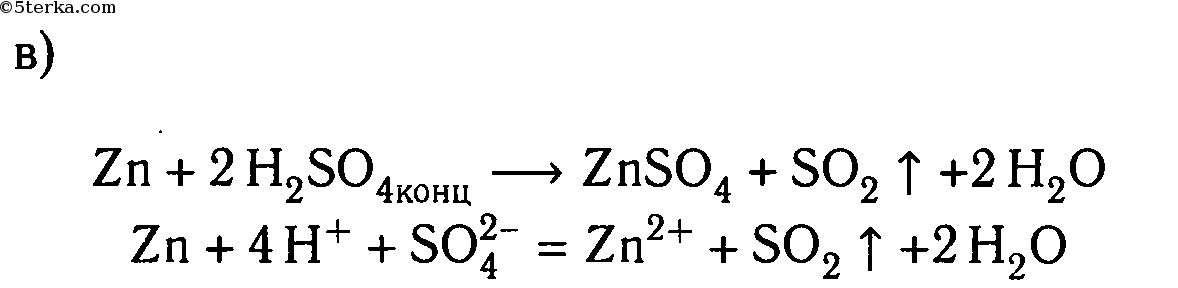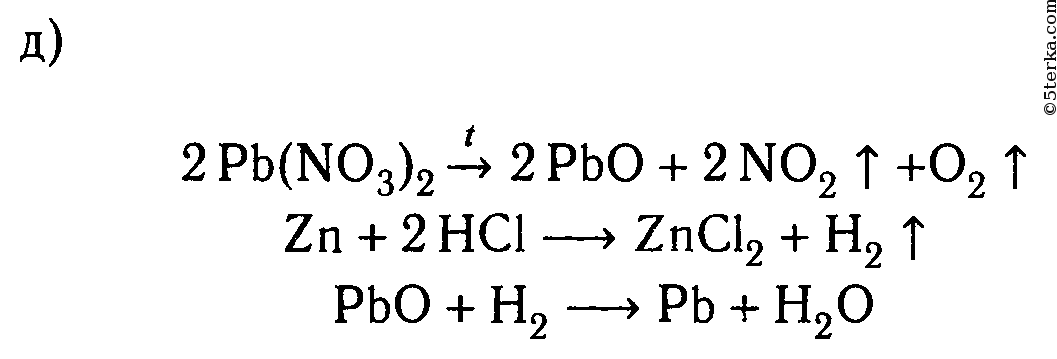Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты;
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Практическая работа №9. Решение экспериментальных задач.
Налейте в пробирку 1-2 мл концентрированного раствора серной кислоты и опустите в неё гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?
В шести пробирках находятся растворы хлорида магния. В каждую из пробирок последовательно прилейте следующие растворы: а) гидроксид натрия; б) сульфат калия; в) карбонат натрия; г) нитрат цинка; д) фосфат калия; е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионном видах.
Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты; г) сульфита натрия и серной кислоты; д) сульфата меди (II) и азотной кислоты.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения со ответствующих реакций в молекулярном и ионном видах.
Осуществите реакции, схемы которых:
а) Ba 2+ + CO3 2- ⟶ BaCO3↓;
б) 2H + + CO3 2- ⟶ CO2↑ + H2O;
в) H + + OH — ⟶ H2O;
г) Fe 0 ⟶ Fe 2+ ;
д) CuO ⟶ Cu 2+ ;
е) Pb 2+ + S 2- ⟶ PbS↓.
Проделайте реакции между следующими веществами:
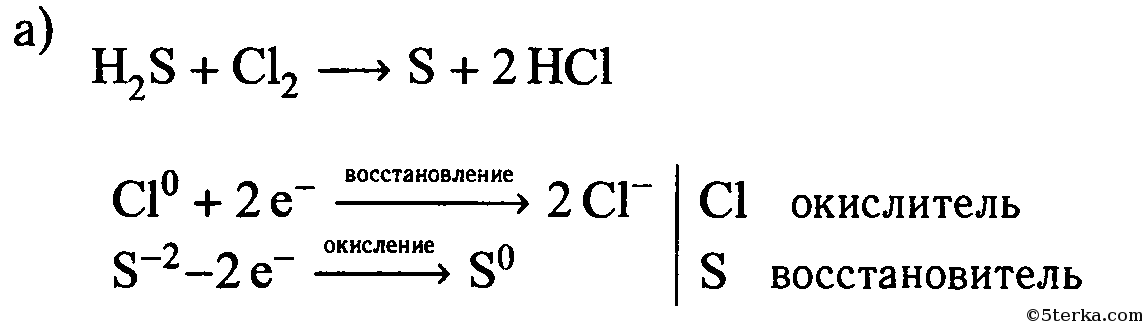
а) сероводородной и хлорной водой;
б) раствором иодида калия и хлорной водой;
в) соляной кислотой и алюминием;
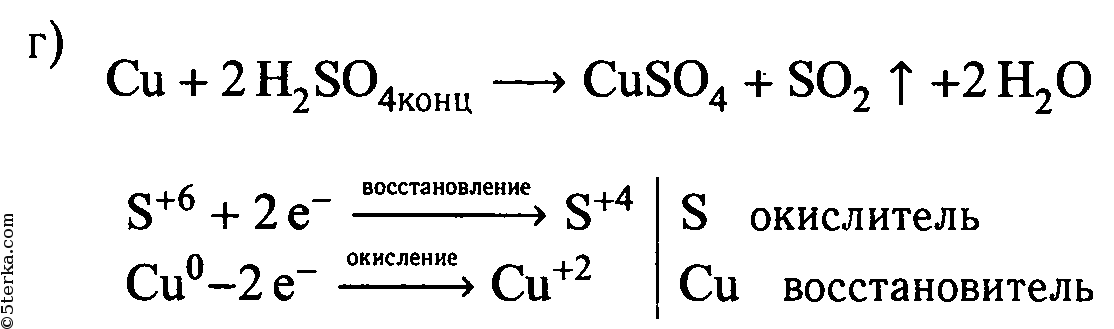
г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем и что – восстановителем?
Пользуясь растворами и веществами, находящимися на столе, получите:
а) гидроксид железа (III);
б) сульфид меди (II);
в) оксид серы (IV);
г) карбонат магния;
д) свинец.
Составьте молекулярные и ионные уравнения соответствующих реакций.
| Zn + H2SO4 ⟶ ZnSO4 + H2↑ Zn + 2H + + SO4 2- ⟶ Zn 2+ + SO4 2- + H2↑ Zn + 2H + ⟶ Zn 2+ + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Zn 0 — 2ē ⟶ Zn +2 | 1 | восстановитель (окисление) |
MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓
Mg 2+ + 2Cl — + 2Na + + 2OH — ⟶ 2Na + + 2Cl — + Mg(OH)2↓
Mg 2+ + 2OH — ⟶ Mg(OH)2↓
MgCl2 + K2SO4 ⇸ реакция не идет, т. к. не образуется осадок или газ.
MgCl2 + Zn(NO3)2 ⇸ реакция не идет, т. к. не образуется осадок или газ.
MgCl2 + Na2S ⟶ 2NaCl + MgS↓
Mg 2+ + 2Cl — + 2Na + + S 2- ⟶ 2Na + + 2Cl — + MgS↓
Mg 2+ + S 2- ⟶ MgS↓
K2CO3 + 2HCl ⟶ 2KCl + H2O + CO2↑
2K + + CO3 2- + 2H + + 2Cl — ⟶ 2K + + 2Cl — + H2O + CO2↑
2H + + CO3 2- ⟶ H2O + CO2↑
Реакция идет до конца, т. к. выделяется газ, не имеющий запаха.
Na2S + H2SO4 ⟶ Na2SO4 + H2S↑
2Na + + S 2- + 2H + + SO4 2- ⟶ 2Na + + SO4 2- + H2S↑
2H + + S 2- ⟶ H2S↑
Реакция идет до конца, т. к. выделяется газ, имеющий запах тухлых яиц.
ZnCl2 + HNO3 ⇸ реакция не идет, т. к. не образуется осадок или газ.
CuSO4 + 2HNO3 ⇸ реакция не идет, т. к. не образуется осадок или газ.
| а) H2S + Cl2 ⟶ S + 2HCl | ||
| Cl2 0 + 2ē ⟶ 2Cl — | 1 | окислитель (восстановление) |
| S -2 — 2ē ⟶ S 0 | 1 | восстановитель (окисление) |
| 2KI + Cl2 ⟶ 2KCl + I2 | ||
| Cl2 0 + 2ē ⟶ 2Cl — | 1 | окислитель (восстановление) |
| 2I — — 2ē ⟶ I2 0 | 1 | восстановитель (окисление) |
| 2Al + 6HCl ⟶ 2AlCl3 + 3H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 3 | окислитель (восстановление) |
| Al 0 — 3ē ⟶ Al +3 | 2 | восстановитель (окисление) |
| Cu + 2H2SO4(конц.) ⟶ CuSO4 + SO2↑ + 2H2O | ||
| S +6 + 2ē ⟶ S +4 | 1 | окислитель (восстановление) |
| Cu 0 — 2ē ⟶ Cu +2 | 1 | восстановитель (окисление) |
а) FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe 3+ + 3Cl — + 3Na + + 3OH — ⟶ 3Na + + 3Cl — + Fe(OH)3↓
Fe 3+ + 3OH — ⟶ Fe(OH)3↓
б) CuSO4 + Na2S ⟶ Na2SO4 + CuS↓
Cu 2+ + SO4 2- + 2Na + + S 2- ⟶ 2Na + + SO4 2- + CuS↓
Cu 2+ + S 2- ⟶ CuS↓
д) Zn + Pb(NO3)2 ⟶ Zn(NO3)2 + Pb↓
Zn 0 + Pb 2+ + 2NO3 — ⟶ Zn 2+ + 2NO3 — + Pb↓
Zn 0 + Pb 2+ ⟶ Zn 2+ + Pb↓
Практическая работа № 9. Решение экспериментальных задач
1. Налейте в пробирку 1—2 мл концентрированного раствора серной кислоты и опустите в нее гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?
2. В шести пробирках находятся растворы хлорида магния. В каждую из пробирок последовательно прилейте следующие растворы: а) гидроксид натрия; б) сульфат калия; в) карбонат натрия; г) нитрат цинка; д) фосфат калия; е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионном видах.
3. Даны растворы: а) карбонат калия и соляная кислота; б) сульфид натрия и серная кислота; в) хлорид цинка и азотная кислота; г) сульфит натрия и серная кислота; д) сульфат меди (II) и азотная кислота.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения соответствующих реакций в молекулярном и ионном видах.
4. Осуществите реакции, схемы которых:
5. Проделайте реакции между следующими веществами:а) сероводородной и хлорной водой;б) раствором иодида калия и хлорной водой;в) соляной кислотой и алюминием;г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем и что — восстановителем?
6. Пользуясь растворами и веществами, находящимися на столе, получите:а) гидроксид железа (III);б) сульфид меди (II);в) оксид серы (IV);г) карбонат магния;д) свинец.
Составьте молекулярные и ионные уравнения соответствующих реакций.

задача №4
к главе «Глава 7. Свойства электролитов».
http://gomolog.ru/reshebniki/8-klass/gabrielyan-2013/prakt/9.html
http://5terka.com/node/10326