Гидролиз ацетата бария
(CH3COO)2Ba — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
2CH3COO — + Ba 2+ + HOH ⇄ CH3COOH + CH3COO — + Ba 2+ + OH —
Сокращенное (краткое) ионное уравнение
CH3COO — + HOH ⇄ CH3COOH + OH —
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
CH3COOBaOH + HOH ⇄ CH3COOH + Ba(OH)2
Полное ионное уравнение
CH3COO — + Ba 2+ + OH — + HOH ⇄ CH3COOH + Ba 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
CH3COO — + HOH ⇄ CH3COOH + OH —
Среда и pH раствора ацетата бария
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Ацетат бария
| Ацетат бария | |
|---|---|
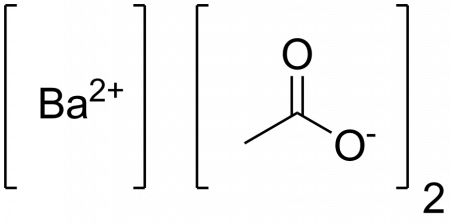 | |
| Систематическое наименование | Ацетат бария |
| Традиционные названия | барий уксуснокислый |
| Хим. формула | C4H6BaO4 |
| Рац. формула | Ba(CH3COO)2 |
| Молярная масса | 255,43 г/моль |
| Плотность | 2,468 г/см³ |
| Температура | |
| • плавления | с разл. |
450 °C
Ацетат бария (уксуснокислый барий) — органическое соединение, соль щелочноземельного металла бария и уксусной кислоты. Бесцветные кристаллы, образует кристаллогидраты.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
Получение
- Получают действием уксусной кислоты на оксид бария, гидроксид бария или карбонат бария:
BaO + 2CH3COOH → Ba(CH3COO)2 + H2O Ba(OH)2 + 2CH3COOH → Ba(CH3COO)2 + 2H2O BaCO3 + 2CH3COOH → Ba(CH3COO)2 + CO2↑ + H2O
Физические свойства
Ацетат бария образует бесцветные кристаллы тетрагональной сингонии, пространственная группа I 41/a, параметры ячейки a = 0,9901 нм, c = 2,7362 нм, Z = 16.
При кристаллизации из водных растворов образует кристаллогидраты:
- при температуре ниже 25 °C — тригидрат Ba(CH3COO)2•3H2O
- при температуре 25÷41 °C — моногидрат Ba(CH3COO)2•H2O
- при температуре выше 41 °C — безводный Ba(CH3COO)2
Напишите в молекулярной и ионной формах уравнения ре-акций гидролиза солей Ba(CH3COO)2 и CoSO4, укажите значения рН растворов этих солей (больше или меньше семи).
| 🎓 Заказ №: 22224 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Напишите в молекулярной и ионной формах уравнения ре-акций гидролиза солей Ba(CH3COO)2 и CoSO4, укажите значения рН растворов этих солей (больше или меньше семи).
Решение. Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды. Гидролиз является обратимым процессом. В реакциях гидролиза участвуют ионы слабых электролитов: катионы слабых оснований и анионы слабых кислот. Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O H + + OH— ; в результате среда становится либо кислой (рН 7). Ацетат бария Ba(CH3COO)2 – cоль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (pH > 7). Уравнения гидролиза Ba(CH3COO)2 + 2 HOH 2 CH3COOH + Ba(OH)2
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://chem.ru/acetat-barija.html
http://lfirmal.com/%D0%9D%D0%B0%D0%BF%D0%B8%D1%88%D0%B8%D1%82%D0%B5-%D0%B2-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9-%D0%B8-%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE%D0%B9-%D1%84%D0%BE%D1%80%D0%BC-25/


