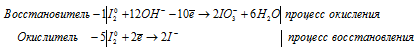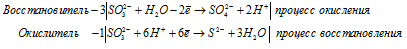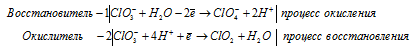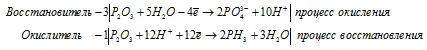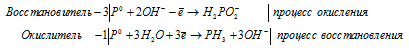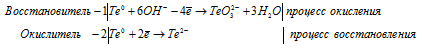Гидроксид бария: способы получения и химические свойства
Гидроксид бария Ba(OH)2 — неорганическое соединение. Белый, плавится без разложения. При дальнейшем нагревании разлагается. Хорошо растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 171,34; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 408º C.
Способы получения
1. Гидроксид бария получают в результате взаимодействия твердого сульфида бария и паров воды при 450º С, на выходе образуется гидроксид бария и сероводородная кислота:
2 . При взаимодействии бария с водой при комнатной температуре образуется гидроксид бария и водород:
3. Оксид бария при взаимодействии с водой образует гидроксид бария:
Качественная реакция
Качественная реакция на гидроксид бария — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид бария взаимодействует со сложными веществами :
1.1. Гидроксид бария реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом бария и разбавленной соляной кислотой образуется хлорид бария и вода:
1.1.2. Гидроксид бария взаимодействует с разбавленной серной кислотой, образуя сульфат бария и воду:
1.1.3. В результате взаимодействия гидроксида бария и разбавленной фосфорной кислоты образуется фосфат бария и вода:
если с гидроксидом бария будет взаимодействовать концентрированная фосфорная кислота, то в результате реакции возможно образование гидрофосфата бария и воды:
1.1.4. С насыщенным и холодным гидроксидом бария реагирует разбавленная сероводородная кислота , образуя сульфид бария и воду:
если сероводородная кислота будет насыщенной на выходе образуются гидросульфид бария и вода:
1.1.5. Гидроксид бария вступает во взаимодействие с концентрированной плавиковой кислотой с образованием фторида бария и воды:
1.2. Гидроксид бария взаимодействует с оксидами:
1.2.1. В результате взаимодействия гидроксида бария и углекислого газа образуется карбонат бария и вода:
если с углекислым газом реагирует карбонат бария в виде суспензии, то образуется гидрокарбонат бария в растворе:
1.2.2. Гидроксид бария вступает в реакцию с оксидом серы (IV) , образуя на выходе сульфит бария и воду:
если с оксидом серы (IV) взаимодействует гидроксид бария в виде суспензии, то на выходе происходит образование гидросульфита бария в растворе:
1.3. Гидроксид бария вступает в взаимодействие с солями :
1.3.1. Гидроксид бария вступает в реакцию с хроматом калия и образует хромат бария и гидроксид калия:
1.3.2. Насыщенный гидроксид бария взаимодействует при кипении с концентрированным раствором хлората аммония. При этом образуются хлорат бария, газ аммиак и воды:
2. Гидроксид бария разлагается при температуре 780 — 800º С, образуя на выходе оксид бария и воду:
Гидролиз сульфита бария
BaSO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Ba 2+ + 2SO3 2- + 2HOH ⇄ Ba 2+ + 2HSO3 — + Ba 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
SO3 2- + HOH ⇄ HSO3 — + OH —
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
Ba 2+ + 2HSO3 — + 2HOH ⇄ 2H2SO3 + Ba 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
HSO3 — + HOH ⇄ H2SO3 + OH —
Среда и pH раствора сульфита бария
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Составление уравнений реакций самоокисления-самовосстановления (диспропорционирования)
Задача 634.
Закончить уравнения реакций самоокисления-самовосстановления (диспропорционирования):
а) I2 + Ba(OH)2 → Ba(IO3)2 +
б) K2SO3 → K2S +
в) HClO3 → ClO2 +
г) P2O3 + H2O → PH3 +
д) P + KOH + H2O → KH2PO2 + PH3
е) Te + KOH → K2TeO3 +
Решение:
Реакции диспропорционирования сопровождаются одновременным увеличением и уменьшением степени окисления одного и того же элемента, первоначально находившихся в одном, определённом состоянии.
а) I 2 + Ba(OH) 2 → Ba(IO 3) 2 +
После приведения членов обеих частей уравнения, получим:
б) K 2SO 3 → K 2S +
После приведения членов обеих частей уравнения, получим:
в) HClO 3 → ClO 2 +
После приведения членов обеих частей уравнения, получим:
г) P2O 3 + H 2 O → PH 3 +
После приведения членов обеих частей уравнения, получим:
д) P + KOH + H 2 O → KH 2 PO 2 + PH 3
После приведения членов обеих частей уравнения, получим:
е) Te + KOH → K 2 TeO 3 +
3Te 0 + 6OH — → TeO3 2- + 2Te 2- + 3H2O.
После приведения членов обеих частей уравнения, получим:
http://chemer.ru/services/hydrolysis/salts/BaSO3
http://buzani.ru/zadachi/khimiya-glinka/1216-reaktsii-samookisleniya-samovosstanovleniya-zadacha-634