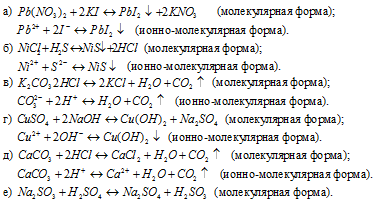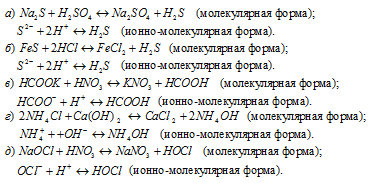Уравнять уравнение Ba(OH)2 + HF?
Химия | 5 — 9 классы
Уравнять уравнение Ba(OH)2 + HF.
Ba(OH)2 + 2HF = BaF2 + 2Н2О.
Na2O + H2 = Na + H2O уравняйте уравнение?
Na2O + H2 = Na + H2O уравняйте уравнение.
Как решить эти химические уравнение и уравнять их?
Как решить эти химические уравнение и уравнять их?
Назовите соединение (BaOH)3PO4?
Назовите соединение (BaOH)3PO4.
Помогите?
Уравнять NaOH + K2O, NaOH + MgCO3, NaOH + H3PO4, NaOH + H2S, NaOH + Fe(OH)2, NaOH + HCI3, NaOH + Zn(OH)2, BaOH + KCI, NaOH + SO3.
Уравняйте уравнениеAg + HNO3 — — AgNO3 + NO + H2O?
Ag + HNO3 — — AgNO3 + NO + H2O.
Помогите уравнение уравнять методом ОВР?
Помогите уравнение уравнять методом ОВР!
Написати рівняння реацй BaOH + H2SO4?
Написати рівняння реацй BaOH + H2SO4.
Решите уравнения по химии 8 класс, надо уравнять?
Решите уравнения по химии 8 класс, надо уравнять.
Определить вещества H2SO4, H3PO4, NaOH, BaOH, NACl?
Определить вещества H2SO4, H3PO4, NaOH, BaOH, NACl.
Написать молекулярно — ионные и сокращенно — ионные уравнения :(NH4)2SO3 + BaOHNH4NO3 + BaOH?
Написать молекулярно — ионные и сокращенно — ионные уравнения :
На странице вопроса Уравнять уравнение Ba(OH)2 + HF? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
2Fe2O3 + 3C = 4Fe + 3CO2 реакция замещения Fe2O3 + 6HCl = 2FeCl3 + 3H2O реакция обмена H2CO3 = H2O + CO2 реакция разложения 3Mg + N2 = Mg3N2 реакция соединения.
HCl + NH3 = NH4Cl n(HCl) = n(NH4Cl) = 11200 дм3 / 22, 4 дм3 / моль = 500 моль m(NH4Cl) = 500 моль * 56, 5 г / моль = 28250 г = 28, 250 кг.
H2SO3 = H + HSO3 = 2H + SO3 AL(NO3)3 = AL + 3NO3.
Твердое ; желтого или зелено желтого цвета ; запах есть, непластичное и хрупкоев S8моноклинном виде и пластичное в S6 и S4 — пластические виды серы, получаются при нагревании ; в воде нерастворимо ; T кип = + 444 С Т плав = + 112С ; плотность = 2070 ..
A) Li + Cl2 = LiCl2 b)Li + S = v) g)Li + O2 = LiO2 d)Li + 2HCl = LiCl + H2.
На чем основаны разделение химических реакций на типы? (8класс).
9 / 3 = 3 3 * 9 = 27 периметр.
Вода, солёностькоторой не превышает 0, 1%, даже в форме пара или льда называется пресной. Ледяные массивы, например : айсберги и ледники в полярных регионах содержат в себе наибольшую часть пресной воды Земли. Помимо этого, пресная вода существует ..
6. 4) оксид меди(II) 7. 2) кислород 8. 4) — 3→ + 1 N⁻³H4NO3 = N⁺¹2O + 2H2O 9. 3) Br2(0) SO2 + Br⁰2 + H2O → H2SO4 + HBr⁻¹ 10. 4) кислород.
Гидролиз фторида бария
BaF2 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
BaF2 + HOH ⇄ HF + BaOHF
Полное ионное уравнение
Ba 2+ + 2F — + HOH ⇄ HF + Ba 2+ + OH — + F —
Сокращенное (краткое) ионное уравнение
F — + HOH ⇄ HF + OH —
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
BaOHF + HOH ⇄ HF + Ba(OH)2
Полное ионное уравнение
Ba 2+ + OH — + F — + HOH ⇄ HF + Ba 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
F — + HOH ⇄ HF + OH —
Среда и pH раствора фторида бария
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
http://chemer.ru/services/hydrolysis/salts/BaF2
http://buzani.ru/zadachi/khimiya-glinka/1194-ionno-molekulyarnaya-forma-uravneniya-zadachi-580-582