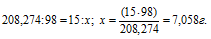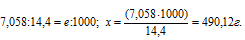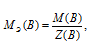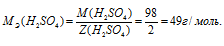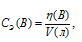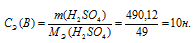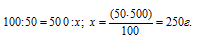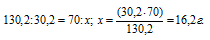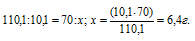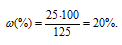Решение задач по химии на расчет нормальности раствора кислоты при осаждении сульфата бария
Задача 447.
Для полного осаждения BaSO4 из 100 г 15%-ного (по массе) раствора BaCl2 потребовалось 14,4 мл H2SO4. Найти нормальность раствора H2SO4.
Решение:
М(BaCl2) = 208,274 г/моль.
Уравнение реакции имеет вид:
Рассчитаем массу серной кислоты, необходимую для взаимодействия с 15 г BaCl2 из пропорции:
Теперь рассчитаем массу серной кислоты, которая содержится в 1000 мл из пропорции:
МЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(B) — эквивалентное число; равно числу ионов H + , H2SO4 → 2.
Для расчета нормальности раствора используем формулу:
СЭ(В) – молярная концентрация эквивалента вещества В; V(мл) – объём раствора; n(B) – количество эквивалентов вещества В.
Ответ: 10 Н.
Задача 448.
В 500 г воды растворено при нагревании 300 г NH4Cl. Какая масса NH4Cl выделится из раствора при охлаждении его до 50°С, если растворимость NH4Cl при этой температуре равна 50 г в 100 г воды?
Решение:
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе, т.е. массой вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. При охлаждении раствора до 50 0 С на каждые 100 г воды в растворе останется 50 г NH4Cl, а излишки соли выпадут в осадок, при этом образуется насыщенный раствор соли NH4Cl.
Рассчитаем массу NH4Cl оставшуюся в растворе после охлаждения из пропорции:
Рассчитаем массу NH4Cl выпавшей после охлаждения в осадок: 300 – 250 = 50г.
Ответ: 50г.
Задача 449.
Растворимость хлората калия при 70°С равна 30,2 г, а при 30°С — 10,1 г в 100 г воды. Сколько граммов хлората калия выделится из 70 г насыщенного при 70 0 С раствора, если его охладить до 30 0 С?
Решение:
Содержание хлората калия при 70 0 С в 70 г раствора его найдём из пропорции:
Содержание хлората калия в 70 г раствора при 30 0 С находим из пропорции:
Таким образом, при охлаждении раствора в осадок выпало 9,8 г хлората калия (16,2 – 6,4 = 9,8).
Ответ: 9,8г.
Задача 450.
Коэффициент растворимости сульфата меди при 30 0 С равен 25 г на 100г воды. Будет ли при этой температуре 18% раствор соли насыщенным?
Решение:
Коэффициент растворимости – это масса вещества, растворяющегося при данных условиях в 100 г воды с образованием насыщенного раствора.
Рассчитаем массовую долю насыщенного раствора сульфата меди при 30 0 С по формуле:
Это значит, что 20%-ный раствор сульфата меди является насыщенным, а 18%-ный – не будет насыщенным.
Хлорид бария: способы получения и химические свойства
Хлорид бария BaCl2 — соль щелочноземельного металла бария и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 208,23; относительная плотность для тв. и ж. состояния d = 3,856; tпл = 961º C;
Способ получения
1. Хлорид бария можно получить путем взаимодействия бария и хлора :
2. В результате взаимодействия карбоната бария и разбавленной соляной кислоты образуется хлорид бария, углекислый газ и вода:
3. Гидроксид бария вступает в реакцию с соляной кислотой с образованием хлорида бария и воды:
Качественная реакция
Качественная реакция на хлорид бария — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид бария образует нитрат бария и осадок хлорид серебра:
Химические свойства
1. Хлорид бария вступает в реакцию со многими сложными веществами :
1.1. Хлорид бария реагирует с кислотами:
1.1.1. Твердый хлорид бария реагирует с концентрированной серной кислотой при кипении , образуя сульфат бария и газ хлороводород :
1.2. Хлорид бария вступает в взаимодействие с солями:
1.2.1. В результате реакции между хлоридом бария и концентрированным раствором карбоната натрия образуется карбонат бария и хлорид натрия:
1.2.2. Хлорид бария может реагировать с сульфатом натрия при 800º С с образованием сульфата бария и хлорида натрия:
2. В результате электролиза раствора хлорида бария образуется водород и хлор:
Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 4270063
Васян Коваль
BaCl2 + H2SO4 = BaSO4 + 2HCl. Сделайте с этим уравнением электронно-ионный баланс
http://chemege.ru/xlorid-bariya/
http://shkolenet.ru/QA/4270063/