Взаимодействие хромата калия с хлоридом бария
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,298
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,232
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Частные реакции катионов третьей аналитической группы
Реакции катиона бария Ba 2+
1. Реакция окрашивания пламени. Летучие соли бария окрашивают пламя газовой горелки в желто-зеленый цвет. Реакция является фармакопейной.
Выполнение реакции. Соль бария (лучше BaCl2 ) смачивают хлороводородной кислотой и вносят в основание пламени на тонкой платиновой проволоке или на грифеле, а затем переводят в зону пламени с наивысшей температурой.
2. Разбавленная серная кислота H2SO4 и растворимые сульфаты выделяют даже из очень разбавленных растворов осадок сульфата бария:
BaCl2 + H2SO4 
Ba 2+ + SO4 2- 
Осадок не растворяется в кислотах и щелочах. Реакция является фармакопейной.
Выполнение реакции. К одной капле раствора соли бария добавляют одну каплю разбавленной серной кислоты.
3. Карбонат аммония (NH4)2CO3 или другой растворимый карбонат с солями бария дает белый осадок карбоната бария:
BaCl2 + (NH4)2CO3 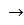
Ba 2+ + CO3 2- 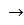
Осадок растворим в разбавленных минеральных кислотах и в уксусной кислоте (но не в серной, так как в этом случае образуется нерастворимый сульфат бария). Осаждение следует вести в слабощелочной среде, лучше в аммиачной.
Выполнение реакции. В пробирку помещают 2 капли раствора BaCl2 или Ba(NO3)2, добавляют 1 каплю разбавленного раствора аммиака и 2 капли раствора карбоната аммония.
4. Хромат калия K2CrO4 или натрия Na2CrO4 осаждает из нейтральных или уксуснокислых растворов бариевой соли хромат бария желтого цвета:
BaCl2 + K2CrO4 
Ba 2+ + CrO4 2- 
Выполнение реакции. К одной капле раствора бариевой соли добавляют 1 каплю раствора хромата калия.
5. Дихромат калия K2Cr2O7 осаждает из растворов солей бария также желтый осадок BaCrO4:
2BaCl2 + K2Cr2O7 + H2O 

2Ba 2+ + Cr2O7 2- + H2O 

Осадок BaCrO4 растворим в сильных кислотах, поэтому реакция не доходит до конца (сильная кислота HCl образуется в результате самой реакции). Если к раствору добавить ацетат натрия, хлороводородная кислота будет замещена слабой уксусной кислотой
CH3COONa + HCl 
И реакция практически дойдет до конца.
Выполнение реакции. К 1-2 каплям раствора бариевой соли добавляют 2 капли раствора ацетата натрия и 2 капли раствора дихромата калия.
6. Оксалат аммония (NH4)2C2O4 образует с солями бария белый осадок, растворимый в хлороводородной и азотной кислотах, а в уксусной кислоте только при кипячении:
BaCl2 + (NH4)2C2O4 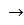
Ba 2+ + C2O4 2- 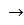
Выполнение реакции. К 2 каплям раствора соли бария добавляют 2 капли раствора оксалата аммония.
Реакции катиона Ca 2+
1. Реакция окрашивания пламени. Летучие соли кальция окрашивают бесцветное газовое пламя в кирпично-красный цвет. Реакция является фармакопейной.
Выполнение реакции. Реакция выполняется так же, как описано для катиона бария.
2. Разбавленная серная кислота H2SO4 образует с ионом кальция белый осадок сульфата кальция:
CaCl2 + H2SO4 
Ca 2+ + SO4 2- 
Вследствие достаточно высокой растворимости сульфата кальция (2 г/л) осаждение возможно только из достаточно концентрированных растворов солей кальция. Более полное осаждение сульфата происходит при добавлении к раствору этилового спирта.
Выполнение реакции. К 3 каплям раствора соли кальция добавляют 3-4 капли разбавленной серной кислоты. К помутневшему раствору приливают 8-10 капель этилового спирта. Наблюдают выделение осадка.
3. Карбонат аммония (NH4)2CO3 осаждает карбонат кальция в виде осадка белого цвета:
CaCl2 + (NH4)2CO3 
Ca 2+ + CO3 2- 
Для полного осаждения кальция необходим достаточный избыток осадителя. Осадок растворим в разбавленных минеральных кислотах и в уксусной кислоте. Осаждение следует проводить в аммиачной среде.
Выполнение реакции. В пробирку помещают 2 капли раствора соли кальция, добавляют 1 каплю разбавленного раствора аммиака и 2 капли раствора карбоната аммония.
4. Оксалат аммония (NH4)2C2O4 дает на холоду в нейтральных и слабощелочных растворах белый мелкокристаллический осадок оксалата кальция:
CaCl2 + (NH4)2C2O4 
Ca 2+ + C2O4 2- 
Осадок не растворим в уксусной кислоте, но легко растворим в минеральных кислотах. Реакцию с оксалатом аммония нельзя проводить в присутствии солей бария, так как ион Ba 2+ образует с оксалатом аммония белый осадок ВaC2O4.
Это наиболее важная качественная реакция иона Са 2+ . Она является фармакопейной.
Выполнение реакции. К 2 каплям раствора хлорида кальция добавляют 2 капли раствора оксалата аммония.
5. Гексацианоферрат (II) калия (желтая кровяная соль К4[Fe(CN)6]) с солями кальция образует в слабощелочной среде белый кристаллический осадок, нерастворимый в уксусной кислоте:
CaCl2 + К4[Fe(CN)6] + NH4Cl 
Ca 2+ + K + + NH4 + + [Fe(CN)6] 3- 
В присутствии значительных количеств иона Ba 2+ не рекомендуется применять эту реакцию для открытия ионов Ca 2+ , так как ион Ba 2+ при достаточном количестве может дать осадок с К4[Fe(CN)6].
Выполнение реакции. В пробирку помещают 2 капли раствора хлорида кальция, добавляют 1 каплю раствора хлорида аммония и 2 капли раствора аммиака до щелочной реакции и нагревают 1-2 минуты на водяной бане. К горячему раствору прибавляют 5-6 капель 0,5 М раствора желтой кровяной соли. Вновь нагревают 2-3 минуты на водяной бане. Реакция менее чувствительна, чем с оксалатом аммония.
6. Микрокристаллоскопическая реакция. Разбавленная серная кислота образует с солями кальция иглообразные кристаллы СaSO4*2H2O.
Выполнение реакции. На предметное стекло помещают одну каплю раствора соли кальция и рядом одну каплю разбавленной серной кислоты. Соединяют стеклянной палочкой обе капли и слегка подсушивают (но не высушивают досуха!) над огнем до появления каемки по краям капли. Образующиеся кристаллы рассматривают под микроскопом.
Задания для самостоятельной работы
учащихся по теме:
«Катионы 3 аналитической группы, анализ смеси катионов 1,2,3 аналитических групп»
1.Какие катионы относятся к третьей аналитической группе . Назовите групповой реагент третьей аналитической группы.
2.Какую роль в организме человека играют ионы Ca 2+ ,Ba 2+ . Какие соли этих катионов используются в медицине.
3.Напишите в молекулярном и ионном виде реакции обнаружения на катион Ba 2+ .
4.Допишите реакцию взаимодействия:
а) Pb(NO3)2 + 2KOH
б) Pb(NO3)2 + K2CrO4
в) CaCl2 + H2SO4
г) CaCl2 + (NH4)2CO3
д) CaCl2 + (NH4)2C2O4
е) CaCl2 + К4[Fe(CN)6] + NH4Cl
5.На какой из катионов 3 аналитической группы проводится микроскопическая реакция. Опишите ее выполнение.
6.Какой катион второй группы при систематическом анализе смеси катионов 1,2,3 групп может оказаться вместе с катионами третьей группы
7.Почему сульфаты катионов третьей аналитической группы необходимо превращать в карбонаты
8.Какой реактив в качестве катализатора следует добавить в реакционную среду при взаимодействии серной кислоты и Са 2+ для полного осаждения продукта реакции?
9. В какой цвет окрашивают пламя горелки соли бария?
а) зеленый в) кирпично-красный
б) фиолетовый г) желто-зеленый
10.В каком реактиве растворяется осадок, образующийся в реакции хромата калия с солями бария?
Bacl2 k2cro4 ионное уравнение и молекулярное уравнение
Вопрос по химии:
Напишите молекулярные, полные и сокращенные ионные уравнения следующих реакций:
1) FeCl3+KOH=
2)CuSO4+BaCl2=
3)Na2CO3+HCl=
4)CaCO3+HCl=
5)Zn(OH)2+NaOH=
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
http://zdamsam.ru/b4835.html
http://online-otvet.ru/himia/5cea9d3996f4e19a2952f25e



