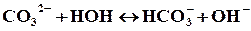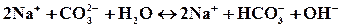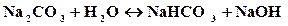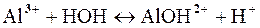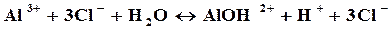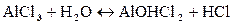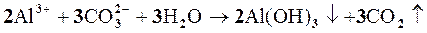Какие из солей подвергаются гидролизу: Na2WO4, BaCl2, PbCl2? Составьте ионно-молекулярные и молекулярные уравнения гидролиза. Какое значение рН (>7, 7, Готовое решение: Заказ №8404
7, Тип работы: Задача
7, Статус: Выполнен (Зачтена преподавателем ВУЗа)
7, Предмет: Химия
7, Дата выполнения: 01.09.2020
7, Цена: 209 руб.
Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Какие из солей подвергаются гидролизу: Na2WO4, BaCl2, PbCl2? Составьте ионно-молекулярные и молекулярные уравнения гидролиза. Какое значение рН (>7,
Решение:
Na2WO4 – вольфрамат натрия – соль слабой кислоты и сильного основания, в водном растворе частично гидролизуется по аниону слабой кислоты:
2Na + + WO4 2- + H2O ↔ Na + + НWO4 — + Na + + OH —
| Если вам нужно решить химию, тогда нажмите ➔ заказать химию. |
| Похожие готовые решения: |
- Методом электронного баланса подберите коэффициенты в уравнениях, укажите окислитель и восстановитель, напишите электронные уравнения процессов окисления и восстановления Na3AsO3 + KMnO4 + KOH = Na3A
- Для гальванического элемента, образованного пластинами из металлов Bi и Ti , погруженных в растворы их солей с концентрацией ионов металлов An+ =1,0 и Bm+ = 0,05.
- Какой объем 1М раствора хлорида хрома (III) необходимо взять для приготовления 200 мл 2%-го раствора плотностью 1,018 г/мл.
- Составьте молекулярные и ионно-молекулярные уравнения реакций, которые доказывают амфотерный характер: гидроксида свинца (II); гидроксида олова (IV).
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
составьте уравнения гидролиза солей определите среду раствора. а) NH4Br б) K2CO3 в) MgS г) BaCl2 д) Fe(NO3)3
1) NH4Br + H2O —> NH4OH + HBr среда кислая
NH4Br —> NH4(+) + Br(-)
H2O H(+) + OH(-)
2) K2CO3 + H2O —> KHCO3 + KOH среда щелочная
K2CO3 —> KCO3(-) + K(+)
H2O H(+) + OH(-)
3) 3MgS + 2H2O —> (MgH)2S3 + Mg(OH)2 среда щелочная (не уверена в правильном составлении формулы кислой соли магния)
MgS —> Mg(2+) + S(2-)
H2O H(+) + OH(-)
4) BaCl2 + H2O —> BaOHCl + HCl среда кислая
BaCl2 —> BaCl(+) + Cl(-)
H2O H(+) + OH(-)
5) Fe(NO3)3 + H2O —> FeOH(NO3)2 + HNO3 среда кислая
Fe(NO3)3 —> Fe(NO3)2(+) + NO3(-)
H2O H(+) + OH(-)
3 и 4 абсолютно не верно! 3 — сульфид магния образован двумя слабыми частицами, плюс в таблице растворимости четкое указание на разложение в водной среде, т. е. можно предположить полный гидролиз! 4 — обе частицы сильные и гидролиз протекать не может!
ИОНООБМЕННЫЕ РЕАКЦИИ. ГИДРОЛИЗ СОЛЕЙ
При взаимодействии растворов электролитов реакции происходят между ионами растворенных веществ. Химический процесс можно записать в молекулярной и ионно-молекулярной формах. Однако ионная форма отражает его точнее. При составлении ионных уравнений реакций вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные изображаются в виде молекул.
Пример 1.Записать в молекулярной и ионно-молекулярной формах уравнения реакций между следующими веществами: H2SO4 и BaCl2; Na2СО3 и НCl.
1) H2SO4 + BaCl2= Ва SO4 ↓+ 2 НCl – молекулярное уравнение,
2Н + + SO4 2- _+ Ва 2+ + 2Cl — = ВаSO4 ↓ + 2Н + + 2Cl — – полное ионно-молекулярное уравнение;
Ва 2+ + SO4 2- = ВаSO4 ↓ – сокращенное ионно-молекулярное уравнение.
Сокращенное ионно-молекулярное уравнение показывает, что в реакции участвуют только ионы Ва 2+ и SO4 2- .
Гидролизомназывается взаимодействие солей и воды с образованием слабодиссоциирующих веществ, одновременно сопровождающееся смещением ионного равновесия воды. Отсюда следует, что не всякое взаимодействие соли с водой является гидролизом, а следовательно, не все соли гидролизу подвергаются.
Гидролизу подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (Na2CO3, CH3COOK), катионом слабого основания и анионом сильной кислоты ( ZnCl2, Al2(SO4)3), катионом слабого основания и анионом слабой кислоты (CH3COONH4, Al2S3).
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
При анализе состава солей нужно помнить, что:
| 1. К сильным основаниям относятся: LiOH, KOH, NaOH, CsOH, RbOH, Ca(OH)2, Ba(OH)2, Sr(OH)2, Rа(OH)2. 2. К сильным кислотам относятся: H2SO4, H2SеO4, HNO3, HClO4, HBr, HI, HCl. | 3. Слабые основания образуют катионы всех остальных металлов и NH4 + . 4. К слабым кислотам относятся: H2SO3, HNO2, HClO, HF, H3PO3, H2CO3, H2S, H2SiO3,CH3COOH и др. |
Соли, образованные многокислотными основаниями или многоосновными кислотами, подвергаются ступенчатому гидролизу. Более легко протекает первая ступень гидролиза, и на ней, как правило, при обычных условиях гидролиз солей завершается. Скорость гидролиза зависит от растворимости солей, оснований и кислот, поэтому необходимо учитывать этот фактор (прил. 7).
Гидролизу подвергается не все количество находящейся в растворе соли, а только часть ее. Иначе говоря, в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием. Доля вещества, подвергающаяся гидролизу, — степень гидролиза, — зависит от константы этого равновесия, а также от температуры и концентрации соли.
Запишем уравнение гидролиза в общем виде. Пусть НА – кислота, МОН – основание, МА – образованная ими соль. Тогда уравнение гидролиза будет иметь вид:
Этому равновесию отвечает константа
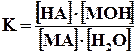
Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая К·[ Н2О] =Кг, получим
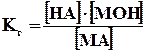
Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз. Для соли, образованной катионом сильного основания и анионом слабой кислоты, константа гидролиза связана с константой диссоциации кислоты Ккисл зависимостью:


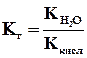
Это уравнение показывает, что Кг тем больше, чем меньше Ккисл . Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
Для солей, образованных катионом слабого основания и анионом сильной кислоты, аналогичное выражение связывает константу гидролиза с константой диссоциации основания Косн:
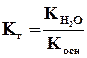
Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза.
Зависимость степени гидролиза (h) от концентрации выражается через закон разбавления:
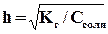
то есть с разбавлением раствора степень гидролиза увеличивается.
Влияние температуры на степень гидролиза вытекает из принципа Ле-Шателье. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз с поглощением теплоты. Поскольку выход эндотермических реакций с ростом температуры увеличивается, то и степень гидролиза растет с повышением температуры.
Пример 1.Составить молекулярное и ионное уравнение гидролиза соликарбоната натрия.
Решение. Соль Na2СO3 образована сильным основанием (NaOH) и слабой кислотой (H2СO3), таким образом,гидролиз соли будет протекать по аниону. Так как ион СO3 2- содержит 2 заряда, то гидролиз возможен в 2 ступени: первая ступень протекает в обычных условиях, вторая – при нагревании или разбавлении. Рассмотрим гидролиз по первой ступени:
Сокращенное ионное уравнение гидролиза:
полное ионное уравнение гидролиза:
Так как в растворе накапливаются гидроксид-ионы, то среда щелочная, т.е. рН>7.
Пример 2. Составить молекулярное и ионное уравнение гидролиза соли хлорида алюминия.
Решение.Гидролиз солей, образованных слабым основанием (Al(OH)3) и сильной кислотой (HCl) протекает по катиону:
В обычных условиях гидролиз протекает по первой ступени, незначительно – по второй. Третья ступень практически не протекает, однако разбавление или нагревание усиливают гидролиз.
Так как в растворе накапливаются ионы водорода, то среда кислая, т.е. рН — и Н + :
Задачи к главе 9
Й уровень
336-340. Записать в молекулярной и ионно-молекулярной формах уравнения реакций между веществами А и Б, приводящих к образованию малорастворимых осадков или газов:
| Задачи | |||||
| А | NiСl2 | К2СО3 | СuSO4 | Рb(NО3)2 | АgNО3 |
| Б | Н2S | Н2SО4 | Na3РО4 | KI | AlBr3 |
341-345. Составьте уравнения гидролиза солей А и Б в молекулярной и ионно-молекулярной формах. Укажите, каким будет рН их растворов (рН>7, рН 7, рН
Дата добавления: 2016-01-09 ; просмотров: 1836 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://sprashivalka.com/tqa/q/7598660
http://helpiks.org/6-46275.html