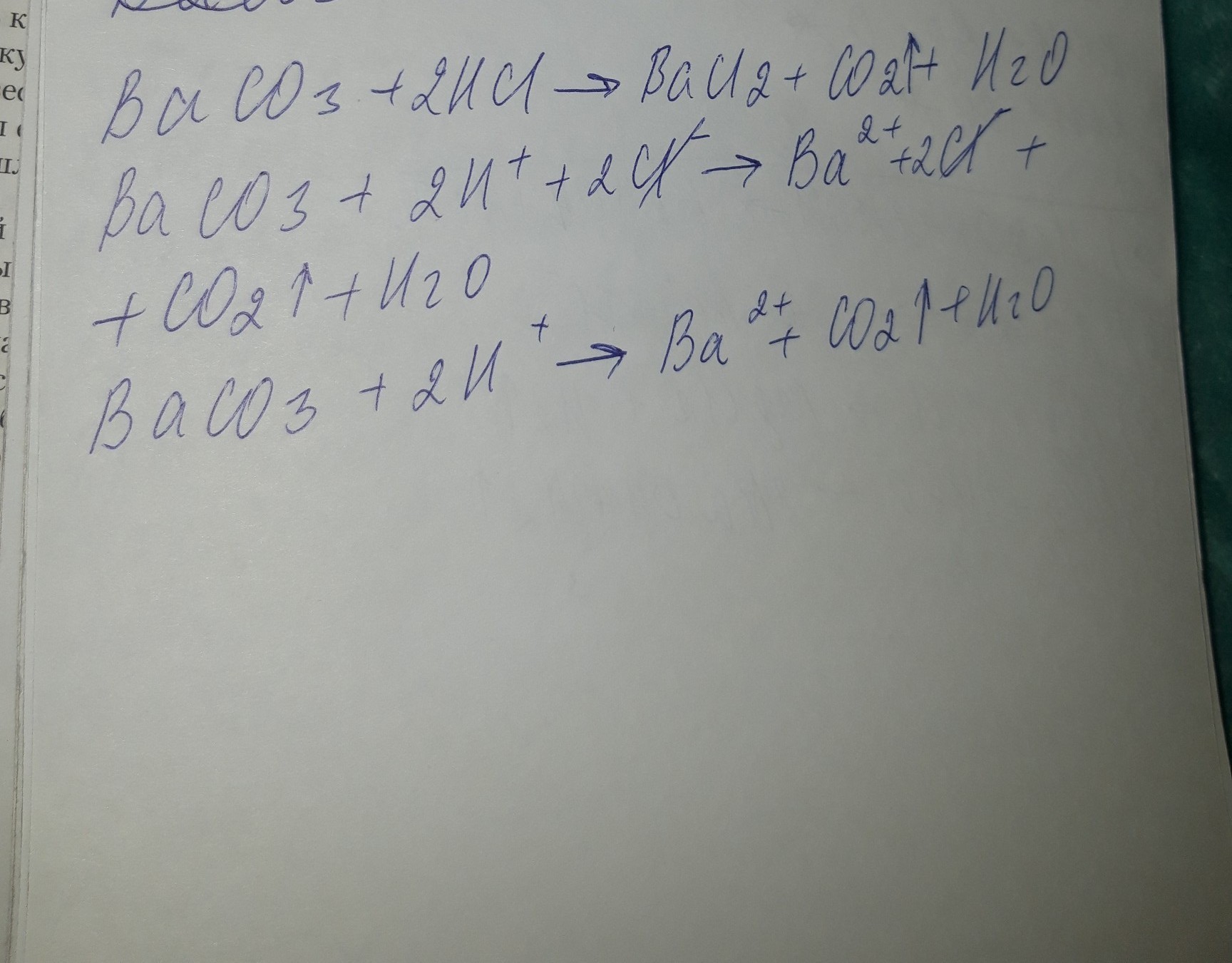молекулярная и ионно-молекулярная форма уравнения BaCO3 + HCL = BaCL + HCO3. вот нужно решить это уравнение, спасибо)
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaCO3 + 2H+ + 2Cl- = Ba(2+) + 2Cl- + CO2 + H2O
BaCO3 + 2H+ = Ba(2+) + CO2 + H2O
BaCO3 + 2HCl = BaCl2 + H2CO3 Ba2++2Cl-=BaCl2 2H++(CO3)2-=H2CO3 Но карбонатная кислота распадается H2CO3=H2O+CO2^
BaCO3 + 2HCl = BaCl2 + H2CO3 Ba2++2Cl-=BaCl2 2H++(CO3)2-=H2CO3 Но карбонатная кислота распадается H2CO3=H2O+CO2^
Baco3 hcl ионное уравнение полное и сокращенное
Вопрос по химии:
Baco3+HCL
составить ионное и молекулярное уравнение
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
BaCO3+2HCl=BaCl2+H2O+CO2(срелка вверх)
(Ba+2) + (CO3-2) + (2H+) + (2Cl-)= (Ba +2) + (2Cl-) + H2O+CO2
(CO3-2)+(2H+)=H2O+CO2
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Baco3 + HCLсоставить ионное и молекулярное уравнение?
Химия | 5 — 9 классы
составить ионное и молекулярное уравнение.
Решение во вложении.
Составить уравнения реакций ионного обмена в молекулярной и ионной форме?
Составить уравнения реакций ионного обмена в молекулярной и ионной форме.
Cuoh2 + hcl =в молекулярном и ионном?
в молекулярном и ионном.
№ 1. Напишите ионные уравнения реакций между растворёнными в воде веществами : а) FeCl3 и NaOH ; б) Na2SO3 и HCl ; в) HCl и Ca(OH)2?
№ 1. Напишите ионные уравнения реакций между растворёнными в воде веществами : а) FeCl3 и NaOH ; б) Na2SO3 и HCl ; в) HCl и Ca(OH)2.
Составьте уравнения в молекулярном, ионно — молекулярном и кратком ионном виде.
Fe + HCl составьте молекулярное и ионное уравнение?
Fe + HCl составьте молекулярное и ионное уравнение.
Нужно решить ионное уравнение и молекулярное с сокращеннымNa2Co3 + HCl?
Нужно решить ионное уравнение и молекулярное с сокращенным
Как составить молекулярное и ионное уравнение?
Как составить молекулярное и ионное уравнение?
Мне нужно объяснить что за чем делать
а) HCl и Ba(OH)2 б) AgNO3 и AlCl3.
Составьте полное и сокращённое ионные уравнения для молекулярных уравнений : Li2O + HCL?
Составьте полное и сокращённое ионные уравнения для молекулярных уравнений : Li2O + HCL.
Составьте молекулярное и ионное уравнениеSnCl2 + K3PO4(NH4)2SO3 + HClCr2O3 + HCl?
Составьте молекулярное и ионное уравнение
Составьте молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между : а) Li2SiO3 и HCl?
Составьте молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между : а) Li2SiO3 и HCl.
Ba(no3)2 + hcl СОСТАВИТЬ молекулярные, полные, и краткие ионные уравнения?
Ba(no3)2 + hcl СОСТАВИТЬ молекулярные, полные, и краткие ионные уравнения.
Перед вами страница с вопросом Baco3 + HCLсоставить ионное и молекулярное уравнение?, который относится к категории Химия. Уровень сложности соответствует учебной программе для учащихся 5 — 9 классов. Здесь вы найдете не только правильный ответ, но и сможете ознакомиться с вариантами пользователей, а также обсудить тему и выбрать подходящую версию. Если среди найденных ответов не окажется варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском», который откроет все похожие ответы, или создайте собственный вопрос, нажав кнопку в верхней части страницы.
1)расставляем коэффициенты 2)указываем С. О. каждогоэлемента 3)составляем ионное уравнение 4)сокращаем одинаковое 5)составляем сокращенное ионное уравнение.
3FeCl2 + 2Al — > 2AlCl3 + 3Fe Fe( + 2) + 2e — > Fe(0) 3 в — ие ок — ль Al(0) — 3e — > Al( + 3) 2 ок — ие в — ль 3Fe( + 2) + 6Cl( — ) + 2Al(0) — > 2Al( + 3) + 6Cl( — ) + 3Fe(0) 3Fe( + 2) + 2Al(0) — > 2Al( + 3) + 3Fe(0).
А) N2O5 б) Mg3N2 в) SO3 г) Na2S д) AsF3.
M(Na2CrO4) = 23 * 2 + 52 + 16 * 4 = 46 + 64 + 52 = 162 г / моль M((NH4)2SO4) = 14 * 2 + 1 * 8 + 32 + 16 * 4 = 28 + 8 + 32 + 64 = 132 г / моль M(Fe2(SO4)3) = 56 * 2 + 32 * 3 + 16 * 12 = 112 + 96 + 192 = 400 г / моль.
0. 15G / (G + M) = 0. 05 G — масса 15% раствора. M — масса воды M = 2G для получения 5% раствора нужно взять воды по массе в два раза более массы раствора. Учтём что плотность раствора и воды примерно одинаковы и получим что нужно взять один объём..
Химические свойства кислот 1) Диссоциация : HCl + nH2OH + ×kH2O + Cl–×mH2O (сокращенно : HCl H + + Cl– ). Многоосновные кислоты диссоциируют по ступеням (в основном по первой) : H2SO4 H + + НSO4– (1 ступень) и HSO4– H + + SO42– (2 ступень). 2) Взаи..
Массу. Агрегатное состояние характерно для вещества.
ПРАВИЛЬНЫЙ ОТВЕТ ПЕРВЫЙ АГРЕГАТНОЕ СОСТОЯНИЕ.
Молярна маса FeSO4 = 152 г / моль Складемо наступну пропорцію із якої порахуємо масу заліза у 0. 1 г сульфату заліза Отже бачимо, що така маса сульфату заліза вдвічі перевищує його добову потребу.
Металлические, Ионные, Молекулярные, Атомные.
http://online-otvet.ru/himia/5ceaa3a396f4e19a295ffb94
http://himia.my-dict.ru/q/7559928_baco3-hclsostavit-ionnoe-i-molekularnoe-uravnenie/