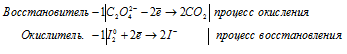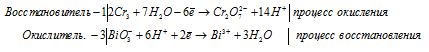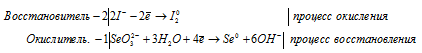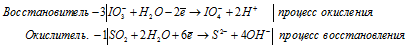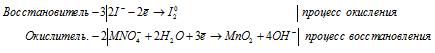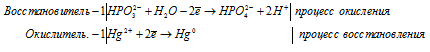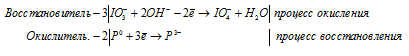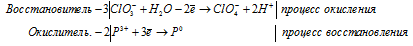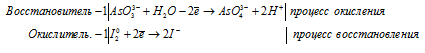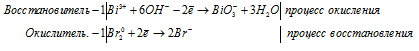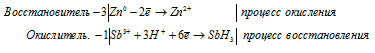Опыт 37 — Опыт 45
Опыт 37
Совместный гидролиз сульфата хрома (III)
и карбоната натрия.
Результат:
1) Ионные уравнения реакций:
а) 2Cr 3+ + 3SO − 2 4+ 6Na + + 3CO 2− 3 = 2Cr +3 + 3CO 2− 3 + 6Na + + 3SO − 2 4
б) Cr2(CO3)3 + 3H2O = 2Cr(OH)3↓ + 3CO2↓
в) Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3Na2SO4.
Вывод:
Гидроксид хрома (III) проявляет свойства основания. Соли
хрома (III) сильно гидролизуются, вследствие чего невозмож-
но существование Cr2(CO3)3.
Для полного протекания гидролиза необходимо кипятить
раствор для удаления CO2.
Опыт 38
Перевод хроматов в дихроматы
и дихроматов в хроматы
Результат:
1) Ионные реакции проведенных реакций:
а) 2CrO − 2 4+ 2H + ⇔ Cr2O 2− 7 + H2O
Раствор переходит из темной окраски в более темную.
б) Cr2O 2− 7 + 2OH − ⇔ 2CrO − 2 4+ H + .
Раствор становится темным.
Опыт 39
Взаимодействие хромата калия с хлоридом бария
Результат:
1) Ионные уравнения реакции:
K2CrO4 + BaCl2= BaCrO4↓ + 2HCl.
В сокращенной форме:
CrO − 2 4+ Ba 2+ = BaCrO4↓
2) Образуется хромат бария, имеющий желтый цвет
Опыт 40
Окисление ионов Mn 2+ до ионов Mn 4 +
Результаты:
1) Ионные уравнения приведенных реакций:
Mn 2+ + 2OH − = Mn(OH)2↓
Образуется гидроксид марганца (II) имеющий розовую ок-
раску.
Mn(OH)2 + H2O = Mn(OH)4 + H2O
92
Гидроксид марганца (II) быстро темнеет, окисляясь даже
кислородом воздуха до гидроксида марганца (IV).
Опыт 41
Получение гидроксида железа (III)
и изучение его свойств
Результат:
1) Ионные уравнения проведенных реакций:
а) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl.
Образуется бурый осадок гидроксида железа (III).
б) 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Происходит растворение гидроксида железа (III) в серной
кислоте с образованием желто-коричневого раствора.
Опыт 42
Получение гидроксида железа (III)
и изучение его свойств
Результат:
1) Уравнения проведенных реакций:
а) FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
бледно-зеленый
б) 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3↓
красно-коричневый
в) Fe(OH)2 + 2HCl = FeCl2 + H2O
образуется бледно зеленый раствор.
93
Опыт 43
Качественные реакции на ионы Fe 3+ и Fe3+
Результат:
1) Уравнения проведенных реакций:
а) Fe 3+ + [Fe(CN)6] 4− = [Fe2(CN)6] −
синего цвета
б) Fe3+ + CNS− = Fe(CNS)3↓
темно-красный осадок
в) Fe2+ + [Fe(CN)6] 3 − = [Fe2(CN)6] − .
синего цвета
Опыт 44
Гидролиз солей железа (III)
Результат:
1) Ионное уравнение гидролиза солей на первой стадии.
а) Fe 3+ + CO 2− 3 = Fe2(CO3)3
б) Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Образуется осадок красно-коричневого цвета и выделяется
углекислый газ.
Опыт 45
Получение гидроксида никеля (II)
и изучение его свойств
Результат:
1) Уравнение реакции:
а) NiSO4 + 2NaOH = Ni(OH)2↓ + Na2SO4
Образуется осадок зеленого цвета.
94
2) Исследование характера гидроксида никеля.
а) Ni(OH)2 + 2HCl = NiCl2 + H2O
Происходит растворение гидроксида с образованием блед-
но-зеленого раствора.
б) Ni(OH)2 + NaOH ≠ — реакция не происходит.
задача №
к главе «ЛАБОРАТОРНЫЕ ОПЫТЫ».
Гидролиз хромата бария
BaCrO4 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Ba 2+ + 2CrO4 2- + 2HOH ⇄ Ba 2+ + 2HCrO4 — + Ba 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
CrO4 2- + HOH ⇄ HCrO4 — + OH —
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
Ba 2+ + 2HCrO4 — + 2HOH ⇄ 2H2CrO4 + Ba 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
HCrO4 — + HOH ⇄ H2CrO4 + OH —
Среда и pH раствора хромата бария
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Составление уравнений реакций окислительно-восстановительных процессов
Задача 637.
Закончить уравнения реакций, записать их в молекулярной форме:
а) С2O4 2- + I2 → CO2 +
б) BiO3 — + Cr 3+ + H + → Cr2O7 2- +
в) SeO3 2- + I — + H2O → Se +
г) IO3 — + SO2 + H2O →
Решение:
а) С2O4 2- + I2 → CO2 +
Молекулярная форма процесса
б) BiO3 — + Cr 3+ + H + → Cr2O7 2- +
После приведения членов в обеих частях равенства получим:
Молекулярная форма процесса:
в) SeO3 2- + I — + H2O → Se +
Молекулярная форма процесса:
Молекулярная форма процесса:
Задача 638.
Закончить уравнения реакций, записать их в молекулярной форме:
а) MnO4 — + I — + H2O →
б) HPO3 2- + Hg 2+ + H2O → Hg +
в) P + IO3 — + OH — →
г) PCl3 + ClO3 — + H2O →
д) AsO3 — + I2 + H2O → AsO4 — +
е) Bi 3+ Br2 + OH — → BiO3 — +
ж) Sb3+ + Zn + H + → SbH3 +
Решение:
а) MnO4 — + I — + H2O →
Молекулярная форма процесса:
б) HPO3 2- + Hg 2+ + H2O → Hg +
Молекулярная форма процесса:
в) P + IO3 — + OH — →
Молекулярная форма процесса:
3ClO3 — + 2P 3+ + 3H2O → 3ClO4 — + 2P 0 + 6H +
Молекулярная форма процесса:
Молекулярная форма процесса:
е) Bi 3+ Br2 + OH — → BiO3 — +
Ионно-молекулярная форма процесса:
Молекулярная форма процесса:
ж) Sb3+ + Zn + H + → SbH3 +
Уравнения полуреакций:
Sb 3+ + 3Zn 0 + 3H + → SbH3 + 3Zn 2+
http://chemer.ru/services/hydrolysis/salts/BaCrO4
http://buzani.ru/zadachi/khimiya-glinka/1219-zakanchivanie-uravnenij-reaktsij-zadacha-637