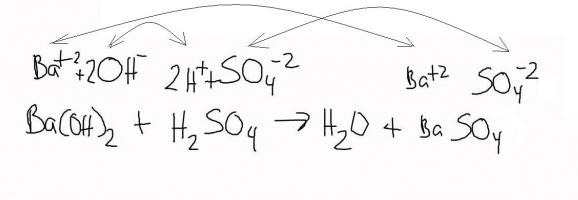Сульфат бария: способы получения и химические свойства
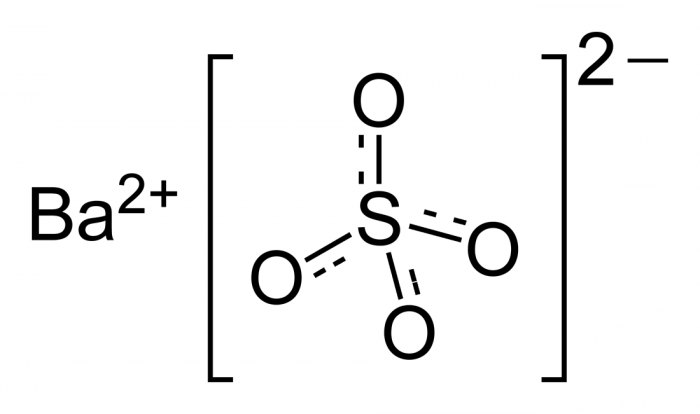
Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
Способ получения
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Химические свойства
1. Сульфат бария реагирует с простыми веществами :
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
2. Сульфат бария вступает в реакцию со сложными веществами :
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
Что такое бария сульфат? Как получают сульфат бария?
Бария сульфат – это неорганическое вещество с химической формулой BaSO4. Представляет собой белый порошок без запаха, нерастворимый в воде. Его белизна и непрозрачность, а также высокая плотность определяют основные области применения.
История названия
Барий относится к щёлочноземельным металлам. Последние названы так потому, что, по словам Д. И. Менделеева, их соединения образуют нерастворимую массу земли, а окислы «имеют землистый вид». Барий в природе содержится в виде минерала барита, который представляет собой бария сульфат с различными примесями.
Впервые он был обнаружен шведскими химиками Шееле и Ганом в 1774 году в составе так называемого тяжелого шпата. Отсюда возникло и название минерала (от греч. «барис» – тяжелый), а затем и самого металла, когда в 1808 г. его выделил в чистом виде Гемфри Деви.
Физические свойства
Поскольку BaSO4 – это соль серной кислоты, то ее физические свойства отчасти определяются самим металлом, который является мягким, химически активным и серебристо-белым. Природный барит бесцветен (иногда белый) и прозрачен. Химически чистый BaSO4 имеет цвет от белого до бледно-желтого, он негорючий, с температурой плавления 1580°С.
Какая масса сульфата бария? Молярная масса его равна 233,43 г/моль. Он обладает необычайно высоким удельным весом – от 4,25 до 4,50 г/см 3 . Учитывая нерастворимость в воде, высокая плотность делает его незаменимым в качестве наполнителя водных буровых растворов.
Химические свойства
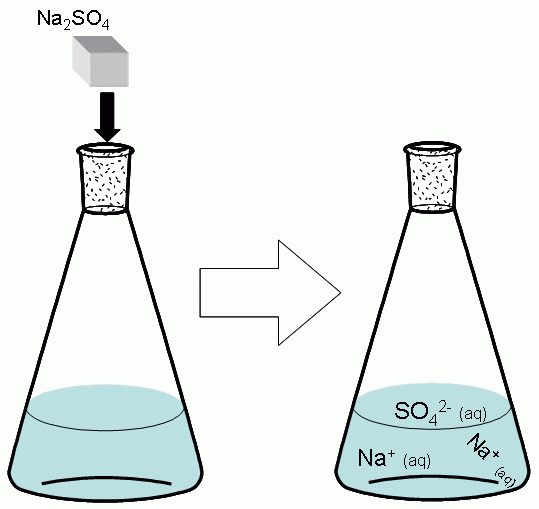
BaSO4 – это одно из самых труднорастворимых в воде соединений. Его можно получить из двух хорошо растворимых солей. Возьмем водный раствор натрия сульфата – Na2SO4. Его молекула в воде диссоциирует на три иона: два Na + и один SO4 2- .
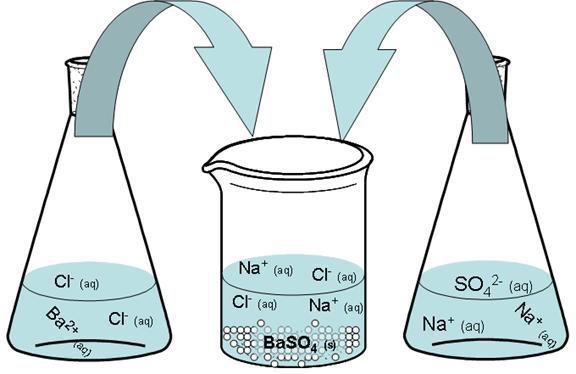
Возьмем также водный раствор хлорида бария – BaCl2, молекула которого диссоциирует на три иона: один Ba 2+ и два Cl — .
Смешаем водный раствор сульфата и смесь, содержащую хлорид. Бария сульфат образуется в результате соединения в одну молекулу двух ионов с одинаковым по величине и противоположным по знаку зарядом.
Ниже вы можете увидеть полное уравнение этой реакции (так называемое молекулярное).
В результате образуется нерастворимый осадок сульфата бария.
Товарный барит
На практике исходным сырьем для получения товарного сульфата бария, предназначенного для использования в буровых растворах при бурении нефтегазовых скважин, является, как правило, минеральный барит.
Термин «первичный» барит относится к товарной продукции, которая включает в себя сырой материал (получаемый из шахт и карьеров), а также продукты простого обогащения такими методами, как промывка, осаждение, сепарация в тяжелых средах, флотация. Большая часть сырого барита требует доведения его до минимальной чистоты и плотности. Минерал, который используется в качестве наполнителя, измельчают и просеивают до однородного размера так, чтобы, по меньшей мере, 97 % его частиц имели размер до 75 мкм, и не более 30 % были менее 6 мкм. Первичный барит также должен быть достаточно плотным, чтобы его удельный вес составил 4,2 г/см 3 или выше, но при этом достаточно мягким, чтобы не повредить подшипники.
Получение химически чистого продукта
Минеральный барит зачастую загрязнен различными примесями, в основном оксидами железа, окрашивающими его в различные цвета. Он обрабатывается карботермическим способом (нагревом с коксом). В результате получается сульфид бария.
BaSO4 + 4 С → BaS + 4 СО
Последний, в отличие от сульфата, растворим в воде и легко реагирует с кислородом, галогенами и кислотами.
Чтобы получить высокочистый выходной продукт, используется серная кислота. Сульфат бария, образуемый по такому процессу, часто называют бланфиксом, что в переводе с французского означает «белый фиксированный». Он часто встречается в потребительских продуктах, таких как краски.
В лабораторных условиях сульфат бария образуется путем объединения в растворе ионов бария и сульфат-ионов (см. выше). Поскольку сульфат является наименее токсичной солью бария из-за ее нерастворимости, отходы, содержащие другие его соли, иногда обрабатывают сульфатом натрия, чтобы связать весь барий, являющийся достаточно токсичным.
Из сульфата в гидроксид и обратно
Исторически барит использовался для производства гидроксида бария Ba(OH)2, необходимого при рафинировании сахара. Это вообще очень интересное и широко используемое в промышленности соединение. Оно хорошо растворимо в воде, образует раствор, известный как баритовая вода. Ее удобно использовать для связывания сульфат-ионов в различных составах путем образования нерастворимого BaSO4.
Выше мы видели, что при нагреве в присутствии кокса из сульфата легко получить водорастворимый сульфид бария – BaS. Последний же при взаимодействии с горячей водой образует гидроксид.
Гидроксид бария и сульфат натрия, взятые в растворах, при смешивании дадут нерастворимый осадок сульфата бария и едкий натрий.
Получается, что природный бария сульфат (барит) промышленным способом сначала превращается в бария гидроксид, а затем служит для получения того же сульфата при очистке различных солевых систем от сульфат-ионов. Точно так же будет проходить реакция и при очистке от ионов SO4 2- раствора сернокислой меди. Если сделать смесь «гидроксид бария + сульфат меди», то в результате получится гидроксид меди и нерастворимый бариевый сульфат.
Даже в реакции с самой серной кислотой ее сульфат-ионы будут полностью связаны барием.
Использование в буровых растворах
Около 80 % мирового производства сульфата бария, очищенного и измельченного барита, потребляется в качестве компонента буровых растворов при создании нефтегазовых скважин. Добавка его увеличивает плотность жидкости, закачиваемой в скважину, с целью лучшего сопротивления высокому пластовому давлению и предотвращения прорывов.
Когда скважина бурится, долото проходит через различные образования, каждое из которых имеет свои характеристики. Чем больше глубина, тем больший процент барита должен присутствовать в структуре раствора. Дополнительным преимуществом является то, что бария сульфат – немагнитное вещество, поэтому он не мешает проведению различных измерений в скважине с помощью электронных устройств.
Лакокрасочная и бумажная промышленность
Большая часть синтетического BaSO4 используется в качестве компонента белого пигмента для красок. Так, бланфикс в смеси с двуокисью титана (TiO2) продается в качестве белой масляной краски, применяемой в живописи.
Сочетание BaSO4 и ZnS (сульфид цинка) дает неорганический пигмент, который называется литопоном. Он используется в качестве покрытия для определенных сортов фотобумаги.
Совсем недавно бария сульфат был применен для осветления бумаги, предназначенной для струйных принтеров.
Применение в химической промышленности и цветной металлургии
В производстве полипропилена и полистирола BaSO4 используют в качестве наполнителя в пропорции до 70 %. Он имеет эффект увеличения стойкости пластмасс к кислотам и щелочам, а также придает им непрозрачность.
Он также используется для производства других соединений бария, в частности его карбоната, который применяется для изготовления светодиодного стекла для телевизионных и компьютерных экранов (исторически в электронно-лучевых трубках).
Формы, используемые в отливке металлов, часто покрывают бария сульфатом для предотвращения сцепления с расплавленным металлом. Так поступают при изготовлении анодных медных пластин. Их отливают в медные изложницы, покрытые слоем сульфата бария. Когда жидкая медь затвердевает в виде готовой анодной пластины, она может быть легко извлечена из литейной формы.
Пиротехнические устройства
Поскольку соединения бария испускают зеленый свет при горении, то соли этого вещества часто используются пиротехнических формулах. Хотя нитрат и хлорат являются более распространенными, чем сульфат, последний широко используется в качестве компонента пиротехнических стробоскопов.
Рентгеноконтрастный препарат
Бария сульфат является рентгеноконтрастным агентом, используемым для диагностики определенных медицинских проблем. Так как подобные вещества являются непрозрачными для рентгеновских лучей (блокируют их в результате своей высокой плотности), то области тела, в которых они локализуются, появляются как белые участки на рентгеновской пленке. Это создает необходимое различие между одним (диагностируемым) органом и другими (окружающими его) тканями. Контраст поможет врачу увидеть любые особые условия, которые могут существовать в этом органе или части тела.
Бария сульфат принимается через рот или ректально при помощи клизмы. В первом случае он делает пищевод, желудок или тонкий кишечник непрозрачным для рентгеновских лучей. Таким образом, они могут быть сфотографированы. Если вещество введено при помощи клизмы, то толстую кишку или кишечник можно увидеть и зафиксировать рентгеновскими лучами.
Доза сульфата бария будет разной для разных пациентов, все зависит от типа теста. Препарат выпускается в виде специальной медицинской бариевой суспензии или в таблетках. Различные тесты, при которых нужен контраст и рентгеновское оборудование, требуют различного количества суспензии (в некоторых случаях необходим прием препарата в форме таблетки). Контрастное вещество должно использоваться только под непосредственным контролем врача.
СОЛИ БАРИЯ
Важнейшими промышленными солями бария являются хлорид, карбонат и сульфат. Выпускают также гидроокись, окись и перекись бария, нитрат, хромат, манганат, хлорат и другие соли, а также сульфид бария, который служит полупродуктом для производСтва других соединений бария.
Окись бария ВаО обычно получается в виде аморфной, пористой массы с плотностью 4,73—5,46 г/см3 могут быть получены кубические кристаллы с плотностью 5,72 г/см3. Плавится при 1923°. Довольно хорошо растворяется в расплавленных хлоридах и сульфатах щелочных металлов, не вступая с ними в реакции обмена; так, например, растворимость ВаО при 1200° в NaCl 5,33, а в Na2S04 7,58 мол. % i. Окись бария энергично соединяется с водой ВаО + Н20 = Ва(ОН)2 + 22,3 ккал
Образуя гидроокись бария — белый, аморфный порошок с плотностью 4,5 г/см3. При 20° в воде растворяется 3,75%, а при 80° 53,17% Ва(ОН)2; в присутствии хлоридов и нитратов щелочных металлов растворимость увеличивается, а в присутствии гидроокисей — уменьшается.
Из водных растворов системы Ва(ОН)2—Н20 кристаллизуется Ва(0Н)2-8Н20 с плотностью 1,66 г/см3, конгруэнтно плавящийся при 78,3°. Растворение Ва(0Н)2-8Н20 в воде идет с поглощением тепла (—15,2 ккал/моль). Из концентрированных растворов, содержащих 57—62,2% Ва(ОН)2, кристаллизуется Ва (ОН2) • ЗН20; концентрации 62,2% соответствует перитектическая точка при 88°. При более высоких концентрациях выделяется Ва(0Н)2-Н20, имеющий точку полиморфного превращения при 185° и перитектического перехода в безводный Ва(ОН)2 при 199° (концентрация в точке пе-
Рехода 88,2% Ва(ОН)2). Безводная гидроокись бария при 250°претерпевает полиморфное превращение и плавится без разложения при 408°2. При нагревании до 900—1000° получается безводная окись бария 3.
Перекись бария4 Ва02— белый порошок с плотностью 4,96 г/см3, весьма устойчивый в сухом виде. Технический продукт содержит 80—90% Ва02 и окрашен соединениями железа в желтоватый или зеленоватый цвет. Перекись бария обладает парамагнитными свойствами. При нагревании с углем действует как деполяризатор, при этом протекает реакция:
2Ва02 + С = 2ВаО + С02
Элемент Ва02 — уголь развивает электродвижущую силу, равную 1 в. При нагревании выше 700° Ва02 переходит в тестообразную массу и разлагается по обратимой реакции: 2Ва02 5=± 2ВаО + 02 — 34,2 ккал
Эта реакция ускоряется в присутствии влаги, гидроокиси бария и других веществ.
Многочисленные литературные данные4 о давлении диссоциации Ва02 при разных температурах весьма противоречивы. Вероятно, равновесное давление кислорода равно 1 ат приблизительно при 840°.
Перекись бария является сильным окислителем. Она окисляет S02 в сульфат (на холоду), N20 и NO в нитрат (при нагревании), разлагает сухой хлористый водород с выделением С12, С120 и даже 03. Окисление органических веществ может сопровождаться взрывом и воспламенением. С водой Ва02 образует сначала Ва02 • 8Н20, затем Ва(ОН)2 и Н202. При действии перекиси водорода на слабощелочные растворы бариевых солей ниже 30° или на октагидрат перекиси бария (при 0°) образуются белые кристаллы Ва02 • 2Н202. Выше 30° образуется Ва02 • Н202. В системе Ва (ОН)2—Н202—Н20 в пределах температур от —10 до +50°, помимо октогидрата перекиси бария Ва02 • 8Н20, выделяющегося только при температурах, близких к 0°, и малых концентрациях Н202, в твердых фазах существуют дипероксигидрат Ва02 • 2Н20 и монопероксигиДрат Ва02 • Н205. Установлена возможность получения надперекиси бария Ва(02)2 при взаимодействии перекиси бария с кислородом под давлением больше 3000 ат6.
Хлористый барий ВаС12 • 2Н20 кристаллизуется из водных растворов с двумя молекулами воды в виде бесцветных пластинок с плотностью 3,05 г/см3. Выше 113° теряет кристаллизационную воду. Безводный имеет плотность 3,86 г/см3 и плавится при 962®. Насыщенный водный раствор содержит при 0° — 24,0%, при 100°—37,0% ВаС12. Водные растворы, содержащие ВаС12 и Вв(ОН)2, обладают хорошими буферными свойствами в облает®
.14 м. Е. Позин
рН = 13,62 — г- 13,827. В присутствии НС1 и особенно СаС1г растворимость ВаС12 в воде резко уменьшается (рис. 132)8.
Изучены свойства растворов ВаС12 в расплавленных солях — нитратах9, хлоридах и других10. В системе ВаСЬ—СаС12, имеющей эвтектику с 35 мол. % ВаСЬ при 605°, обнаружено соединение ВаС12 • СаСЦ с Tnjl 632°
В системе ВаС12—КС1—NaCl существует двойная соль ВаС12« ■ 2КС112.
Нитрат бария Ba(NOa)2 представляет собой бесцветные окта — эдрические кристаллы плотностью 3,21 г/см3, плавящиеся при 592°.
При нагревании разлагается с образованием вначале нитрита бария, затем окиси бария. Насыщенный водный раствор при 0° содержит 4,8%, при 20° —7,9%, при 100°— 25,5% Ba(N03)2. В присутствии нитрата и хлорида кальция растворимость Ba(N03)a значительно понижается. Составы эвто — нических растворов при 100° (в мол.%): для системы Ba(N03)2—Са(КЮз)2—Н20 меньше 0,1 Ba(N03)2 и больше 99,9 Ca(N03)2, количество воды 140,9 М на 100 М солей; для системы Ba(N03)2— Рис, 132. Растворимость ВаС12—Н20 28,5 Ba(N03)2 и 71,5 ВаС12, ко — ВаС12 в воде в присут — личество воды 1320 М на 100 М солей. Вы — ствии СаС12. саливающее действие СаС12 объясняется,
По-видимому, его гидратацией 13′ н.
Карбонат бария ВаС03 имеет три. модификации: ниже 811° — а-модификация, кристаллы ромбической системы (витерит) с плотностью 4,3 г/см3, выше 811° стабильна гексагональная модификация, выше 982° — кристаллы кубической системы. Карбонат бария устойчив при достаточно высоких температурах. Давление диссоциации при 1200° равно 92 мм рт. ст., при 1400°
1 ат. Несколько ниже 1400° ВаС03 начинает спекаться; плавится при 1740°. В воде почти не растворим — при 18° в 1 л воды растворяется
0,02 г ВаС03. Растворимость его повышается в присутствии угольной кислоты или солей аммония, а особенно в концентрированных растворах Na2S04, MgS04, ZnS04, Ca(N03)2, CaCl2, K2C03, MgCl2. В водной системе BaC03 + Na2S04 BaS04 + Na2C03, при 33° и оптимальном отношении BaC03: Na2S04, равном 11:5, после 7-часового перемешивания выход Na2C03 в виде 5—6%-ного раствора достигает 89% 15. В системе BaS04 — К2С03 — Н20 при всех температурах стабильной парой солей является ВаС03 и K2S04. Описаны условия превращения ВаС03 в окись, феррит и другие соединения бария 1б. При нагревании смеси ВаС03 и Si02 взаимодействие начинается выше 700° с образованием метасиликата бария, а выще 800°— ортосиликата. При 1000° и избытке ВаС03 на
ряду с ортосиликатом образуется трехбариевый силикат. В смесях, богатых ЭЮг, метасиликат образуется только выше 1000°Взаимодействие эквимолекулярных количеств ВаС03 и ТЮ2 начинается выше 400° с образованием BaTiOs. В интервале 1150—1250° образуется тетрагональная модификация ВаТЮ3. Титанат бария обладает сегнето-электрическими свойствами в широком диапазоне температур и в этом отношении имеет ряд преимуществ перед другими сегнето-электриками. Монокристаллы титаната бария могут быть получены из расплавленных систем титаната бария и фторидов, хлоридов, сульфатов, силикатов, карбонатов и других соединений щелочных металлов; титанат бария плохо растворим в расплавах большинства галогенидов щелочных металлов, за исключением фторидов натрия и калия 18,19.
Сульфат бария BaS04 имеет плотность 4,5 г/см3, при
1150° претерпевает полиморфное превращение, при
1400° начинает заметно диссоциировать, плавится при 1580°. Искусственно осажденный в виде белого, тонкого, почти аморфного порошка называется бланфиксом. Почти совершенно не растворим в воде20 — насыщенный водный раствор при 18° содержит 0,00023% BaS04. Растворяется в расплавленных щелочах, в концентрированной серной кислоте с образованием кислого сернокислого бария, немного растворяется в кипящей соляной кислоте. В системе BaS04 — NaCl наблюдается полная смешиваемость в жидком состоянии при отсутствии соединений и твердых растворов; в эвтектике при 741° содержится 33,3 вес.% BaS0421. При длительном кипячении измельченного барита в растворе соды образуется двойная соль сульфата — и карбоната бария.
Сульфид бария BaS при кристаллизации из расплавленного состояния образуется в виде кристаллов кубической формы с плотностью 4,25 г/см3. Технический продукт представляет собой пористую массу серого или черного цвета (цвет зависит от количества примеси угля). При растворении в воде BaS гидролизуется с образованием гидроокиси и гидросульфида бария, т. е. ионов ОН» и HS-:
2BaS + 2Н20 — Ba(HS)2 + Ва(ОН)2
Из водного раствора может быть выкристаллизован BaS • 6Н20.’ Кислоты, в том числе и С02 воздуха, выделяют из BaS сероводород. При нагревании с концентрированными кислотами BaS раз: лагается с выделением S02 и S. В чистом виде сернистый барий обладает люминофорными свойствами.
При взаимодействии раствора Ва(ОН)2 с сероводородом образуются полисульфиды бария с примесью небольших количеств тиосульфата, сульфида и сульфита. Полисульфиды образуются также при растворении в воде смеси тонко размолотых плава сернистого, бария и серы. Образовавшиеся вначале низшие полисульфиды,.
Реагируя с серой, переходят в высшие — BaS-Se, BaS-S4 22. Полисульфиды бария достаточно устойчивы: температуры плавления BaS2 — 925°, BaS3 — 554°.
Фторид бария BaF2 имеет плотность 4,83 г/см3 и плавится при 1280°. При 18° в 1 л воды растворяется 1,63 г BaF2.
Кремнефторид бария BaSiF6 получают взаимодействием растворов кремнефтористоводородной кислоты и хлорида бария, а также по реакции23
BaS + H2SiF6 = BaSiF6 + H2S
При небольшом избытке H2SiF6 во избежание образования BaF2 по реакции:
BaSiF6 + 2BaS + 2Н20 = 3BaF2 + Si02 + 2H2S
При 25° в 1 л воды растворяется 0,25 г BaSiF6.
Все растворимые соединения бария ядовиты. Смертельная доза
0,8 г бариевой соли. Средство первой помощи — прием внутрь разбавленного раствора сульфата магния. О технике безопасности в производстве бариевых солей см.24.
Хлорид бария применяется в качестве яда для борьбы с вредителями полевых, огородных и садовых культур, в частности для уничтожения свекловичного долгоносика25. Его применяют также в керамической промышленности, в текстильном производстве, для изготовления некоторых минеральных красок, для очистки котельной воды и рассолов от иона SOr, при получении некоторых редких металлов (например, радия) в качестве соосадителя при выделении их солей из растворов и т. д.
Нитрат бария применяют для получения окиси и перекиси бария, в пиротехнике при изготовлении осветительных составов (Ва окрашивает пламя в желтовато-зеленый цвет), в производстве некоторых взрывчатых веществ. Системы, содержащие нитрат бария и хлориды натрия и калия, представляют интерес в качестве низкотемпературных соляных ванн для термической обработки металлов 2б.
Карбонат бария используют для изготовления карбюризаторов, применяемых для науглероживания (цементации) стальных изделий при высоких температурах. Они представляют собой зерна древесного угля или активированного каменноугольного полукокса (ГОСТ 5535—50), покрытые слоем ВаС03; содержание последнего 10—25%. Карбонат бария применяют в керамической промышленности, в производстве оптического стекла, эмалей, а также в радио — ламповом производстве для покрытия катодов27-18. Карбонат бария используют также в качестве зооцида — для борьбы с грызунами.
Окись, гидроокиси и перекись бария производятся в небольших количествах. Окись бария добавляют к материалам, из которых изготовляют сердечники электромагнитов. Перекись бария применяют для изготовления запалов, используемых при термитной сварке. Гидроокись бария в некоторых странах употребляют в сахарной промышленности для выделения сахара из мелассы.
Природный сульфат бария — барит служит в СССР основным сырьем для производства всех солей бария. Тонкоизмельченный барит используют как утяжелитель глинистых растворов при глубоком бурении нефтяных и газовых скважин. В США для этой цели используют около 80% потребляемого барита 29-30. Помимо этого, его применяют для производства бланфикса и литопона, а также при изготовлении специальных сортов стекла, эмалей, глазури и др. Бланфикс и лучшие сорта барита используют в качестве наполнителя при производстве высших сортов бумаги, при производстве резины, пластмасс, при изготовлении аппретуры в текстильной промышленности, для получения огне — и кислотоупорных красок и замазок, в электротехнической и парфюмерной промышленности, а также в рентгенотехнике. Литопон — эквимолекулярная смесь BaS04 и ZnS, осаждающаяся при сливании растворов BaS и ZnS04, имеет Наибольшее значение как стойкая против действия щелочей и сероводорода белая краска 31>32. Однако производство литопона резко сокращается — его вытесняют титановые пигменты, имеющие лучшую укрывистость, светостойкость и др.
Сульфид бария является промежуточным продуктом при изготовлении соединений бария из барита и применяется в кожевенной промышленности, а также при изготовлении инсектофунгицидов, в особенности сольбара — полисульфидов бария. Сольбар получают смешением размолотого до тонкости частиц меньше 0,1 мм плава сернистого бария с молотой серой. Сольбар, в отличие от извест — ково-серных отваров, обладает транспортабельностью и незначительной фитоцидностью33. Фунгицидное и инсектицидное действие сольбара (и других полисульфидов) обусловлено не только полисульфидами, но и тонкодисперсной элементарной серой, являющейся продуктом их разложения. Сернистый барий особой чистоты используют при изготовлении люминофоров.
Фтористый барий является антисептиком для древесины и инсектицидом. Более широкое распространение в качестве инсектицида получил кремнефтористый барий, в отличие от BaF2 не ожигающий растения.
Хлорат бария применяют в пиротехнике и в производстве взрывчатых веществ, перхлорат бария — в качестве обезвоживающего средства, ацетат бария — при крашении тканей, манганат бария — в малярном деле и проч.
Титанат и ферриты бария, обладающие сегнето-электрическими ввойствами, применяют в радиоэлектронике. . Как тугоплавкий
http://www.syl.ru/article/202535/new_chto-takoe-bariya-sulfat-kak-poluchayut-sulfat-bariya
http://msd.com.ua/texnologiya-mineralnyx-solej-udo-brenij-pesticidov-promyshlennyx-so-lej-okislov-i-kislot/soli-bariya/