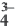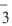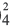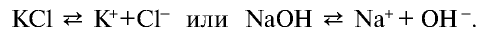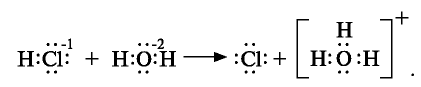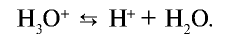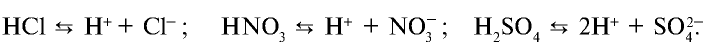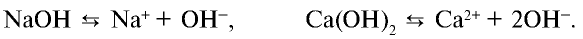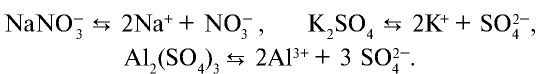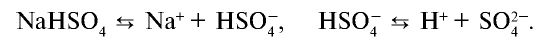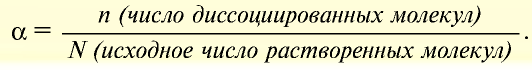Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + . Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н + ):
Константа диссоциации по первой ступени:
Вторая ступень диссоциации (отщепление иона водорода Н + от сложного иона НСО3 — ):
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н + (Н3О + ).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — .
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН — ):
Вторая ступень диссоциации (отщепляется гидроксид-ион ОН — от сложного катиона FeOH + ):
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН — .
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н + или ОН — от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н + и гидроксид-анионы ОН — , т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н + и анионы ОН — .
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.
Сложный анион НСО3 — (гидрокарбонат-ион) частично диссоциирует по уравнению:
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН — .
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Сложный катион частично диссоциирует по уравнениям:
Для обеих ступеней диссоциации Fe(OH)2 + .
Электролитическая диссоциация. Ионно-молекулярные уравнения
Электролитами называют вещества, растворы и расплавы которых про-
водят электрический ток.
К электролитам относятся неорганические кислоты, а также основания, амфотерные гидроксиды и соли. Они распадаются в водных растворах и расплавах на катионы (К n + ) и анионы (А m — ).
Процесс распада молекул электролитов на ионы в среде растворителя получил название электролитической диссоциации (или ионизации).
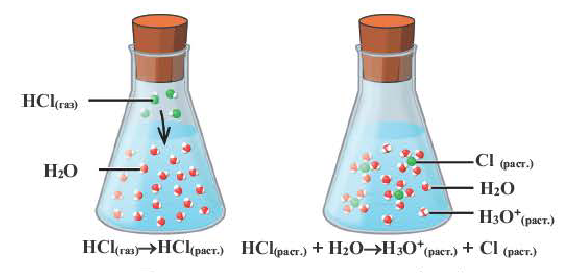
Для количественной характеристики силы электролита используют понятие степени электролитической диссоциации (ионизации) — α, которая равна отношению числа молекул, распавшихся на ионы (n), к общему числу молекул электролита, введенных в раствор (N):
Такимобразом, α выражаютв долях единицы.
По степени диссоциации электролиты условно подразделяют на сильные (α » 1) и слабые (α 3+ +3 SO4 2– NаHCO3 = Nа + +НСО3 –
СuОНСl = CuOH + +Cl – Ва(ОН)2 = Ва 2+ +2ОН –
Слабые электролиты
· Гидроксиды металлов основного характера (кроме щелочных и щелочноземельных) и гидроксид аммония NH4OH.
Для слабых электролитов диссоциация – обратимый процесс, для которого справедливы общие законы равновесия.
Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации (ионизации) КД (табл.П.3):
CH3COOH 
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, и каждую ступень равновесного состояния характеризует своя константа диссоциации (причем Кд1 всегда больше Кд2 и т.д.), например при диссоциации H2S :1-я ступень H2S 

2-я ступень HS – 

где [ ] ─ равновесные концентрации ионов и молекул.
1-я ступень Сu(OH)2 
2-я ступень Cu(OH) + 
Амфотерные гидроксиды, напримерPb(OH)2 ,диссоциируют по основному типу: Pb(OH)2 
PbOH + 
и кислотному: H2PbO2 
HPbO2 – 
В растворах электролитов реакции протекают между ионами. Для записи ионных реакций применяют ионные уравнения. При составлении ионных уравнений реакций все слабые электролиты, газы и труднорастворимые электролиты записывают в молекулярной форме, все сильные электролиты (кроме труднорастворимых солей) в ионной форме. Примеры составления ионных уравнений реакций:
· образование труднорастворимых соединений:
· реакции с участием слабодиссоциирующих соединений:
СН3СООNa + НС1 = СН3COOH + NаС1
НС1 + NаОН = NаС1 + Н2O Н + + ОН – = Н2O
· образование газообразных веществ:
Пример 1. Осуществить превращения NаОН ® NаНSО3 ® Nа2SO3 .
Пример 2.Осуществить превращения Ni(ОН)2 ® (NiOH)2SO4 ® NiSO4.
Внимание! Основные соли, как правило, нерастворимы в воде, поэтому при написании ионных уравнений их не расписывают на ионы.
Задания к подразделу 3.2
Задания 121-140. Напишите в молекулярной и ионной формах уравнения возможных реакций предложенных оксидов с H2O, Na2O, KOH, HNO3.
| 121.N2O3; Na2O | 126.SO2; CuO | 131.MnO; P2O5 | 136.N2O5; CuO |
| 122.SnO; P2O5 | 127.Cr2O3; Cl2O7 | 132.BaO; Mn2O7 | 137.P2O5; CoO |
| 123.SO3; CaO | 128.CoO; ZnO | 133.CdO; SnO | 138.PbO; MgO |
| 124.SiO2; NiO | 129.P2O3; FeO | 134.As2O5; CuO | 139.Cl2O7; MnO |
| 125.PbO; N2O5 | 130.Fe2O3; K2O | 135.Al2O3; SiO2 | 140.SO3; TiO |
Задания 141-160. Напишите для предложенных соединений уравнения диссоциации, а также в молекулярной и ионной формах уравнения возможных реакций взаимодействия их с H2SO4 и NaOH.
| 141.HCl; Cr(OH)3 | 151.Ca(OH)2; H3PO4 |
| 142.Cd(OH)2; H2S | 152.HNO3; Be(OH)2 |
| 143.Cu(OH)2; HBr | 153.H2Сr2O7; KOH |
| 144.H2SO3; Sn(OH)2 | 154.HCN; Ga(OH)3 |
| 145.H2SiO3; Pb(OH)2 | 155.KOH; H2CO3 |
| 146.CH3COOH; Fe(OH)3 | 156.HF; Be(OH)2 |
| 147.H2Se; Zn(OH)2 | 157.NH4OH; HClO4 |
| 148.Fe(OH)2; H3AsO3 | 158.Pb(OH)2; HNO2 |
| 149.RbOH; HI | 159.Mg(OH)2; HClO |
| 150.H2Te; Al(OH)3 | 160.Ga(OH)3; HMnO4 |
Задания 161-180. Напишите уравнения диссоциации солей и назовите их.
| 161.ZnCl2, MnOHCl, Ba(HSO3)2 | 171.Pb(HSO4)2, NH4NO3, CoOHCl |
| 162.K2HAsO3, AlOHCl2, Na2SO3 | 172.Al(OH)2NO3, Fe2(SO4)3, KHSe |
| 163.KHSO3, (PbOH)2SO4, CrBr3 | 173.CsHTe, Ca3(PO4)2, MnOHBr |
| 164.Fe(NO3)3, SnOHCl, NaHTe | 174.Mn(NO3)2, Bi(OH)2Cl, KHS |
| 165.NaHSe, CoOHNO3, MgCl2 | 175.Al2(SO4)3, CrOHCl2, KHSO3 |
| 166.CdOHBr, NiCl2, KH2PO4 | 176.NaHSe, NiOHNO3, ZnSO4 |
| 167.CaBr2, (SnOH)2SO4, K2HPO4. | 177.CrOHSO4, BaBr2, CsHSO3 |
| 168.BaCl2, Ca(HCO3)2, AlOHCl2 | 178.Cu(NO3 )2, CoOHCl, NaHS |
| 169.NiBr2, (CoOH)2SO4, KHCO3. | 179.FeCl2, NaH2AsO4, KCrO2 |
| 170.NiOHCl, NiBr2, NaH2PO4 | 180.AlOHBr2, Sr(HS)2, K2SO3 |
Задания 181-200. Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений.
186.NiCl2 Ni(OH)2 NiOHCl NiCl2; Ba(HS)2 BaS
Гидролиз солей
Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды.
Гидролиз является обратимым процессом. В реакциях гидролиза участву-
ют ионы слабых электролитов: катионы слабых оснований и анионы слабых кислот. Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O 
· Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (pH > 7). Первая ступень гидролиза: Na2CO3 + HOH 

· Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону. Реакция среды кислая (pH 2+ + HOH 
· Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется константами диссоциации образовавшихся слабых электролитов.
CH3COONH4 + HOH 
CH3COO — + NH4 + + HOH 
· При совместном гидролизе двух солей образуются слабое основание и слабая кислота: 2FeCl3 + 3Na2S +6H2O = 2Fe(OH)3 ¯ + 3H2S + 6NaCl
· Соль, образованная сильной кислотой и сильным основанием, гидролизу
не подвергается, реакция среды нейтральная: KNO3 + HOH ¹
Ионы K + и NO3 — не образуют с водой слабодиссоциирующих продуктов (KOH и HNO3 – сильные электролиты).
Задания к подразделу 3.3
Задания 201-220. Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи).
| 201.NaNO2, Cu(NO3)2 | 211.Na2HPO4, Mg(NO3)2 |
| 202.AlCl3, NaHCO3 | 212.Al2 (SO4)3, Na2SeO3 |
| 203.Na3PO4, ZnCl2 | 213.CuSO4, K3PO4 |
| 204.FeCl2, K2S | 214.Na2SO3, Fe2 (SO4)3 |
| 205.K2SO3, ZnSO4 | 215.NaCN, FeSO4 |
| 206.NH4Cl, KClO | 216.Ba(CH3COO)2, CoSO4 |
| 207.Na2Se, MnCl2 | 217.NiSO4, NaF |
| 208.ZnSO4, BaS | 218.Pb(NO3)2, Ba(NO2)2 |
| 209.Ni (NO3)2, KNO2 | 219.Cr2(SO4)3, Na CH3COO |
| 210.NH4Br, Na2S | 220.KHS, MgSO4 |
Задания 221-240. Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза предложенных солей.
| 221.Fe2(SO4)3 + Na2CO3 | 231.CrCl3 + K2S |
| 222.Na2S + Al2 (SO4)3 | 232.Na2CO3 + Cr (NO3)3 |
| 223.NH4Cl + Na2SiO3 | 233.K2SiO3 + Bi (NO3)3 |
| 224.Cr2 (SO4)3 + K2S. | 234.Na2SO3 + CrCl3 |
| 225.K2CO3 + Bi (NO3)3 | 235.NH4NO3 + Na2SiO3 |
| 226.Na2S + AlCl3 | 236.AlCl3 + Na2SO3 |
| 227.BeSO4 + K2S | 237.K2SO3 + CrCl3 |
| 228.Cr2 (SO4)3 + Na2SO3 | 238.Na2S + Al2 (SO4)3 |
| 229.K2SO3 + AlBr3 | 239.Fe (NO3)3 + K2CO3 |
| 230.Bi (NO3)3 + Na2CO3 | 240.Al2 (SO4)3 + Na2CO3 |
ЧТО И КАК ПИСАЛИ О МОДЕ В ЖУРНАЛАХ НАЧАЛА XX ВЕКА Первый номер журнала «Аполлон» за 1909 г. начинался, по сути, с программного заявления редакции журнала.
Конфликты в семейной жизни. Как это изменить? Редкий брак и взаимоотношения существуют без конфликтов и напряженности. Через это проходят все.
Что способствует осуществлению желаний? Стопроцентная, непоколебимая уверенность в своем.
Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Теория электролитической диссоциации в химии — формулы и определение с примерами
Содержание:
Электролитическая диссоциация:
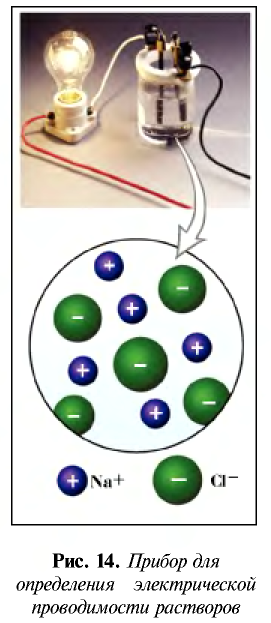
По электрической проводимости вещества делятся на две группы.
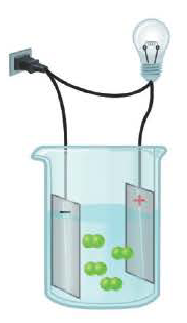
Вещества, водные растворы и расплавы которых проводят электрический ток, называются электролитами.
Вещества, водные растворы и расплавы которых не проводят электрический ток, называются неэлектролитами. Нерастворимые в воде неорганические вещества (H2SiO3, SiO2, AgCl, CaSO4 и др.), чистая вода, большинство органических веществ неэлектролиты.
Процесс распада электролитов на ионы при растворении их в воде или расплавлении называется электролитической диссоциацией.
Основные теоретические положения электролитической диссоциации дал в 1887 году шведский ученый Сванте Аррениус. Современная теория электролитической диссоциации состоит из трех основных положений:
1) Электролиты в растворе и в расплаве распадаются (диссоциируют) на ионы, обладающие положительным или отрицательным зарядом
HNO3 

Ионы в растворе находятся в беспорядочном движении в разных направлениях.
2) Под воздействием электрического тока ионы движутся направленно: положительно заряженные ионы направляются к катоду, а отрицательно заряженные ионы — к аноду. Поэтому положительно заряженные ионы называются катионами, а отрицательно заряженные ионы анионами.
3) Диссоциация — обратимый процесс: наряду с распадом молекул происходит также и соединение — ассоциация ионов.
KA 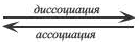
Ионы и нейтральные атомы отличаются друг от друга как по строению, так и по свойствам. Например:
| 11Na 0 l s 2 ∕2s 2 2p 6 ∕3s 1 Электронная формула атома натрия | 11Na + ls 2 ∕2s 2 2p 6 / Электронная формула иона натрия |
| 11Na 0 l)2e 2)8e 3)1е Схема строения атома натрия | 11Na + l)2e 2)8е Схема строения иона натрия |
| Восстановитель | Окислитель |
Несмотря на все это, С.Аррениус не смог полностью раскрыть сущность процесса электролитической диссоциации. Он не учитывал роль молекул растворителя и полагал, что в водном растворе находятся свободные ионы. При диссоциации электролитов в растворе образуются положительно и отрицательно заряженные частицы, состоящие из одного или нескольких атомов.
| Катионы | Анионы |
| LI+, Na + , K + , Be 2+ , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , Cu 2+ ,Hg 2+ , Ag + | CO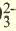 , Cl, S 2- , SO , Cl, S 2- , SO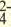 , NO3 , SiO , NO3 , SiO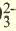 , ClO , ClO2 , ClO , ClO2 |
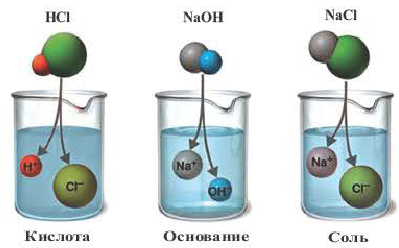
Причиной разложения электролита на ионы является его взаимодействие с полярными молекулами воды. При растворении в воде любой соли, например, кристаллов хлорида натрия, отрицательные полюсы полярных молекул воды притягиваются к положительно заряженным ионам натрия Na + , а положительные полюсы к отрицательно заряженным хлорид-ионам Cl . В результате растворения в воде ионы отщепляются от кристалла и, перейдя в раствор, гидратируются.
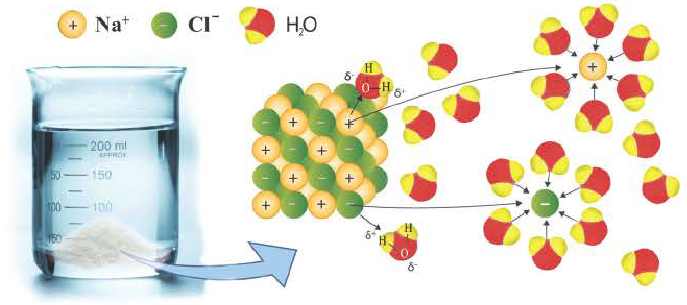
Диссоциация водного раствора хлорида натрия
Наряду с веществами, кристаллическая решетка которых имеет ионное строение, молекулы с полярной ковалентной связью также в воде распадаются на ионы. При растворении в воде хлорида водорода (хлороводорода) с полярно-ковалентной связью под действием полярных молекул воды связь между атомами разрывается. Молекула хлорида водорода распадается на два гидратированных иона. Электронная пара переходит к атому хлора, в результате полярная ковалентная связь превращается в ионную связь.
Диссоциация молекулы хлороводорода
Процесс диссоциации характеризуется степенью диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называется степенью диссоциации и обозначается знаком а (альфа).
Здесь а показывает степень диссоциации,n число диссоциированных молекул, N— общее число растворенных молекул.
Величина а принимает значения между 0÷1, при выражении в процентах между 0÷100%.
Если α=0, значит, диссоциация не произошла.
Если α=1 или а= 100%, значит, электролит полностью диссоциировал на ионы.
Величина n может принимать разные значения от 0 до N.
Если количество электролита дается в молях:
α= vдис./vобщ. или α=vобщ . 100%
vобщ. — общее растворенное молярное количество вещества.
vдис. — диссоциированное молярное количество вещества.
По значению степени диссоциации электролиты делят на три группы.
| Сильные Электролиты | Электролиты средней силы | Слабые электролиты |
| a ≥ 30% | a=3 ÷ 30% (или 0,03 ÷ 0,3) | a 3% 3% (или a  0,03) 0,03) |
| Щелочи: LiOH, NaOH, КОН, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 Растворимые в воде соли, сильные кислоты | Mg(OH)2, H3PO4, H2C2O4 (щавелевая кислота) | NH4OH, H2CO3, H2S, HCN, H2O, CH3COOH и другие органические кислоты |
Электролиты, которые при растворении в воде или расплаве полностью диссоциируются на ионы, называются сильными электролитами.
Электролиты, которые при растворении в воде или расплавлении частично диссоциируются на ионы, называются слабыми электролитами.
Факторы, влияющие на степень диссоциации
Значение степени диссоциации зависит от ряда факторов.
Природа электролита (характер связи в молекуле электролита). Слабые и средней силы электролиты диссоциируют в растворе частично, а сильные электролиты полностью.
Природа растворителя
Диэлектрическая постоянная показывает, во сколько раз сила взаимодействия между двумя электрическими зарядами, находящимися в определенной среде, меньше по отношению к вакууму. Поскольку диэлектрическая постоянная воды (проникающая способность) при 20 o C высокая, способность ионизации также сравнительно высокая. Численное значение ее диэлектрической постоянной (81) показывает, что сила взаимодействия между ионами в растворе с водной средой в 81 раз слабее по сравнению с их силой взаимодействия в кристалле. Если в растворе, приготовленном с одинаковой концентрацией, в качестве среды берется вода, то степень диссоциации бывает сравнительно больше по отношению к растворителям.
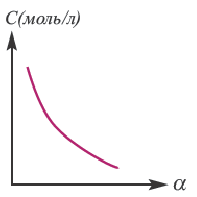
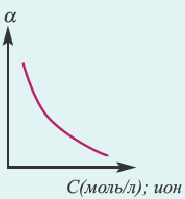
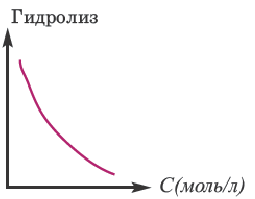
Концентрация раствора электролита. При уменьшении концентрации раствора (т.е. разбавлении раствора), вероятность встречи ионов уменьшается и равновесие смещается в сторону ионизации (степень диссоциации повышается). При уменьшении числа столкновений между ионами в разбавленных растворах в заметной степени снижается и скорость образования молекул. Это, в свою очередь, способствует смещению равновесия в сторону диссоциации и повышению степени диссоциации. Значит, степень диссоциации находится в обратной зависимости от концентрации электролита.
Влияние температуры
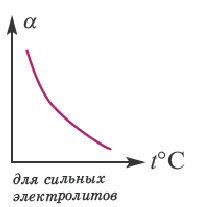
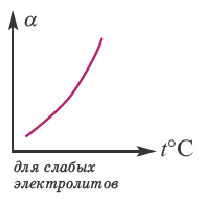
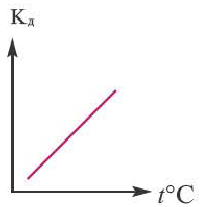
В процессе диссоциации электролитов в небольшом количестве поглощается или выделяется тепло. Обычно нагревание раствора на IoC усиливает процесс диссоциации большинства электролитов на 0,05%. При повышении температуры усиливается и электрическая проводимость электролита. Однако это связано как с понижением степени гидратации ионов и вязкости среды, так и с повышением скорости движения ионов. В этом отношении вода занимает особое место. Диссоциация воды эндотермический процесс, который протекает с затратой 57,3 кДж теплоты. Вот почему с повышением температуры повышается и степень диссоциации воды. При нагревании раствора сильных электролитов степень диссоциации понижается, а при нагревании слабых электролитов степень диссоциации повышается.
Влияние концентрации ионов. Повышением или понижением концентрации ионов, образованных в результате диссоциации, можно сместить равновесие. Например, NH4OH диссоциирует на ионы в воде по следующему
уравнению:
NH4OH
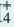
При добавлении в раствор немного NH4CI концентрация иона NH 
Постоянная диссоциации (Кд). Поскольку значение степени диссоциации зависит от концентрации электролита использование 
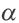
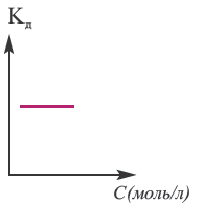
Постоянная диссоциации равна отношению произведения концентраций ионов на концентрацию молекул, не разложившихся на ионы.
Например, формула вычисления постоянной диссоциации для уксусной кислоты следующая:
Поскольку Кд не зависит от концентрации, это постоянная величина. Значение Кд зависит от природы /электролита и растворителя и температуры. Чем больше значение Ka, тем больше диссоциирует электролит.
Электрическая проводимость бывает более высокой в том из растворов с одинаковым мольным количеством растворенных в них различных электролитов, в котором образуется наибольшее количество ионов. В ряду NaCl, FeCl2, AlCl3 в
водном растворе каждого из них электрическая проводимость повышается.
Диссоциация кислот, оснований и солей
Все растворимые кислоты в водных растворах диссоциируют на ионы водорода и кислотных остатков. C точки зрения теории электролитической диссоциации кислотам можно дать такое определение:
Кислоты это сложные вещества, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Диссоциация кислот
Свойства кислот (кислый вкус, воздействие на индикаторы и т.д.) связаны с наличием в растворе гидратированных ионов водорода (Н3О + ). Следовательно, общим для кислот является ион водорода H+ (или Н3О + ). Отсюда становится ясно, что цвет индикатора меняет ион H+ (или Н3О + ).
Одноосновные кислоты диссоциируют одноступенчато, двухосновные кислоты двуступенчато, а трехосновные кислоты (Н3РО4) грехступенчаго. Диссоциация двух- и трехосновных кислот в основном происходит в первой стадии (ступени). При ступенчатой диссоциации каждая последующая ступень протекает более слабо (т.е. при ступенчатой диссоциации процесс диссоциации протекает все медленнее). Основность кислот определяется количеством катионов водорода, образованных в процессе полной диссоциации.
| Диссоциация одноосновных кислот | Диссоциация двухосновных кислот | Диссоциация трехосновных кислот |
I. H2SO4  H + + H HSO H + + H HSO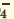 II. HSO4  H + + SO H + + SO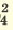 | I. H3PO4 H + +H2PO H + +H2PO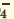 II. H2PO4  H + +HPO H + +HPO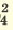 III.HPO 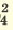  H+HPO H+HPO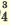 | |
I. H3PO3  H + + H2PO H + + H2PO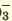 II. H2PO 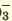  H + + HPО H + + HPО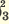 |
Знак обратимости  в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. Если скорость распада на ионы больше, чем скорость образования исходных ионов, процесс диссоциации смещается вправо, если меньше то влево. |
Диссоциация оснований
Электролиты, при диссоциации которых в качестве анионов образуются только гидроксоионы, называются основаниями.
Растворимые в воде основания называют щелочами. Как известно, кислотность оснований определяется количеством гидроксильных ионов (ОН ) в их молекуле. Количество гидроксильных групп показывает кислотность основания. Однокислотные щелочи диссоциируют одноступенчато, двукислотные щелочи двуступенчаго. Цвет индикагора также меняется под действием гидроксильного иона (ОН ).
| Диссоциация однокислотных щелочей | Диссоциация двукислотных щелочей |
NaOH  Na + + ОН Na + + ОН KOH  K + + ОН K + + ОН NH4OH  NH NH 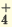 + ОН + ОН | I. Ca(OH)2 CaOH + + ОН CaOH + + ОН II. CaOH +  Ca 2+ + ОН Ca 2+ + ОН |
Основания, которые в процессе диссоциации образуют как ион H + так и ионы ОН , называют амфотерными гидроксидами. Амфотерные гидроксиды, взаимодействуя и с кислотами, и с основаниями, образуют соль и воду.
2OH + Zn 2+ 
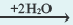
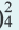
Диссоциация солей
Вещества, образующие в процессе диссоциации катион металла (или аммония) и анион кислотного остатка, называются солями.
В зависимости от вида, соли диссоциируют по-разному. Нормальные, двойные и смешанные соли диссоциируют одноступенчато.
| Диссоциация нормальных солей | Диссоциация двойных солей | Диссоциация смешанных солей |
(NH4)2SO4  2NH4 + SO4 2NH4 + SO4 FeCl3  Fe 3+ + ЗСI — Fe 3+ + ЗСI — Na3PO4  3Na + + PO 3Na + + PO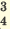 Na2SO4  Na + + SO Na + + SO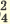 Na2ZnO2  2Na + + ZnO 2Na + + ZnO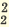 | NaKSO4  Na + + K + + SO 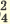 Na2KPO4  2Na + + K + +PO 2Na + + K + +PO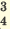 | CaClNO3  Ca 2+ + Cl + NO Ca 2+ + Cl + NO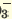 AICISo4  Al 3+ + Cl +SO Al 3+ + Cl +SO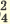 FeNO3Cl2  Fe 3+ + N0 Fe 3+ + N0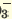 + 2СI — + 2СI — |
| Нерастворимые в воде соли (осадки) не диссоциируют. Они могут диссоциировать только в виде расплавов. |
Кислые соли диссоциируют ступенчато. Гидросоли диссоциируют двуступенчато, а дигидросоли трехступенчаго. Процесс диссоциации постепенно, поступенчато, слабеет.
| Диссоциация гидросолей | Диссоциация дигидросолей |
I. NaHSO4  Na + + HSO Na + + HSO II. HSO   H + + SO H + + SO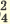 | I. KH2PO4  K + + H2PO K + + H2PO II. H2PO   H + + PO H + + PO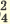 III. HPO 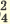  H + + PO H + + PO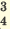 |
Основные соли также диссоциируют ступенчато: гидроксосоли диссоциируют двуступенчато, дигидроксосоли трехступенчато.
| Диссоциация гидросолей | Диссоциация дигидросолей |
I. CaOHNO3  CaOH + + NO CaOH + + NO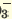 II. CaOH +  Ca 2+ + 0H — Ca 2+ + 0H — | I. Al(OH)2Cl  Al(OH) Al(OH) 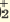 +Cl +Cl II. Al(OH) 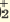  AlOH 2+ + ОН AlOH 2+ + ОН III. AlOH 2+  Al 3+ + ОН Al 3+ + ОН |
I. AlOH(NO3)2  AlOH 2+ +2NO AlOH 2+ +2NO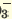 II. AlOH 2+  Al 3+ + 0H — Al 3+ + 0H — |
Реакции ионного обмена
Реакции обмена, протекающие между водными растворами электролитов, в прошлых разделах мы показывали молекулярными уравнениями. В действительности же, в этих реакциях участвуют не молекулы электролитов, а их диссоциированные ионы.
Взаимодействие водных растворов электролитов называют ионными реакциями, а уравнения таких реакций ионными уравнениями. Уравнение, полученное при сокращении ионов, не участвующих в реакции, называется сокращенным ионным уравнением.
Чтобы понять условия протекания реакций ионного обмена, нужно знать их важнейшие свойства.
Свойства ионов
Вам уже известно, что ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из них характерны специфические химические свойства.
При составлении ионных уравнений соблюдаются следующие правила:
- Полное уравнение реакции записывается в молекулярном виде. Т.е. химические формулы участвующих в реакции исходных веществ и конечных продуктов записываются вместе с их коэффициентами.
- Малодиссоциирующие (вода и в основном органические вещества), малорастворимые (осадок) и газообразные вещества записываются в молекулярной форме.
- Сильные электролиты, как полностью диссоциирующие вещества, записываются в ионном виде (такие уравнения называют полным ионным уравнением).
- Не участвующие в реакции ионы сокращаются. Уравнение, в котором указаны лишь участвующие в реакции ионы, называется сокращенным ионным уравнением.
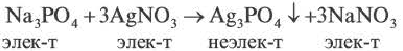
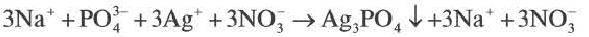
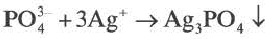
Если при реакциях заряды ионов не меняются, такие реакции называются реакциями ионного обмена.
Реакции ионного обмена протекают до конца в трех случаях:
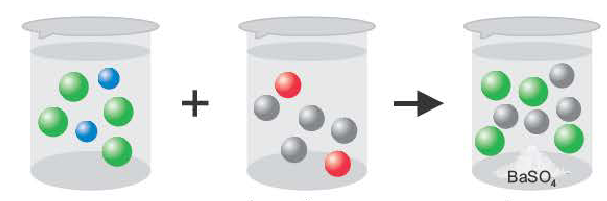
Если образуется осадок.
BaCI2 + Na2SO4 = BaSO4↓ + 2NaCI
Ba 2+ +2CI + 2Na + +SO 
Ba 2+ +SO 
Если получается слабодиссоциирующее вещество (например: вода)
H + +CI +Na + +OH = Na + + Cl + H2O
H + +ОН =H2O
Если получается газообразное вещество.

2H + +2CI + 2Na + +S 2 = H2S↑ + 2Na + + 2CI
2H + +S 2 =H2S↑
Полное ионное уравнение и сокращенное ионное уравнение реакций, протекающих с участием или с образованием двух и более неэлектролитов, бывают одинаковыми.
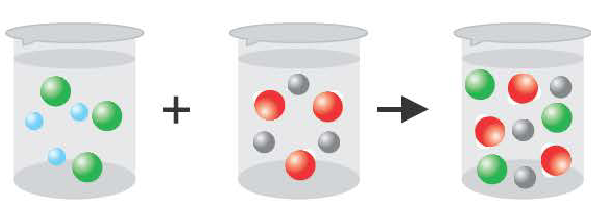
- 1) Ba(OH)2 + H2SO4 → BaSO4↓+ 2Н2О молекулярное уравнение
- Ba 2+ + 2ОН — + 2H + + SO
→ BaSO4↓+ 2 H2O полное или сокращенное ионное уравнение
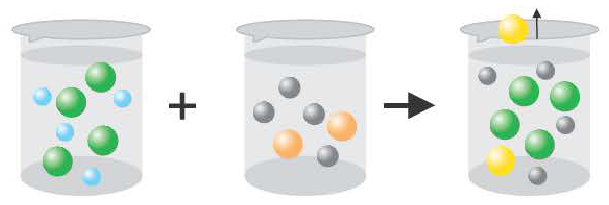
- 2) FeSO4 + Ba(OH)2 → BaSO4↓+ Fe(OH)2↓
- Fe 2+ + SO
+ Ba 2+ + 2ОН → BaSO4↓ + Fe(OH)2 2↓ полное или сокращенное ионное уравнение
Реакции ионного обмена используются для определения того или иного вещества или иона.
| Определяемый ион | Реактив, coσι ветствующнй иону (определитель) | Признаки реакции |
| H+(кислота) | индикатор | Изменение цвета |
| Cu 2+ | OH- (щелочь) | Синий осадок |
| Fe 2+ | Зеленоватый осадок, принимающий со временем бурый цвет | |
| Fe 3+ | Осадок бурого цвета | |
| Zn 2+ | Белый осадок, при избытке ОН растворяется | |
| Al 3+ | Студенистый белый осадок | |
| Mg 2+ | Белый осадок | |
| NT4 + | C запахом аммиака | |
| Cr 3+ | Темно-зеленый осадок | |
| Cl — | Ag + (AgNO3) | Белый осадок |
| Br — | Желтоватый осадок | |
| l — | Газ без запаха, вызывающий помутнение известковой воды | |
CO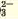 | H + (сильная кислота) | Белый осадок |
SO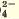 | Ba 2+ | Желтый осадок |
РО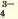 | Ag + | Черный осадок |
| S 2- | Cu 2+ | Черный осадок |
| Pb 2+ | Черный осадок | |
| Zn 2+ | Белый осадок | |
| Cd 2+ | Желтый осадок | |
| Ca 2+ | SO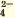 | Белый осадок |
CO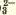 | Белый осадок | |
| F — | Mg 2+ | Желтый осадок |
| ОН — | индикатор | Изменение цвета |
| СН3СОО — | H+ (сильная кислота) | Уксусный запах |
Обменные реакции в растворах электролитов протекают только тогда, когда хотя бы одно из образованных в результате этих реакций веществ является малодиссоциирующим, или нерастворимым (осадком), или же находится в газообразном состоянии.
Сумма коэффициентов сокращенного ионного уравнения реакций, протекающих с образованием лишь одного неэлектролита (осадка или мало диссоциирующего вещества) всегда на 1 единицу бывает больше суммы ионов, образующих этот неэлектролит.
| Слабые электролиты и неэлектролиты | Сумма коэффиниентов сокращенного ионного уравнения его образования |
| СаСО3, MgCO3, ВаСО3, CaSO4, BaSO4, PbSO4, SrSO4, ZnCO3, CuS, PbS, ZnS, CdS, AgCl, Н2О, HCOOH, CH3COOH и др. | 3 |
| Be(OH)2, Mg(OH)2, Zn(OH)2, Fe(OH)2, Cr(OH)2, Cu(OH)2, PbCl2, Mn(OH)2, MgF2 и др. | 4 |
| Al(OH)3, Fe(OH)3, Cr(OH)3, Ag3PO4 и др. | 5 |
| Ca3(PO4)2, Ba3(PO4)2 и др. | 6 |
| Соли, находящиеся в виде осадка, не вступают в реакцию с щелочами, основания в виде осадка не вступают в реакцию с солями, соли в виде осадка не вступают в реакцию с другими солями. |
Электролиз
Электролиз это окислительно-восстановительные реакции, протекающие на электродах, если через раствор или расплав электролита пропускают постоянный электрический ток. В результате электролиза электрическая энергия превращается в химическую энергию. При пропускании через электролитический раствор или расплав постоянного электрического тока хаотическое движение ионов урегулируется, катионы (положительно заряженные ионы) движутся в сторону катода, а анионы (отрицательно заряженные ионы) в сторону анода и, теряя заряды, превращаются в нейтральные атомы или молекулы. В результате на катоде протекает процесс восстановления, а на аноде процесс окисления. В процессе электролиза между участками катода и анода существуют перегородки.
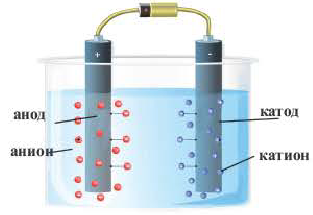
Электролизная ванна
Электролиз расплавов электролитов. Если через расплавы электролитов пропустить постоянный электрический ток, то происходит электролиз. При электролизе расплавов на катоде всегда восстанавливается катион, а на аноде окисляется анион. При электролизе расплавов любых солей, кроме солей аммония, на катоде всегда образуется металл. Рассмотрим процесс электролиза расплавленного хлорида натрия NaCl и гидроксида натрия (NaOH).

Электролиз расплава хлорида натрия
На катоде: Na + + е → Na° восстановление
На аноде: Cl е → Cl° окисление
2Na + +2Cl 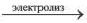
2NaCl 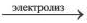
На катоде: Na + + e — → Na 0 восстановление
На аноде: OH — -e — →OH 0 окисление
4OH 0 →2H2O+O2↑
4NaOH 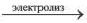

Электролиз расплава гидроксида натрия
Электролиз расплавов солей кислородсодержащих кислот в школьном курсе не изучается.
Г. Дэви, не зная химических свойств выделенного при электролизе металла, наполнил изготовленный из калия тигель водой. Как только вода соприкоснулась с металлом, произошел взрыв. Осколки тигеля и капли расплавленного металла попали в лицо Дэви. Он потерял правый глаз и получил глубокую рану. Рубцы, образовавшиеся на его лице во время взрыва, оставались до конца его жизни.
Электролиз водных растворов электролитов
При электролизе растворов электролитов характер происходящих на электродах электрохимических процессов зависит от природы иона, растворителя, концентрации электролита, материала, из которого изготовлен электрод, температуры, напряжения тока и других факторов. Для того, чтобы заранее определить на основе формулы солей, какие вещества будут образованы на электродах при электролизе водных растворов солей, следует знать следующие правила.
1. При электролизе растворов солей металлов, расположенных в электрохимическом ряду напряжения металлов начиная слития, включая алюминий (Li, К., Ca, Na, Mg, Al), на катоде молекулы воды восстанавливаются с выделением водорода.
На катоде: 2H2O + 2e → H2↑ +2ОН
2. При электролизе же растворов солей бескислородных кислот (НО, HBr, HI, H2S) этих металлов кислотный остаток на аноде окисляется с получением многоатомного простого вещества, и в растворе образуется основание, т.е. масса соли уменьшается.
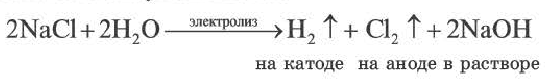
При электролизе растворов солей кислородсодержащих кислот этих металлов (Li, Na, К, Ca, Ba, Mg, Al) вода на аноде окисляется с выделением кислорода (О2), на катоде вода восстанавливается с выделением водорода. Масса соли не изменяется. Поскольку при электролизе растворов этих солей соль не разлагается, концентрация раствора повышается.
Na2SO4 +2H2O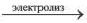
При электролизе водных растворов щелочей LiOH, NaOH, KOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 происходит такой же процесс. Т.е. на катоде вода восстанавливается а на аноде вода окисляется.
NaOH + 2H2O 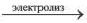
3. При электролизе растворов солей металлов, расположенных в ряду напряжения металлов между алюминием и водородом (Mn, Zn1 Cr, Fe, Ni,Sn, Pb), на катоде ионы металла вместе с молекулами воды восстанавливаются с выделением металла и водорода. На аноде вода окисляется, выделяется кислород. (Электролиз растворов бескислородных солей этих металлов в школьном курсе не изучается).
| На катоде: | 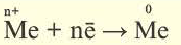 2H2O + 2ё → H2 ↑ +2OН |
| На аноде: | 2H2O 4ё → О2 ↑ + 4Н + |
| Общее уравнение | NiSO4 + 2H2O 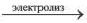 Ni + H2 ↑ + O2 ↑ + H2SO4 Ni + H2 ↑ + O2 ↑ + H2SO4 |
4. При электролизе растворов солей металлов, расположенных в электрохимическом ряду напряжения металлов после водорода (Cu, Hg1 Ag, Pt, Au), на катоде восстанавливаются только ионы металла с получением металла. Из этих металлов при электролизе растворов солей бескислородных кислот меди Cu на аноде кислотный остаток окисляется, получается соответствующее простое вещество. Масса воды не меняется. Следовательно, при электролизе как расплавов, так и растворов CuCh, CuBr2, CuI2, на электродах всегда получается один и тот же продукт (на катоде металл, на аноде галоген).
5. При электролизе растворов солей кислородсодержащих кислот этих металлов (например, Cu(NO2)2, CuSO4, AgNО3, Hg(NO3)2) вода на аноде окисляется с выделением кислорода (O2), в растворе образуется кислота. Значит, при элекгролизе растворов солей этих металлов соль всегда подвергается разложению, концентрация соли уменьшается. 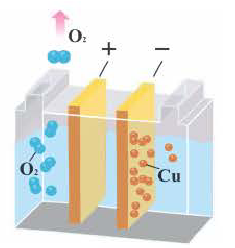
Электролиз водного раствора CuSO4
2CuSO4 + 2H2O 
4AgNO3 + 2H2O
При электролизе как расплавов, так и растворов солей бескислородных кислот (НС1, HBr, HI, H2S) на аноде кислотные остатки, окисляясь, превращаются в соответствующие простые вещества. Последовательность окисления кислогных остатков на аноде представлена в следующем виде:
При проведении электролиза раствора смеси нескольких солей, в первую очередь, на аноде выделится S, при отсутствии этого элемента l2, при его отсутствии Вr2, при его отсутствии С12, при его отсутствии О2.
При электролизе растворов солей HF (MeFa) на аноде ионы F не окисляются, окислению подвергаются молекулы воды. Значит, процесс окисления 2F 2e → F2 в водном растворе не происходит. Процесс окисления возможен лишь при электролизе расплава.
При электролизе водных растворов солей кислородсодержащих кислот (HNO3, H2SO4, H3PO4, Н2СО3 и др.) на аноде окисляется не кислотный остаток, а вода с выделением кислорода (O2).
При электролизе растворов смеси солей различных металлов первоочередная последовательность восстановления металлов на катоде следующая:
Факторы, влияющие на процесс электролиза. Процесс электролиза связан с электропроводной способностью растворов. Способность растворов к электрической проводимости зависит, в первую очередь, от концентрации ионов. Чем больше концентрация ионов, тем сильнее электропроводность раствора. Например, среди растворов солей KCl, Ba(NO3)2, А1С13 с концентрацией в 1 моль/л (т.е. 1 М) каждой из них (при одинаковой а) наибольшая электрическая проводимость будет у А1С13. Это обусловлено тем, что раствор этой соли обладает как наибольшим количеством ионов, так и более высокой концентрацией.
Применение электролиза. Электролиз применяется при получении активных металлов (Na, К, Ca, Mg, Al), меди (Сu), некоторых неметаллов (Cl2, F2) и щелочей (NaOH, КОН). Электролизом также пользуются для покрытия поверхности металлических предметов никелем, хромом, цинком, оловом, золотом и другими стойкими против коррозии металлами.
Гидролиз
Несмотря на отсутствие ионов H + и ОН в составе нормальных солей, их водные растворы показывают щелочную, кислую или нейтральную реакцию. Эта особенность водных растворов солей объясняется гидролизом hidro вода, Iizis разложение).
Реакции, протекающие с образованием слабых электролитов в результате взаимодействия ионов соли и молекул воды, называются гидролизом солей. Другими словами, гидролизом называют разложение солей под воздействием воды.
В зависимости от природы солей, они подвергаются или не подвергаются гидролизу. Если хотя бы одна из кислот или оснований, образующих соль, будет слабой, то такая соль подвергается гидролизу. Нерастворимые в воде соли гидролизу не подвергаются.
Так как гидролиз является обратимым процессом, в системе образуется динамическое равновесие. Гидролиз солей, образованных из многоосновных кислот или многокислотных оснований, протекает ступенчато. Гидролизные реакции записываются как в виде молекулярного, так и в виде ионного уравнений.
Для составления краткого ионного уравнения гидролиза следует:
- а) написать уравнение диссоциации соли;
- Ь) определить природу аниона и катиона (установить катион слабого основания или анион слабой кислоты);
- с) написать полное ионное уравнение реакции (так как вода является неэлектролитом, ее формулу оставить как есть);
- d) путем сокращения ионов, не участвующих в реакции, определить краткое ионное уравнение.
По наличию или отсутствию процесса гидролиза соли подразделяются на четыре группы:
- Соли, образованные сильными кислотами (HNO3, H2SO4, HCl, HBr, HI) и сильными основаниями (LiOH, NaOH, КОН, RbOH, CsOH, Ca(OH)2, Sr(OH)2).
- Соли, образованные сильными кислотами и слабыми основаниями (Me(OH)n Me
Be, Mg, Zn, Al, Cr, Fe, Cu,Hg, Ag, Mn, NH4 и др.).
- Соли, образованные слабыми кислотами (H3PO4, H2SO3, H2CO3, H2S, H2SiO3, HCOOH, CH3COOH и др.) и сильными основаниями.
- Соли, образованные слабыми кислотами и слабыми основаниями.
| Кристаллогидраты | Гидраты | |||||||
| FeSO4∙ 7H2O железный купороса SO4∙ 2Н2О природный гипс Na2CO3 ∙ 10H2O кристаллическая сода Na2SO4 ∙ 10H2O глауберова соль MgSO4 ∙ 7H2O горькая соль CuSO4 ∙ 5H2O медный купорос (синий камень) |
| Атом натрия | Ион натрия |
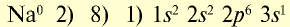 | 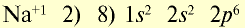 |
| Атом хлора | Ион хлора |
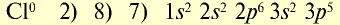 | 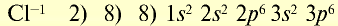 |
Распад на ионы соединений с ионной связью при образовании водных растворов называется диссоциацией. Этот процесс можно объяснить следующим образом. Вы уже знаете, что поваренная соль в твердом состоянии не пропускает электрический ток. При растворении в воде она разделяется на ионы, так как:
- кристаллы поваренной соли представляют собой соединения с ионной связью и в узлах их кристаллической решетки расположены ионы (см. рис. 15);
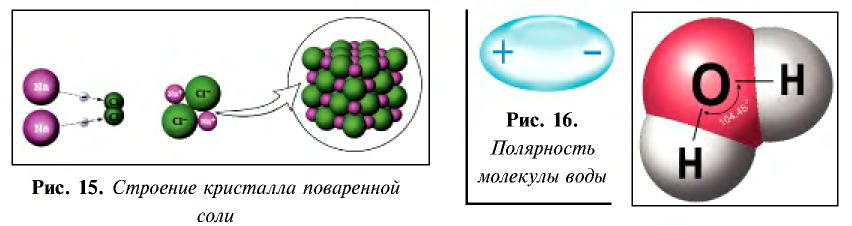
- молекула воды образована за счет полярной ковалентной связи и имеет строение, показанное на рис. 16;
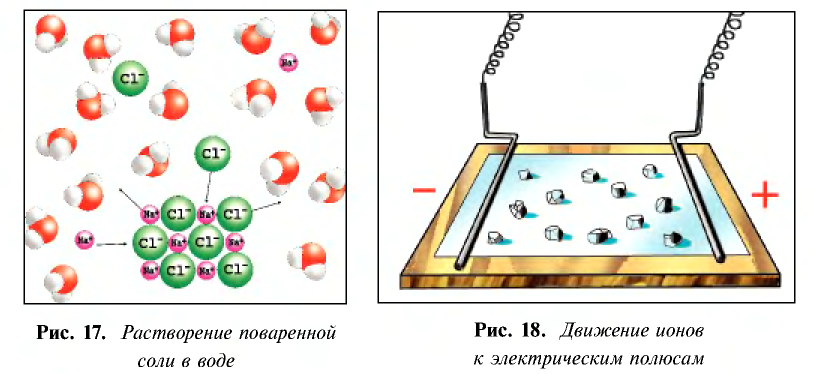
- поваренная соль при растворении в воде диссоциирует по схеме, показанной на рис. 17.
Таким образом, при растворении в воде кристаллы поваренной соли под воздействием поляризованных молекул воды образуют гидра-тированные ионы.
Атомы водорода и металлов превращаются в катионы, отдавая электроны, а атомы аммиака — присоединяя протоны за счет электронной пары, не участвующей в образований химической связи (
Кислотные остатки и гидроксильные группы являются анионами. В электрическом поле движение ионов происходит следующим образом (см. рис. 18).
Положительно заряженные ионы притягиваются катодом. Поэтому их называют катионами.
Отрицательно заряженные ионы притягиваются анодом, поэтому их называют анионами.
Соли и щелочи при плавлении также делятся на ионы за счет усиления колебательных движений частиц, приводящих к ослаблению связей между ними.
Кислоты представляют собой сильно поляризованные молекулы и при растворении в воде тоже распадаются на ионы, но этот процесс происходит у них иначе, чем у солей и щелочей:
При растворении хлорида водорода в воде атом водорода отдает электрон и переходит в молекулу воды. В результате образуется ион хлора с одним лишним электроном и ион Н30+ (гидроксония) с одним присоединенным протоном (ядро атома водорода). Следовательно, при растворении в воде НС1, 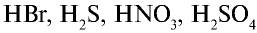
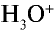
Изучая донорно-акцепторную связь, вы узнали, что 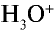
Уравнение диссоциации кислот обычно записывают в более кратком виде.
Элементы знаний, умений и навыков: элекролитическая диссоциация, теория электролитической диссоциации, катионы, анионы, ионы, ионная кристаллическая решетка, гидроксоний.
Диссоциация кислот, щелочей и солей
При диссоциации каких веществ образуются только ионы водорода?
Кислоты
Все кислоты, растворимые в воде, диссоциируют. При их диссоциации образуются ионы водорода и кислотный остаток:
Диссоциация многоосновных кислот протекает в несколько этапов:
Общие свойства кислот — кислый вкус, изменение цвета индикатора, способность вступать в реакцию с основаниями, основными оксидами и солями — объясняются образованием ионов водорода при их диссоциации. Исходя из этого можно дать следующее определение кислотам.
— Кислотами называются сложные вещества, при диссоциации которых в качестве катиона образуются только ионы водорода.
Основания
При диссоциации всех водорастворимых оснований выделяются катионы металла (ион гидроксида аммония 
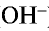
Все свойства, присущие водорастворимым основаниям — изменение цвета индикатора, способность вступать в реакцию с кислотами, кислотными оксидами и солями,— зависят от ионов 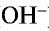
— Основаниями называются сложные вещества, при диссоциации которых в качестве аниона образуются только ионы гидроксида (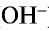
Соли
При диссоциации солей образуются катионы металла (в аммониевых солях катион 
Кислые соли диссоциируют, помимо ионов металла, на ионы водорода:
При диссоциации солей не образуются общие для всех солей ионы, поэтому они не имеют общих свойств.
— Солями называются сложные вещества, при диссоциации которых наряду с катионами металла образуются анионы кислотного остатка (а в кислых солях и катионы водорода).
Элементы знаний, умений и навыков: кислоты, щелочи и соли с точки зрения теории электролитической диссоциации. Многостадийная диссоциация.
Сильные и слабые электролиты
Почему уксусная кислота считается слабым электролитом?
— Отношение числа диссоциированных молекул к исходному числу растворенных молекул называется степенью диссоциации электролита, которая обозначается буквой а:
Степень диссоциации выражается в долях единицы или в процентах.
Если степень диссоциации равна 0,5, то это значит, что каждая из двух молекул распалась на ионы. Если а — 1, то на ионы распались все молекулы. При выражении степени диссоциации в процентах ее значение определяется так: если из ста молекул распались на ионы 85, то а будет равна 85%. Степень диссоциации зависит от природы растворенного электролита и растворителя, концентрации раствора, температуры среды. Поэтому вместе со степенью диссоциации указываются концентрация раствора и температура. Например, степень диссоциации 0,05 М серной кислоты при 18°С составляет 58 %.
— Электролиты с относительно высокой степенью диссоциации называются сильными.
Они практически полностью диссоциируют в растворах любой концентрации. Большинство солей (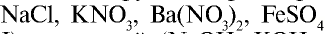
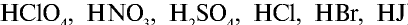
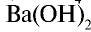
— Электролиты, степень диссоциации которых низка даже в разбавленных растворах, называются слабыми.
Все органические и некоторые неорганические кислоты (H2C03, НС10, H,S, HN02, H2C03, H2Si03, НС102 и др.), гидроксид аммония, нерастворимые гидроксиды металлов, вода считаются слабыми электролитами.
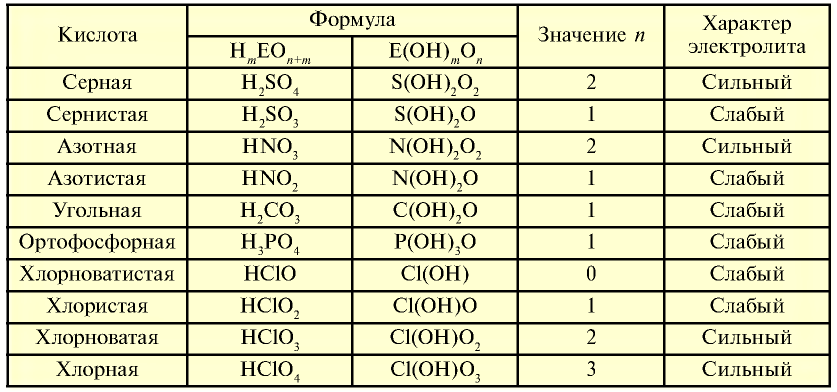
Таблица 19
На основе общих формул кислородсодержащих кислот 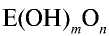
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://zdamsam.ru/a4265.html
http://www.evkova.org/teoriya-elektroliticheskoj-dissotsiatsii-v-himii






















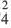
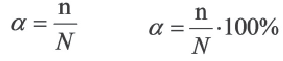
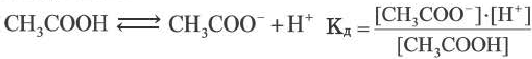
 → BaSO4↓+ 2 H2O полное или сокращенное ионное уравнение
→ BaSO4↓+ 2 H2O полное или сокращенное ионное уравнение
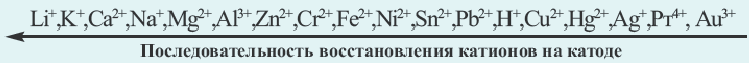
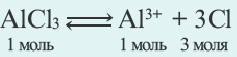
 Be, Mg, Zn, Al, Cr, Fe, Cu,Hg, Ag, Mn, NH4 и др.).
Be, Mg, Zn, Al, Cr, Fe, Cu,Hg, Ag, Mn, NH4 и др.). N(OH ) среда кислая; при N (H + )
N(OH ) среда кислая; при N (H + )  + H2O
+ H2O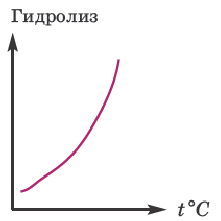
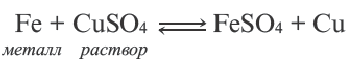
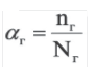 или
или 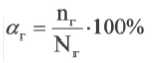
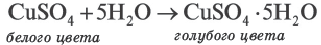
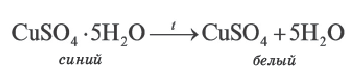
 бесцветны так же, как и безводный сульфат меди (II). Однако при растворении сульфата меди (II) в воде происходит процесс гидратации ионов. При выпаривании этого раствора образуются кристаллы. В узлах их кристаллических решеток находятся гидратированные ионы меди Cu(Н2O)
бесцветны так же, как и безводный сульфат меди (II). Однако при растворении сульфата меди (II) в воде происходит процесс гидратации ионов. При выпаривании этого раствора образуются кристаллы. В узлах их кристаллических решеток находятся гидратированные ионы меди Cu(Н2O) 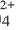 с голубой окраской и бесцветные гидратированные сульфат-ионы (SO4 . Н2О) 2 . Оба иона образуют кристаллы медного купроса CuSO4 . 5Н2О.
с голубой окраской и бесцветные гидратированные сульфат-ионы (SO4 . Н2О) 2 . Оба иона образуют кристаллы медного купроса CuSO4 . 5Н2О. ∙(n-1)H2O
∙(n-1)H2O