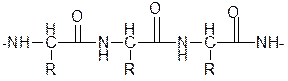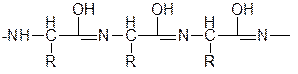Белок cu oh 2 уравнение
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Биуретовая реакция белков
Биуретовая реакция белков – это качественная реакция на обнаружение белков с фиолетовым окрашиванием при действии солей меди (II) (медного купороса) в щелочном растворе.
Чтобы провести качественную реакцию, раствор белка куриных яиц и раствор гидроксида калия или гидроксида натрия (в равных количествах) нагревают с несколькими каплями раствора медного купороса (сульфата меди (II)). Фиолетовый цвет дают образовавшиеся комплексные соединения меди с белками. Такая реакция характерна для всех соединений с пептидной связью (CO-NH).
Белок + CuSO4 + NaOH ——> красно-фиолетовое окрашивание.
Качественные реакции на белки
1) Биуретовая реакция (на все белки)
Белок + СuSO4 + NaOH 



OH H 














N 


ярко фиолетового цвета
2) Ксантопротеиновая реакция (для белков, имеющих в составе АК с ароматическим радикалом)
t
белок + HNO3 (k) 







|
| |

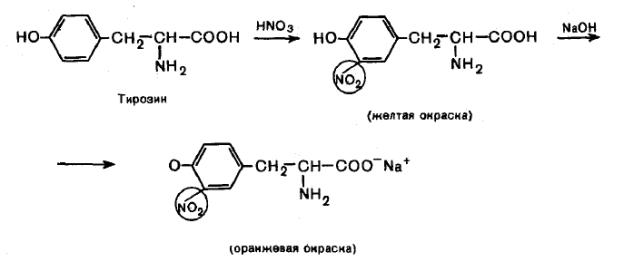
Если добавить концентрированный раствор аммиака, то появляется оранжевое окрашивание, так как в нитробензоле происходит смещение электронной плотности.
3) Цистеиновая реакция — реакция на остаток АК, содержащий S
Белок + NaOH + Pb(CH3COO)2 

SH + Pb 2+ 
SH |


БИОКАТАЛИЗ
Одной из важных черт химических реакций, протекающих в живых организмах, является их каталитическая природа. Живую клетку можно представить как миниатюрный каталитический реактор. Отличие клетки от колбы химика заключается в том, что если в колбе все реакции протекают независимо (осуществляется фундаментальный принцип независимости реакций), то в клетке все происходит взаимосвязано.
Это происходит не потому, что нарушаются физические законы или клетка подчиняется другим законам – нет, в живых материях действуют одни законы. Просто в процессе эволюции природой был создан эффективный аппарат регулирования всех клеточных реакций, который позволяет всей клетке контролировать соотношение продуктов таким образом, чтобы оптимально функционировали все реакции.
Таким образом, все биохимические реакции – это реакции каталитические.
Биологические катализаторы называются ферментами или энзимами.
В принципе, в клетке протекают те же химические реакции, что и в химической лаборатории, но на условия протекания реакций в клетке накладываются жёсткие ограничения, а именно T = 37 ◦ С и P = 1 атм.
Поэтому часто процессы, которые в лаборатории протекают в 1 стадию, в живых клетках в осуществляются в несколько стадий.
Сущность каталитических реакций, несмотря на многообразие, сводится к тому, что исходные вещества, образуют с катализатором промежуточное соединение, которое относительно быстро превращается в продукты реакции, регенерируя катализатор.
Иногда промежуточные соединения можно выделить в чистом виде, но обычно они состоят из неустойчивых молекул, обнаружение которых возможно только с помощью очень чувствительных спектральных приборов.
Процесс с участием катализатора – циклический или круговой.
Мера активности фермента – число оборотов (число молей субстрата, претерпевающих изменение за 1 минуту в расчёте на 1 моль фермента)
Число оборотов может достигать 10 8 .
Довольно часто циклы работы нескольких катализаторов соединяются вместе, образуя круговой процесс.
Вещества S1 и S2 превращаются в продукты Р1 и Р2. В ходе этого превращения сначала S1 реагирует с третьим веществом Х и катализатором Е1, образуя промежуточный продукт М1, который в свою очередь при помощи катализатора Е2 превращается в промежуточный продукт М2 и т. д.
Ускоряющее действие катализатора связано с уменьшением энергии активации (это та дополнительная энергия, которая должна быть сообщена одному молю вещества, чтобы частицы вещества стали реакционно способными и могли преодолеть энергетический барьер реакции).
К основным свойствам ферментов относятся:
— эффективность, которая заключается в степени ускорения (ускорение в 100 млн раз).
— повышенная субстратная специфичность. Ферменты отличают субстрат благодаря биологическому узнаванию (комплементарности).
— повышенная специфичность катализируемой реакции. Большинство ферментов ускоряет один тип реакций.
— повышенная специфичность по отношению к оптическим изомерам (могут узнавать левые и правые изомеры).
Причина всех уникальных свойств ферментов — их пространственное строение. Обычно это глобулярные белки, намного превосходящие по размерам субстрат. Это обстоятельство приводит к тому, что в процессе эволюции на поверхности фермента образовался активный центр, который комплементарен субстрату. Это замок и ключ.
Условно активные центры делятся на: связывающие и каталитические.
Связывающий центр связывает субстрат и оптимально ориентирует его по отношению к катализируемой группе, в катализирующем же центре сосредоточены все активные группы.
Если для проведения реакции необходимо провести гидролиз (белков, липидов), то катализируемый центр формируется боковыми радикалами АК – остатков.
В этом случае фермент состоит только из полипептидных цепей. Однако кроме гидролитических реакций протекают и другие: окислительно-восстановительные, реакции переноса каких-либо групп.
В этих случаях в ферментах содержится небелковая часть. Эта часть – кофермент (rофактор, простетическая группа). Белковая часть обеспечивает связывающее действие, а кофермент – каталитическое. Белковая часть – апофермент.
Апофермент + кофермент ↔холофермент
Качественные реакции на аминокислоты, пептиды, белки
Аминокислоты можно обнаружить с помощью цветных реакций: нингидриновой, ксантопротеиновой, Фоля, Милона, биуретовой пробы и др. Эти реакции неспецифичны, т.к. основаны на обнаружении отдельных фрагментов в структуре аминокислот, которые могут встречаться и в других соединениях.
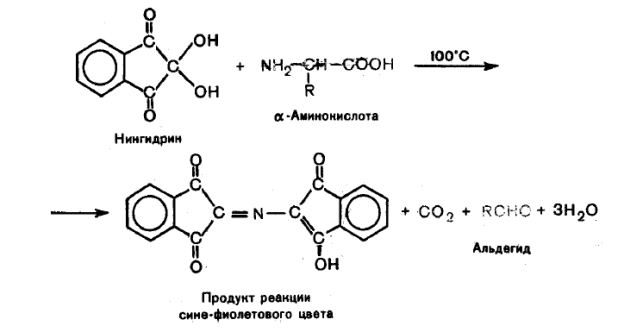
Нингидриновая реакция, цветная реакция, применяемая для качественного и количественного определения аминокислот, иминокислот и аминов. При нагревании в щелочной среде нингидрина (трикетогидринденгидрата, С9НбО4) с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм. Т. к. поглощение при этой длине волны линейно зависит от числа свободных аминогрупп, нингидриновая реакция послужила основой для их количественного определения методами колориметрии или спектрофотометрии. Эта реакция используется также для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета. Чувствительность — до 0,01%. Современный автоматический аминокислотный анализ проводят, сочетая ионообменное разделение аминокислот и количественное определение их с помощью нингидриновой реакции. При разделении смесей аминокислот методом бумажной хроматографии позволяет определять каждую аминокислоту в количестве не менее 2—5 мкг.
По интенсивности окраски можно судить о количестве аминокислот.
Эта реакция положительна не только со свободными аминокислотами, но и пептидами, белками и др.
Ксантопротеиновая реакция позволяет обнаружить ароматические аминокислоты (фенилаланин, тирозин, гистидин, триптофан), основана на реакции электрофильного замещения в ароматическом ядре (нитрование).
При действии концентрированной азотной кислоты, например, на тирозин образуется продукт, окрашенный в желтый цвет.
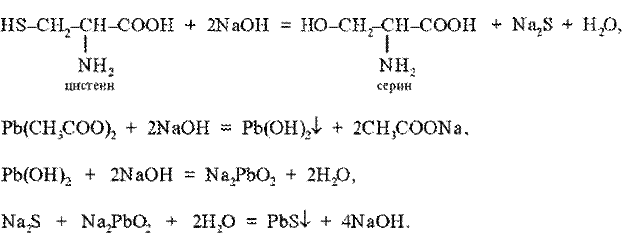
Реакция Фоля. Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Реакция Циммермана. Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
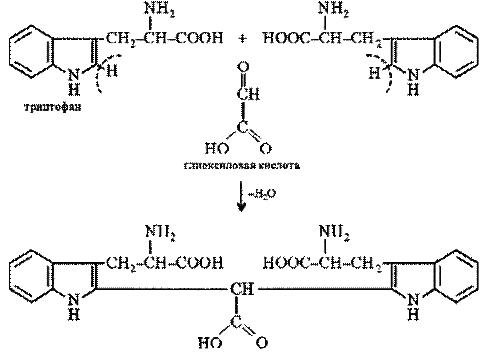
Реакция на триптофан. Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
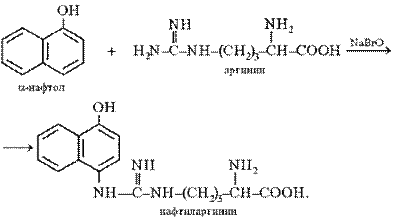
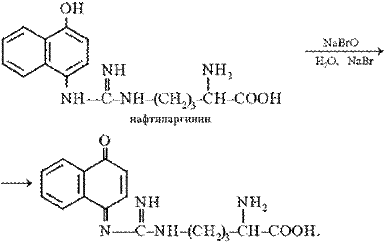
Реакция Сакагучи. Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с α-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра α-нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора α-нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Биуретовая реакция – используется как цветная реакция на белки. В щелочной среде в присутствии солей меди(II) они дают фиолетовое окрашивание. Окраска обусловлена образованием комплексного соединения меди(II), за счет пептидной группы -СО-NH- , которая характерна для белков. Свое название эта реакция получила от производного мочевины — биурета, который образуется при нагревании мочевины с отщеплением аммиака:
Кроме белков и биурета такое же окрашивание дают и другие соединения, содержащие -эту группу: амиды, имиды карбоновых кислот, а также соединения, содержащие в молекуле группы -CS-NH- или =CH-NH-. Также реакцию дают белки, некоторые аминокислоты, пептиды, биурет и средние пептоны.
Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий.
кетонная форма полипептида
енольная форма полипептида
При взаимодействии полипептида с Cu (OH)2 образуется комплекс, строение которого можно показать так:
http://megaobuchalka.ru/9/32082.html
http://poznayka.org/s69766t1.html