ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a -Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a -аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
- Реакция Сакагучи
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a -нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a -нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a -нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
- РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
- РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a -аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a -аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a -Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a -аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
- Открытие серы в белках
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a -АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a -аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- РЕАКЦИЯ НА ТРИПТОФАН
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Цветные реакции на белки и аминокислоты
| Исследуемый материал | Окраска продукта | Реагирующая группа |
| Биуретовая реакция | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Аминокислота | ||
| Нингидриновая реакция | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Аминокислота | ||
| Ксантопротеиновая реакция | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Фенол | ||
| Реакция Фоля (на слабосвязанную серу) | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин |
НИНГИДРИНОВАЯ РЕАКЦИЯ. В этой реакции растворы белка, полипептидов, пептидов и свободных α-аминокислот при нагревании с нингидрином дают синее, сине-фиолетовое или розово-фиолетовое окрашивание. Окраска в этой реакции развивается за счет α-аминогруппы. Реакция протекает в две стадии.
 |
|
Нингидрин образует с аминокислотами соединения с двойной связью между углеродом и азотом, называемые иминами или основаниями Шиффа.
|
 |
|
Альдимин Промежуточный амин Альдегид
|
|
|
Эти соединения обладают высокой реакционной способностью. Дальнейшее превращение их приводит к промежуточному амину, который может реагировать со второй молекулой нингидрина, давая соединение окрашенное в сине-фиолетовый (пурпурный) цвет – сине-фиолетовый (пурпурный) Руэмана.
Очень легко реагируют с нингидрином a-аминокислоты. Наряду с ними сине-фиолетовый Руэмана образуют также белки, пептиды, первичные амины, аммиак и некоторые другие соединения. Вторичные амины, например пролин и оксипролин, дают желтую окраску.
Нингидриновую реакцию широко используют для обнаружения и количественного определения аминокислот.
ХОД РАБОТЫ. Берут пять пробирок, и вносят по 1 мл: в первую воды, во вторую – раствора казеина, в третью – раствора яичного белка, в четвертую – раствора желатины, в пятую – раствора аминокислоты (глицина). Затем в каждую пробирку добавляют по 10-12 капель раствора с массовой долей нингидрина в ацетоне или этаноле 1 %. Содержимое каждой пробирки перемешивают встряхиванием и ставят их в кипящую водяную баню на 3-5 мин. Записывают химизм реакции, схему постановки опыта, строение окрашенных соединений. Результаты вносят в табл. 1.
КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ. Эта реакция указывает на наличие в белках остатков ароматических аминокислот – тирозина, фенилаланина, триптофана. Основана на нитровании бензольного кольца радикалов этих аминокислот с образованием нитросоединений, окрашенных в желтый цвет (греческое «Ксантос» – желтый). На примере тирозина эту реакцию можно описать в виде следующих уравнений.
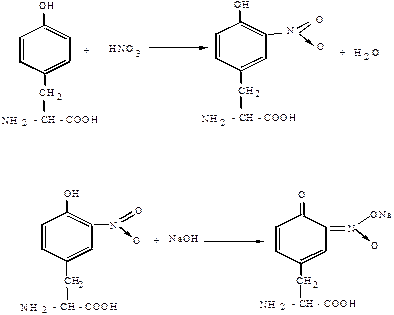 |
Тирозин Нитротирозин
|
Нитротирозин Натриевая соль нитротирозина
В щелочной среде нитропроизводные аминокислот образуют соли хиноидной структуры, окрашенные в оранжевый цвет.
Ксантопротеиновую реакцию дают бензол и его гомологи, фенол и другие ароматические соединения.
ХОД РАБОТЫ. Берут четыре пробирки и вносят по 1 мл: в первую раствора казеина, во вторую – раствора яичного белка, в третью – раствора желатины, в четвертую – раствора фенола. Во все пробирки добавляют по 10 капель концентрированной азотной кислоты. Содержимое перемешивают встряхиванием и пробирки помещают в кипящую водяную баню на 5-8 мин. Под действием кислоты появляется осадок белка, который при нагревании окрашивается в желтый цвет. После бани пробирки выдерживают при комнатной температуре 4-5 мин и записывают окраску содержимого. Затем в каждую пробирку прибавляют по 1 мл раствора с массовой долей гидроксида натрия 30 % (или другую щелочь). Содержимое пробирок перемешивают встряхиванием, окраску записывают. Работу оформляют в соответствии с табл.1.
РЕАКЦИЯ ФОЛЯ (на слабосвязанную серу). Этой реакцией открывают в белках радикалы цистеина содержащие как свободные –SH (тиоловые) радикальные группы, так и окисленные с образованием дисульфидных (-S-S-) связей цистина.
При нагревании белка, содержащегося в молекуле остатки цистеина и цистина, с концентрированным раствором щелочи и ацетатом (или другой растворимой солью) свинца (реактив Фоля) образуется бурое или черное окрашивание. Это объясняют тем, что под действием щелочи от радикалов цистеина отщепляется сера в виде иона со степенью окисления минус два, который, взаимодействуя с ионом свинца (II), дает бурый или черный нерастворимый осадок сульфида свинца. Белки, в составе которых нет цистина и цистеина, реакцию Фоля не дают. Химизм процесса можно описать следующими реакциями:
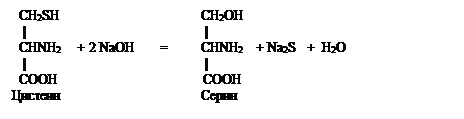 |
Ацетат свинца Ацетат натрия
При нагревании со щелочью часть белка подвергается гидролизу. Кроме того происходит отщепление части аминогрупп (реакция дезаминирования) в виде аммиака, который можно обнаружить по запаху и посредством смоченной водой красной лакмусовой бумажки, поднесенной к отверстию пробирки (не касаться стенок!).
ХОД РАБОТЫ. Берут четыре пробирки и вносят по 1 мл: в первую воды, во вторую – раствора казеина, в третью – раствора яичного белка, в четвертую – раствора желатины. В каждую пробирку добавляют по 1 мл раствора с массовой долей гидроксида натрия 30 % и по 6-8 капель раствора с массовой долей ацетата свинца 5 %, или можно приготовить реактив Фоля на всю подгруппу и добавить по 1 мл в каждую пробирку приготовленного раствора. Содержимое перемешивают встряхиванием, и пробирки помещают в кипящую водяную баню на 5-7 мин. Окраску содержимого пробирок записывают. Результаты оформляют в табл. 1.
РЕАКТИВЫ.Вода дистиллированная (в дальнейшем вода); растворы с массовыми долями: казеина 1 %, желатины 1 %, яичного белка 1 %, сульфата меди 1 %, гидроксида натря 10 и 30 %, глицина (или другой аминокислоты) 0,1 %, фенола 0,1 %, ацетата свинца 5 %, нингидрина в ацетоне или этаноле 1 %; концентрированная азотная кислота.
Реактив Фоля готовят в пробирке перед определением. В пробирку вносят 1 мл 5 % раствора ацетата свинца и небольшими порциями (по 1,5-2 мл) приливают 30 % раствор гидроксида натрия с интервалом 30 сек, каждый раз, перемешивая, до растворения молочно-белого хлопьевидного осадка появившегося после внесения первой порции гидроксида натрия.
1. Общая характеристика пептидов, полипептидов, белков и их строения.
2. Как соединяются аминокислоты в молекуле белка и за счет каких групп? Соедините Ала, Цис, Сер.
3. Перечислите цветные реакции на белки и аминокислоты.
4. Какая реакция открывает пептидные связи? Её химизм.
5. Что характеризуют цвет и интенсивность окраски при положительной биуретовой реакции?
6. Что открывает нингидриновая реакция? Её химизм.
7. Назовите аминокислоты имеющие в радикале бензольное кольцо. Какой реакцией можно обнаружить ароматические аминокислоты? Её химизм.
8. Назовите аминокислоты содержащие серу. Какую из них обнаруживает реакция Фоля? Химизм реакции.
9. Какую цветную реакцию используют для количественного определения белков в растворе и почему?
10. Какую цветную реакцию используют для количественного определения α-аминокислот и почему?
Работа 17. Изучение процесса денатурации белка
Задача работы:изучить пути денатурации белка и выработать навыки проведения реакций осаждения белка, в том числе клинических.
Оборудование, материалы:яичный белок, 5%-ный раствор ацетата свинца, насыщенный раствор сульфата меди, 20%-ный раствор сульфосалициловой кислоты, концентрированная азотная кислота, пипетки, пробирки, спиртовка.
Выполнение работы:
а) Осаждение белка ацетатом свинца.В пробирку наливают 10 капель яичного белка и прибавляют 4 капли 5%-ного раствора (CH3COO)2Pb. Образуется нерастворимый в воде осадок (при добавлении избытка ацетата свинца осадок легко растворяется).
б) Осаждение белка сульфатом меди.В пробирку наливают 1 мл раствора белка и прибавляют по каплям 2%-ный раствор сульфата меди. Выпадает осадок белка.
Аминокислоты и белков способны связывать ионы тяжелых металлов, поэтому используется в медицинской практике как противоядия при отравлении солями ртути, меди, свинца и др.

1. В первой пробирке нейтральный раствор белка нагревают до кипения. Жидкость мутнеет, происходит укрупнение частиц, но мицеллы белка несут заряд и удерживаются во взвешенном состоянии.

3. В третью пробирку добавляют 5-10 капель 1%-ного раствора уксусной кислоты для получения сильнокислой реакции среды. Белковые молекулы перезаряжаются, приобретают положительный заряд, это повышает их устойчивость и при кипячении осадка не образуется.
4. В четвертую пробирку добавляют 2 капли 10%-ного раствора едкого натра, создавая щелочную среду. При кипячении жидкости осадка не образуется, поскольку в щелочной среде заряд белка увеличивается.
5. В пятую пробирку приливают 5 капель 1%-ного раствора уксусной кислоты и 2 капли насыщенного раствора хлорида натрия и нагревают. Выпадает хлопьевидный осадок, так как частицы белка теряют заряд вследствие взаимодействия белка с разноименно заряженными ионами хлорида натрия. Проба используется в клинике для обнаружения белка.
г) Осаждение белка сульфосалициловой кислотой.В пробирку с 5 каплями раствора белка добавляют 2 капли 20%-ного раствора сульфосалициловой кислоты. Выпадает осадок белка. Объяснить наблюдаемое явление. Сульфосалициловая кислота обладает высокой чувствительностью по отношению к белку (чувствительность реакции 1:50000).
Используется для обнаружения малых количеств белка в различных биологических жидкостях (моче, экссудатах и пр.)

http://helpiks.org/2-55017.html
http://poisk-ru.ru/s81497t1.html












