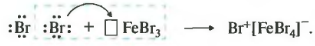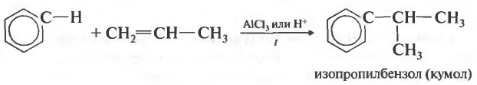Химические свойства аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
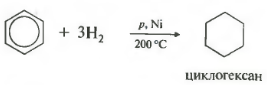
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
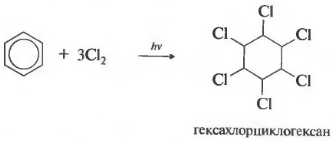
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
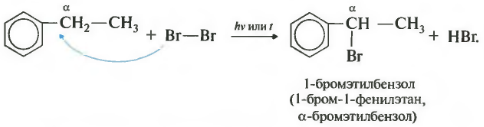
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
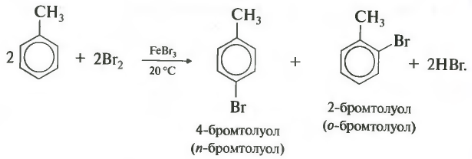
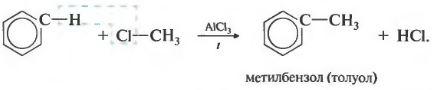
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
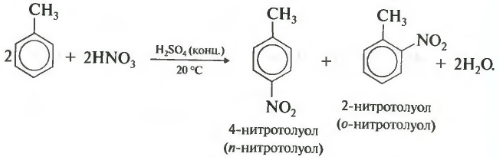
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
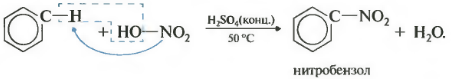
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
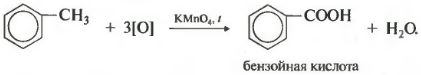
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
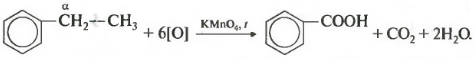
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Бензольные реакции — галогенирование, нитрование и сульфирование бензола
Бензол — бесцветная жидкость, которая была впервые обнаружена Майклом Фарадеем в 1825 году. Молекулярная формула бензола — C 6 H 6 . Из молекулярной формулы видно, что органическое соединение сильно ненасыщено. Из-за высокой степени ненасыщенности он очень реакционноспособен. В отличие от алкенов, он никогда не участвует в реакциях присоединения, окисления и восстановления. Например, бензол не будет реагировать с Br, HCl или другими реагентами, приводя к образованию двойных связей углерод-углерод. В большей части своей реакции бензол подвергается реакции замещения, при которой один или несколько атомов водорода заменяются другим атомом или радикалом.
Бензол относится к категории ароматических соединений. Фактически, термин «ароматический» был предварительно использован для описания бензола и его производных из-за его разнообразного аромата или запаха. Позже классификация бензола была сделана на основе их структуры и химической активности, а не на основе их аромата. Итак, теперь термин ароматические соединения используется для классификации тех соединений, которые являются чрезвычайно ненасыщенными и особенно стабильными по отношению к реагентам, которые активно взаимодействуют с алкенами.
В настоящее время термин арен используется для обозначения ароматических углеводородов по аналогии с алканом и алкеном. Бензол считается исходным ареном. Подобные соединения алкильной группы обозначаются символом RJ, аналогично, если один водород удаляется из арена, тогда комбинация арильной группы с новым атомом или группой обозначается как ArJ.
Структура бензола
Реакции замещения являются характерными реакциями бензола и почти не подвергаются реакции присоединения. Бензол обрабатывают бромом в присутствии хлорида железа в качестве катализатора, после чего образуется соединение, называемое бромбензолом, и это соединение, полученное из этого продукта. Реакция следующая:
Таким образом, из реакций вышеупомянутого типа был сделан вывод, что все шесть атомов углерода и все шесть атомов водорода в бензоле должны быть эквивалентны. Точно так же, если бромбензол обрабатывают бромом с хлоридом железа в качестве катализатора, образуются три изомерных дибромбензола:
Но в течение этих лет химики не были уверены в структуре бензола и в том, как эта структура может повлиять на химическую активность. Только в 1930-х годах химики постепенно пришли к общему пониманию уникальной структуры и химических свойств бензола и его производных.
Различные химические реакции бензола
Галогенирование бензола
Посредством реакции электрофильного ароматического замещения один атом водорода арена замещается одним атомом галогена. Вышеупомянутые реакции относятся к категории реакций галогенирования. Здесь мы попытаемся разобраться в механизме реакции. Эту реакцию проводят в присутствии катализатора кислоты Льюиса. Кислота Льюиса — не что иное, как акцептор электронной пары, а электроны по существу не связывают.
Нитрование бензола.
В реакции нитрования бензола бензол обрабатывают смесью концентрированной азотной кислоты и концентрированной серной кислоты при температуре не выше 50 ° C. С повышением температуры увеличивается вероятность образования более одной нитрогруппы, -NO₂, которая замещается на кольце и приводит к образованию нитробензола. Концентрированная серная кислота действует как катализатор в этой реакции. «Ион нитрония» или «катион нитрила», NO + 2, здесь является электрофилом. Это происходит в результате реакции между азотной кислотой и серной кислотой.
Сульфирование бензола
Сульфирование бензола включает реакцию электрофильного замещения, которая происходит между бензолом и серной кислотой. Есть два эквивалентных способа сульфирования бензола:
Первый способ включает нагрев бензола с обратным холодильником концентрированной дымящей серной кислоты в течение нескольких часов при 40 ° C. Образующийся продукт представляет собой бензолсульфоновую кислоту. Электрофилом здесь является триоксид серы, SO₃. Электрофил на основе триоксида серы может быть получен одним из двух способов в зависимости от того, какой вид кислоты используется. Его можно получить при небольшой диссоциации концентрированной серной кислоты, содержащей следы SO₃.
Дымящаяся серная кислота, H₂S₂O₇, может рассматриваться как раствор SO₃ в серной кислоте, и, таким образом, это гораздо более богатый источник SO₃. Триоксид серы является электрофильным по своей природе, потому что это высокополярная молекула с изрядным количеством положительного заряда на атоме серы. Именно это привлекает кольцевые электроны. Происходящая реакция может быть представлена как:
Алкилирование и ацилирование бензола.
Эта реакция широко известна как реакция Фриделя-Крафтса. Реакционная способность галогеналканов постепенно увеличивается по мере продвижения вверх по таблице Менделеева, а также увеличивается полярность. Это означает, что реакционная способность галогеналкана RF максимальна, за ней следует реактивность RCl, затем RBr и, наконец, RI. Это означает, что кислоты Льюиса, используемые в качестве катализаторов в реакциях алкилирования Фриделя-Крафтса, имеют тенденцию иметь аналогичные комбинации галогенов, такие как BF3, SbCl2, AlCl4, SbCl2 и AlBr2, которые обычно используются в этих реакциях.
В 1877 году для получения алкилгалогенида использовалась описанная ниже процедура, но она сопровождалась нежелательной дополнительной активностью, которая снижала ее эффективность.
В качестве средства устранения этих ограничений была разработана новая улучшенная реакция: ацилирование Фриделя-Крафтса, также известное как алканоилирование Фриделя-Крафтса.
Самый первый шаг начинается с образования иона ацилия, который вступает в реакцию с бензолом на последующей стадии. Второй шаг касается атаки иона ацилия на бензол как нового электрофила, что приводит к одной сложной структуре. Третий шаг включает удаление протона, чтобы гарантировать, что ароматичность вернется к бензолу. На третьем этапе AlCl₄ возвращается, чтобы удалить протон из бензольного кольца, тем самым позволяя кольцу вернуться к своей ароматичности. При этом исходный AlCl2 регенерируется для повторного использования вместе с HCl. Кетон образуется как первый конечный продукт реакции. Эта первая часть продукта является сложной с хлоридом алюминия. Заключительный этап включает добавление воды для высвобождения конечного продукта в виде ацилбензола:
Поскольку ион ацилия (как было показано на первом этапе) стабилизируется из-за резонанса, перегруппировка здесь не происходит (ограничение этой реакции). Кроме того, из-за дезактивации продукта он больше не подвержен электрофильным атакам и, следовательно, больше не будут инициироваться дальнейшие реакции (еще одно ограничение). Однако ацилирование Фриделя-Крафтса может потерпеть неудачу из-за сильных дезактивирующих колец.
Но у этого алкилирования есть пара недостатков. К этим недостаткам можно отнести:
- Есть шансы на перестановки
- Нельзя также игнорировать вероятность многократного добавления
- Это не применимо к бензолам с несколькими электроноакцепторными группами.
Чтобы решить эти проблемы, было введено ацилирование Friedel Craft. Этот метод ацилирования решает первые две проблемы.
Нуклеофильное ароматическое замещение.
Нуклеофильное ароматическое замещение включает реакцию замещения, при которой нуклеофил перемещает сильную уходящую группу, такую как галогенид, на ароматическое кольцо. Эта реакция в основном происходит по одному из двух механизмов:
а) реакция присоединения-элиминирования или
б) Реакция элиминирования-присоединения
Основной принцип этой реакции может быть сформулирован в виде, когда замещенные атомы H «уходят» в виде протона, а формально электроны в связи CH «остаются позади», и существует необходимость завершить связывание с помощью электронодефицитный электрофил.
Когда нуклеофил заменяет водород, не может произвести замену, поскольку предполагается, что электроны также «уходят» (нуклеофил приносит свои собственные электроны в форме гидрид-аниона H-), возникает потребность в более уходящей группе. которые могут «забирать» электроны, нуждаются в обычной уходящей группе, такой как галогенид. Электроны — очень плохие уходящие группы.
Бензильное положение и его влияние на реакционную способность бензола
Ароматичность бензола обуславливает его устойчивость ко многим реакциям, в которых обычно могут принимать участие алкены. Однако химики нашли способы реагировать на бензол, следуя различным другим методикам. Мы начнем обсуждение бензольных реакций с процессов, которые происходят не непосредственно в кольце, а на атоме углерода, непосредственно связанном с бензольным кольцом, точнее называемом бензольным углеродом.
Сильные окислители, такие как H₂CrO₄ и KMnO₄, не могут даже повлиять на бензол. Когда толуол обрабатывают этими окислителями в экстремальных условиях, метильная группа боковой цепи окисляется до карбоксильной группы с образованием основного побочного продукта бензойной кислоты.
Окисление метильной группы, сохраняющее ароматическое кольцо незатронутым, делает очевидным, что ароматическое кольцо чрезвычайно стабильно. Галоген и нитрозаместители в ароматическом кольце даже остаются незатронутыми этими окислениями. Например, хромовая кислота окисляет 2-хлор-4-нитротолуол с образованием 2-хлор-4-нитробензойной кислоты. Но и здесь нитро- и хлор-группы остаются неизменными.
Эти условия также позволяют окислять этилбензол и изопропилбензол до бензойной кислоты. Опять же, боковая цепь трет-бутилбензола, лишенная бензилового водорода, не подвержена влиянию этих окислительных условий.
Если бензиловый водород существует, то бензильный углерод окисляется до карбоксильной группы, и происходит удаление всех других углеродов боковой цепи. Если бензиловый водород отсутствует, как в случае трет-бутилбензола, окисление боковой цепи также не происходит.
Химические свойства
- Строение, номенклатура, изомерия
- Способы получения
- Химические свойства
1. Реакции замещения в бензольном кольце
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.
Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.
Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
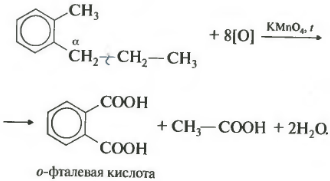
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
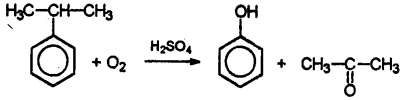
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
http://bystudin.ru/%D0%B1%D0%B5%D0%BD%D0%B7%D0%BE%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8-%D0%B3%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5/
http://stepenin.ru/organic/benzene/properties