Методы получения хлорбензола
СОДЕРЖАНИЕ
ГЛАВА 1 Получение хлорбензола
1.1 Основные физико–химические свойства сырья, полупродуктов и готовой продукции. . 5
1.2 Методы получения хлорбензола. 10
1.3 Основные сведения о механизме процесса. 14
1.4 Теоретические основы принятого метода. 18
ГЛАВА 2 Технологическая и эксплуатационная характеристика процесса
2.1 Подробное описание технологической схемы производства. 22
2.2 Охрана окружающей среды.
Отходы производства и их использование. 26
2.3 Техника безопасности, противопожарные мероприятия и охрана труда..28
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ. 33
ВВЕДЕНИЕ
Актуальность работы. Промышленность основного органического синтеза является одной из важнейших отраслей химического производства. К основному органическому синтезу обычно относят производства синтетических органических продуктов пластических масс и резины. Сырьём для промышленности органического синтеза являются: нефть, уголь и газ. Из них путём переработки получают пять групп углеводородов, на которых базируется весь органический синтез.
Хлорбензол относится к классу хлорпроизводных ароматических углеводородов. Хлорбензол – важный полупродукт в получении анилиновых красителей; он используется также как промежуточный продукт для получения фенола, ДДТ, салициловых препаратов; является хорошим растворителем этилцеллюлозы и многих смол.
Цель работы.Исследование процесса получения хлорбензола и технологии его производства.
Задачи работы:
1) выявить, какое сырье, и какие методы получения применяются в промышленности;
2) разобрать механизм реакции хлорирования бензола;
3) ознакомиться с технологическими процессами получения хлорбензола;
4) узнать об охране окружающей среды и отходах производства при производстве хлорбензола;
5) ознакомиться с техникой безопасности при работе с бензолом, хлором и хлорбензолом.
Структура и объем работы.Курсовая работа изложена на 31 страницах машинописного текста, состоит из введения, двух глав, выводов, и списка использованных источников, который включает в себя 22 отечественных и 8 иностранных авторов. Работа содержит 2 рисунка и 11 таблиц.
Предметом исследованияявляется методы получения хлорбензола в промышленности, аобъектом исследованияявляется хлорбензол.
Теоретическая значимостьзаключается
Практическая значимость. Хлорбензол
ГЛАВА 1. Получение хлорбензола
1.1 Основные физико–химические свойства сырья, полупродуктов и готовой продукции
Сырьём для производства хлорбензола являются бензол и хлор.
Бензол. Физические свойства:
Бензол – бесцветная жидкость со специфическим запахом; молярная масса 78; температура кипения 81 o С; температура плавления 5,5 o С; температура вспышки – 14 o С; удельная теплоёмкость при постоянном давлении 1,7 Дж/г·К; плотность 0,879 г/см 3 ; ∆Н = 82,96 кДж/моль.
Химические свойства: Взаимодействие бензола с хлором происходит по реакции (1.1.1), с образованием хлорбензола:
C6H6 + Cl2 
Взаимодействие бензола с неорганическими кислотами идут по реакциям (1.1.2) и (1.1.3), с образованием производных бензола и воды:
С6H6 + HNO3 
C6H6 + H2SO4 
Окисление бензола показана на реакциях (1.1.4) и (1.1.5)
C6H6 + 0,5O2 

Гидрирование бензола идет по реакции (1.1.6), с образованием циклогексана:
С6H6 + 3H2 
Взаимодействие бензола со спиртами происходит по реакции (1.1.7):
С6H6 + C2H5OH 
Алкилирование бензола идет по реакции (1.1.8)
С6Н6 + СН2=СН2 
C6H6 + C2H2Br 
Взаимодействие бензола с окисью этилена идет по реакции (1.1.9):



О фенилэтиловый спирт
Таблица №1 Бензол [ГОСТ 8448-78]
| Наименование показателя | Показатель | Наименование показателя | Показатель |
| Массовая доля основного вещества, %, не менее | 99,80 | Температура кристаллизации, 0 С, не ниже | 5,4 |
| Плотность при 20 0 С, г/см 3 , в пределах | 0,878–0,880 | Массовая доля тиофена, % не более | 0,0001 |
| Температурные пределы перегонки, при 101325 Па, 0 С | 79,6–80,3 | Показатель цветности сернокислой вытяжки по бихроматной шкале, не выше | |
| В интервале, 0 С | 0,4 | Массовая доля общей серы, %, не более | 0,0005 |
| Объёмная доля отгонки, % | Массовая доля нелетучего остатка, не более | 0,02 | |
| Фасовка | Фасовка | ||
| Стекло 20,0 дм 3 | Стекло 1,0 дм 3 | ||
| Стекло 5,0 дм 3 | Стекло 0,5 дм 3 |
Хлор. Физические свойства:
Хлор, формула Cl2 – желтовато-зелёный газ; молярная масса 71; температура кипения -34,1 o С; температура плавления –101,03 o С; удельная теплоёмкость при постоянном давлении 0,471 Дж/г·К; плотность 0,00321 г/см 3 ; динамическая вязкость 0,00133 мПа·с; ∆Н = 0 кДж/моль.
Взаимодействие хлора с неметаллами может идти по реакциям (1.1.10) и (1.1.11):
Cl2 + F2 
Cl2 + 3F2 
Взаимодействие хлора с металлами идет по реакциям (1.1.12.) и (1.1.13.), с образованием хлоридов:
Cl2 + 2Na 
3Cl2 + 2Al 
Взаимодействие хлора с водой может идти при свете по реакции (1.1.14), с образованием хлорноватистой и соляной кислот:
Cl2 + H2O 
Взаимодействие хлора со щелочами (формула 1.1.15):
Cl2 +2KOH 
Взаимодействие хлора с углеводородами (формула 1.1.16) и (формула 1.1.17):
Cl2 + CH4 
Cl2 + C2H4 
Взаимодействие хлора с бензолом идет по реакции (1.1.18):
Cl2 + C6H6 
Таблица №2 Хлор (ГОСТ 6718-93)
| Наименование показателей | Нормы |
| 1. Содержание хлора в об. %, не менее | 99,6 |
| 2. Содержание влаги в вес. %, не более | 0,05 |
| 3. Содержание трёххлористого азота в вес. %, не более | 0,005 |
Готовым продуктом хлорирования бензола является хлорбензол.
Хлорбензол. Физические свойства:
Хлорбензол – бесцветная жидкость с характерным запахом; молярная масса 112,5; температура плавления -45,58 0 С; температура кипения 132 0 С; давление пара 1,33 кПа; удельная теплоёмкость при постоянном давлении 1,330 Дж/г·К; ∆Н = -111,7 кДж/моль.
Гидролиз хлорбензола водным раствором щёлочи (формула 1.1.19):
C6H5Cl + 2NaOH 
Взаимодействие хлорбензола с аммиаком идет с образованием анилина (формула 1.1.20)
С6H5Cl + NH3 
С6H5Cl + HNO3 
Сульфирование хлорбензола (формула 1.1.22):
С6H5Cl + H2NO4 
Взаимодействие хлорбензола с хлором:
С6H5Cl + Cl2 
Таблица №3 Хлорбензол [ГОСТ 646-60]
| Марка А | Марка Б | ||
| Сорт 1 | Сорт 2 | ||
| 1. Внешний вид | Прозрачная бесцветная жидкость без механических примесей | ||
| 2. 95% по объёму должно перегоняться в пределах изменения температуры в 0 С, не более | 0,7 | 2,0 | 3,5 |
| 3. Реакция водной вытяжки | Нейтральная | ||
| 4. Содержание бензола в %, не более | Не определ. | 0,1 | 0,3 |
| 5. Содержание полихлоридов в %, не более | Не определ. | 0,75 | 1,0 |
Методы получения хлорбензола
Хлорбензол был открыт в 1851 году как продукт реакции фенола с хлоридом фосфора(V) и так он обычно получается в лаборатории. В промышленности хлорбензол получают следующими методами:
1.1.1 Каталитическое хлорирование бензола может идти двумя способами:
Бензол хлорируют хлором в присутствии катализатора, продукты реакции ректифицируют, бензол рециклизуют на хлорирование, а выделенные при этом полихлориды бензола подвергают каталитическому гидрогенолизу с получением хлорбензола и бензола, которые направляют на стадию ректификации продуктов реакции после хлорирования бензола
Способ получения хлорбензола путем непрерывного каталитического хлорирования бензола хлором, отмывкой образовавшегося хлорбензола-сырца от катализатора, азеотропной осушкой хлорбензола-сырца с последующим выделением товарного хлорбензола ректификацией.
В качестве катализатора используют хлорное железо, которое образуется в процессе хлорирования из железных колец, шаров или стружки, загруженных в реактор. Процесс хлорирования бензола проводят при температуре 80-85 о С при 40-50 % конверсии бензола по реакции (1.2.1.):
Одновременно с целевым продуктом хлорбензолом в результате последовательных реакций более глубокого хлорирования, в процессе образуются полихлориды бензола, представляющие собой смесь 1,2-, 1,3- и 1,4-дихлорбензолов (формула 1.2.2)
Кроме того, в состав полихлоридов входит небольшое количество смолистых веществ.
Недостатком известного способа является низкая селективность процесса за счет образования полихлорбензолов.
Целью изобретения является повышение селективности процесса, выхода хлорбензола, снижение расходных коэффициентов по сырью, снижение количества отходов.
Поставленная цель достигается путем направления полихлоридов бензола на стадию каталитического гидрогенолиза, а продукты гидрогенолиза полихлоридов бензола направляются на систему ректификации хлорбензола-сырца. Процесс гидрогенолиза полихлоридов бензола проводят водородом при 300-350 о С на катализаторе, содержащем 0,5 мас. Pd на окиси алюминия (промышленный палладиевый катализатор МА-15). В результате процесса гидрогенолиза образуются хлорбензол и бензол (формулы 1.2.3 и 1.2.4)
C6H4Cl2 + H2 → C6H5Cl + HCl (1.2.3)
Таким образом каталитическим хлорированием бензола элементарным хлором с последующей ректификацией продуктов реакции и выделением целевого хлорбензола, бензола для рецикла на хлорирование и полихлоридов бензола, отличающийся тем, что выделенные полихлориды бензола подвергают каталитическому гидрогенолизу с получением хлорбензола и бензола, которые направляют на стадию ректификации продуктов реакции после хлорирования бензола, получают в промышленности.
Рассмотрим окислительное хлорирование бензола (при низких температурах)
Периодический процесс хлорирования бензола может идти по реакции (1.2.5):
C6H6 + Cl2 
Наряду с основной реакцией идут побочные реакции с образованием полихлоридов (формулы 1.2.6 и 1.2.7):
C6H6 + 2Cl2 
C6H6 + 3Cl2 
В настоящее время этот метод почти не используется, так как процесс идёт при низких температурах (t ≈ 20 о C), поэтому необходим отвод большого количества тепла реакции.
Достоинства: можно использовать, если необходимо получить небольшое количество хлорбензола.
Недостатки: низкая производительность; необходимо отводить большое количество тепла; требуется предварительная очистка и осушка бензола.
Непрерывный процесс хлорирования бензола осуществляется при температуре 75-83 о С (температура кипения бензола) за счёт испарения избыточного количества бензола. Процесс идёт в жидкой фазе, в качестве катализатора применяется железо и его соли (FeCl3) (формула 1.2.8).
C6H6 + Cl2 
Наряду с основной реакцией идут побочные реакции с образованием полихлоридов, которые показаны в формулах (1.2.9) и (1.2.10):
C6H6 + 2Cl2 
C6H6 + 3Cl2 
Мольное соотношение бензола и хлора поддерживают, равным 3,5 ÷ 1:1, а содержание хлорбензола примерно равно 40 %. На 1т образовавшегося хлорбензола берётся 1,5 т бензола на испарение и избыточное количество бензола с таким расчётом, чтобы в продуктах реакции оставалось до 65 % не прореагировавшего бензола. Получаемый хлорбензол содержит 0,3–1,1 % полихлоридов и около 0,3% бензола.
Достоинства: Высокая производительность хлоратора; образование катализатора непосредственно при хлорировании бензола; интенсивный отвод тепла реакции.
Недостатки: необходима предварительная очистка и осушка бензола; берётся избыточное количество бензола; протекание большого количества побочных реакций.
Окислительное хлорирование бензола происходит по реакции (1.2.11)
С6H6 + HCl + 0,5O2 
Процесс окисления проводят в паровой фазе над катализатором, состоящим из хлоридов меди и железа на окиси аммония. Температура процесса 235-245 о С. Количественное соотношение бензола, хлористого водорода и кислорода составляют примерно 10:2:3. Превращение бензола за один проход составляет 10-15 %.
Достоинства: выход чистого хлорбензола составляет 95-98 %.
Недостатки: необходимо применять коррозионно-стойкое оборудование.
Способы получения аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
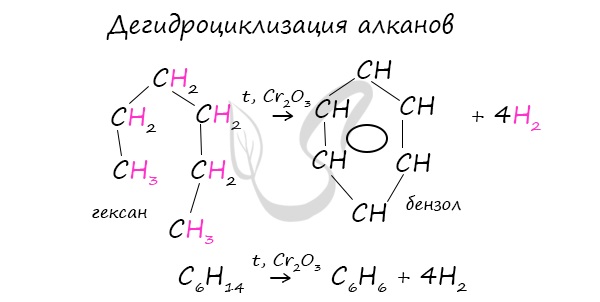
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
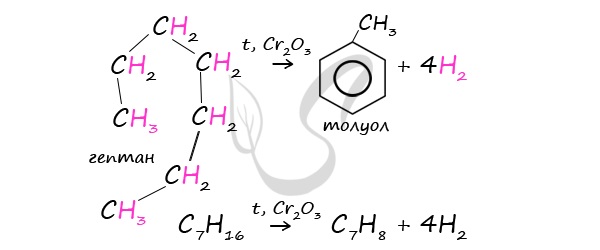
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
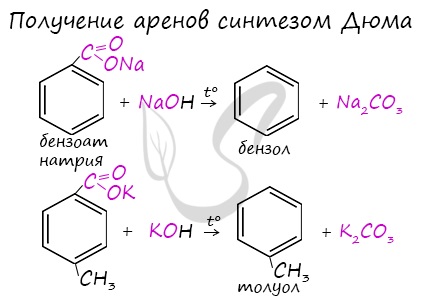
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
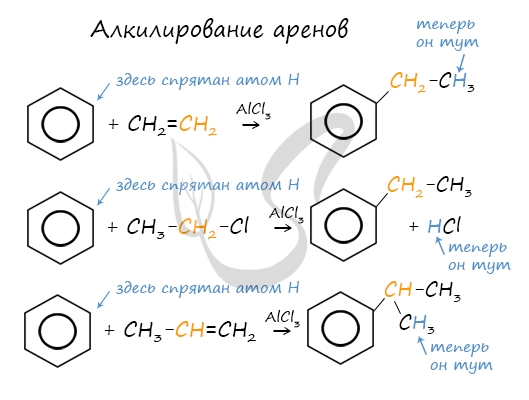
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
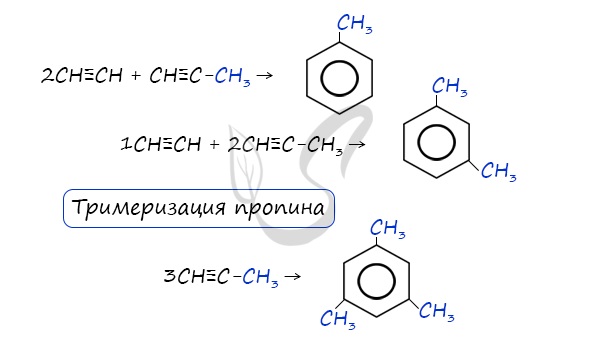
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
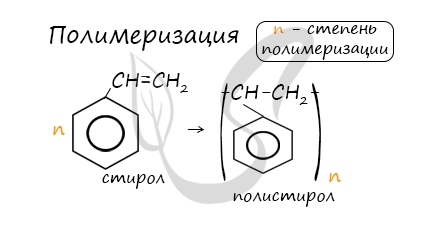
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Бензол и его гомологи
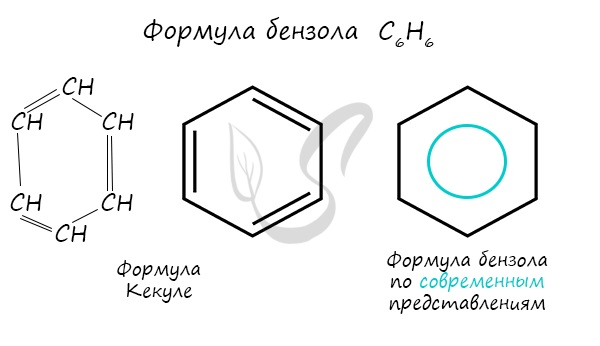
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
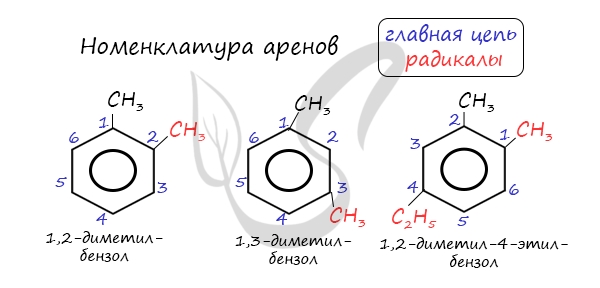
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
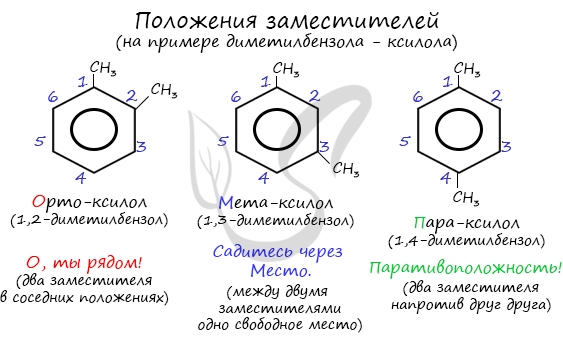
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
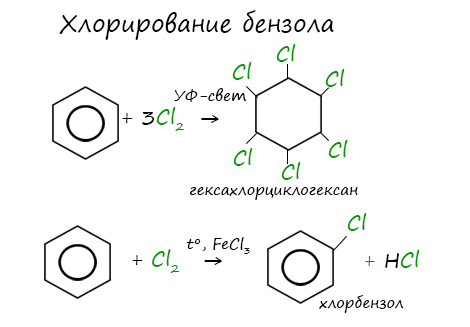
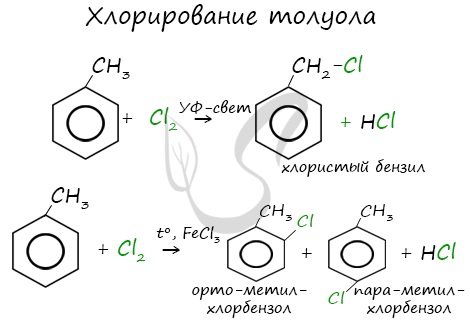
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
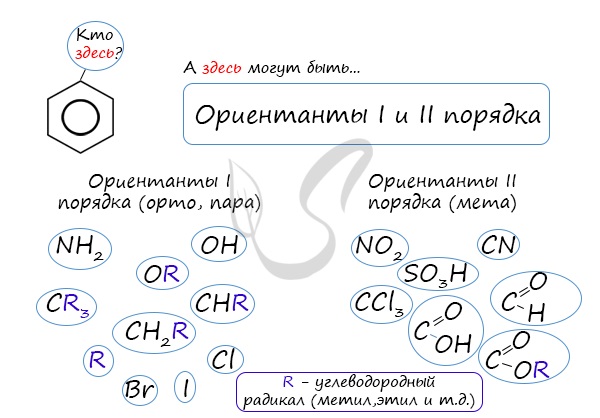
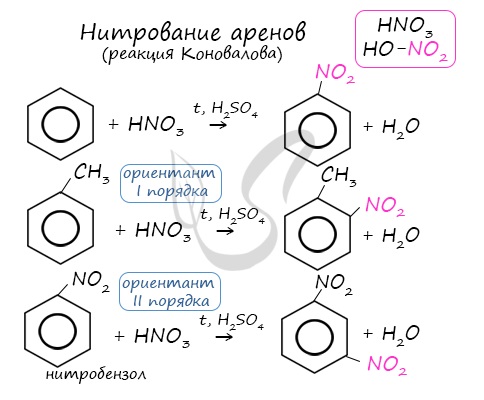
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
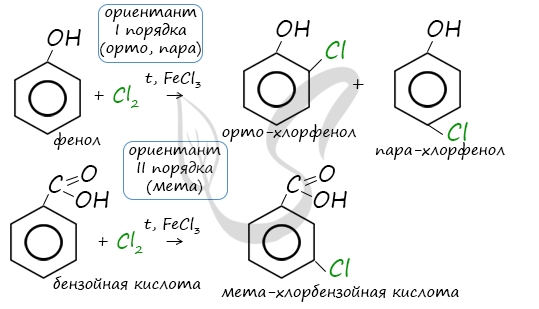
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
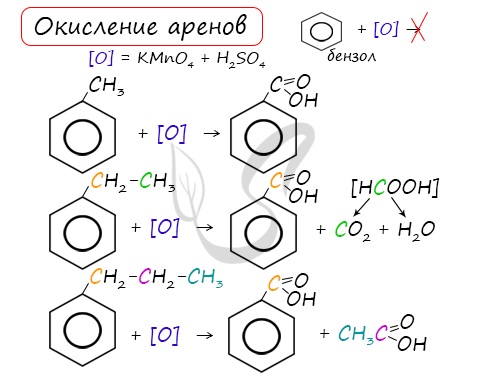
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://chemege.ru/sposoby-polucheniya-arenov/
http://studarium.ru/article/186