ПОДГОТОВКА К ЕГЭ ПО ХИМИИ. КАРБОНОВЫЕ КИСЛОТЫ.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп
Классификация карбоновых кислот.
1. По числу карбоксильных групп:
— одноосновные (монокарбоновые)
— многоосновные (дикарбоновые, трикарбоновые и т.д.).
По характеру углеводородного радикала:
НАЗВАНИЯ КАРБОНОВЫХ КИСЛОТ.
ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТ.
1. Изомерия углеродной цепи. Начинается с бутановой кислоты ( С 3 Н 7 СООН ), которая существует в виде двух изомеров: масляной (бутановой) и изомасляной (2-метилпропановой) кислот.
2. Изомерия положения кратной связи в непредельных кислотах, например:
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кротоновая кислота)
3. Цис-, транс-изомерия в непредельных кислотах, например:
4. Межклассовая изомерия: Карбоновые кислоты изомерны сложным эфирам:
5. Изомерия положения функциональных групп у гетерофункционалъных кислот.
Например, существуют три изомера хлормасляной кислоты: 2-хлорбутановая, 3-хлорбутановая и 4-хлорбутановая.
СТРОЕНИЕ КАРБОКСИЛЬНОЙ ГРУППЫ.

Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается.
ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ – в них гидроксогруппа замещена на некоторые другие группы. Все они при гидролизе образуют карбоновые кислоты.
ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ.
1. Окисление спиртов в жестких условиях – раствором перманганата или дихромата калия в кислой среде при нагревании.
2.Окисление альдегидов : раствором перманганата или дихромата калия в кислой среде при нагревании, реакцией серебряного зеркала, гидроксидом меди при нагревании.
3. Щелочной гидролиз трихлоридов :
4. Гидролиз сложных эфиров.
RCOOK + HCl R-COOH + KCl
5. Гидролиз нитрилов, ангидридов, солей.
1)нитрил: R — CN + 2 H 2 O –( H + ) RCOOH
2)ангидрид: ( R — COO )2 O + H 2 O 2 RCOOH
3)натриевая соль: R — COONa + HCl R — COOH + NaCl
6. Взаимодействие реактива Гриньяра с СО2:
R-MgBr + CO2 R-COO-MgBr
R-COO-MgBr -(+H2O) R-COOH +Mg(OH)Br
7. Муравьиную кислоту получают нагреванием оксида углерода (II) с гидроксидом натрия под давлением:
NaOH + CO –(200 o C,p) HCOONa
8. Уксусную кислоту получают каталитическим окислением бутана:
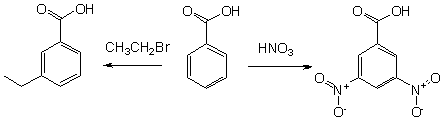
9. Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
1. Кислотные свойства – замещение атома Н в карбоксильной группе на металл или ион аммония.
1.Взаимодействие с металлами
2.Взаимодействие с оксидами металлов
3.Реакция нейтрализации с гидроксидами металлов
4.Взаимодействие с солями более слабых и летучих (или нерастворимых) кислот
4*. Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими карбонатами и гидрокарбонатами.
В результате наблюдается выделение углекислого газа.
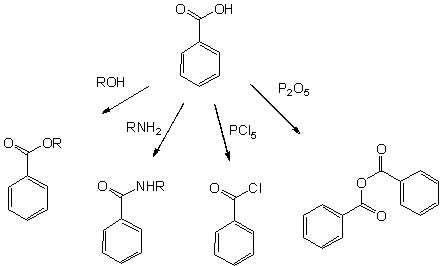
2. Замещение гидроксильной группы:
5 .Реакция этерификации
6.Образование галоген-ангидридов – с помощью хлоридов фосфора ( III ) и ( V ).
7. Образование амидов:
8. Получение ангидридов.
С помощью Р2О5 можно дегидратировать карбоновую кислоту – в результате получается ангидрид.
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе ( -углеродный атом)
9.Галогенирование кислот – реакция идёт в присутствии красного фосфора или на свету.
Особенности муравьиной кислоты.
1. Разложение при нагревании.
Н — СООН –(H 2 SO 4 конц ,t) CO + H 2 O
2. Реакция серебряного зеркала и с гидроксидом меди ( II ) – муравьиная кислота проявляет свойства альдегидов.
3. Окисление хлором и бромом, а также азотной кислотой.
Особенности бензойной кислоты.
1. Разложение при нагревании – декарбоксилирование.
П
2. Реакции замещения в ароматическом кольце.


Особенности щавелевой кислоты.
1. Разложение при нагревании
2. Окисление перманганатом калия.
Особенности непредельных кислот (акриловой и олеиновой).
1. Реакции присоединения.
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
СН 2 = СН — СООН + Н Br Br-CH 2 -CH 2 -COOH
Также к непредельным кислотам можно присоединять галогены и водород:
2. Реакции окисления
При мягком окислении акриловой кислоты образуется 2 гидроксогруппы:
3СН2=СН-СООН+2 KMnO 4+2 H 2 O 2 CH 2( OH )- CH ( OH )- COO К + CH 2( OH )- CH ( OH )- COOH +2 MnO 2
Свойства солей карбоновых кислот.
1. Обменные реакции с более сильными кислотами и со щелочами.
CH3-COONa + HCl CH3-COOH + NaCl
2. Термическое разложение солей двухвалентных металлов (кальция, магния, бария)- образуются кетоны.
3. Сплавление солей щелочных металлов со щелочью (реакция Дюма)- получаются алканы.
4. Электролиз водных растворов солей карбоновых кислот (реакция Кольбе).
1. Гидролиз – получается кислота.
2. Реакции ацилирования бензола, аминов, солей фенола.
C
Бензойная кислота
| Бензойная кислота | |
|---|---|
 | |
| Систематическое наименование | бензойная кислота |
| Традиционные названия | бензойная кислота |
| Хим. формула | C6H5COOH |
| Рац. формула | C7H6O2 |
| Состояние | твёрдая, кисловато-горький вкус |
| Молярная масса | 122.12 г/моль |
| Плотность | 1.32 г/см³ |
| Т. плав. | 122.4 °C |
| Т. кип. | 249.2 °C |
| Т. разл. | 370 °C |
| Т. всп. | 121 °C |
| Т. свспл. | 570 °C |
| Удельная теплота испарения | 527 Дж/кг |
| Удельная теплота плавления | 18 Дж/кг |
| pKa | 4.20 |
| Растворимость в воде | 0,29 г/100 мл |
| Показатель преломления | 1,504 |
| Дипольный момент | 1.72 Д |
| ГОСТ | ГОСТ 10521-78 ГОСТ 6413-77 |
| Рег. номер CAS | 65-85-0 |
| PubChem | 243 |
| Рег. номер EINECS | 200-618-2 |
| SMILES | |
| Кодекс Алиментариус | E210 |
| RTECS | DG0875000 |
| ChEBI | 30746 |
| ChemSpider | 238 |
| Токсичность | LD50 500 mg·kg−1 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
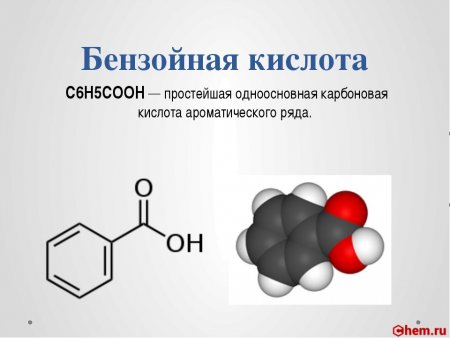
Бензойная кислота C6H5COOH — простейшая одноосновная карбоновая кислота ароматического ряда.
Содержание
- 1 История
- 2 Физические свойства
- 3 Получение
- 4 Лабораторный синтез и очистка
- 4.1 Гидролиз
- 4.2 Реакция Канниццаро
- 4.3 Реакция Гриньяра
- 4.4 Окисление
- 5 История получения
- 6 Применение
- 6.1 Калориметрия
- 6.2 Сырьё
- 6.3 Консервант
- 6.4 Медицина
- 6.5 Другие применения
- 7 Биологическое действие и влияние на здоровье человека
- 7.1 Бензольное кольцо
- 7.2 Карбоксильная группа
- 8 Производные
- 8.1 Соли
История
Впервые выделена возгонкой в 16 веке из бензойной смолы (росного ладана), отсюда и получила своё название. Этот процесс был описан у Нострадамуса (1556), а затем у Жироламо Рушелли (1560, под псевдонимом Alexius Pedemontanus) и у Блеза де Виженера (1596).
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась в консервировании фруктов.
Физические свойства
Бензойная кислота — белые кристаллы, плохо растворимые в воде, хорошо — в этаноле, хлороформе и диэтиловом эфире. Бензойная кислота является, подобно большинству других органических кислот, слабой кислотой (pKa 4,21).
Чистая кислота имеет температуру плавления 122,4 °C, температуру кипения 249 °C.
Легко возгоняется; перегоняется с водяным паром, поэтому неэффективно повышать концентрацию водных растворов бензойной кислоты упариванием раствора.
Получение
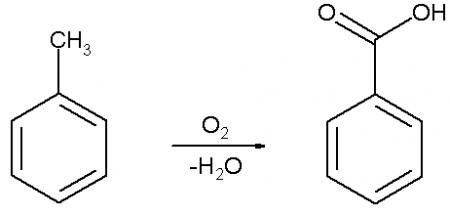
Бензойную кислоту можно получить окислением толуола сильными окислителями, такими, например, как перманганат калия, оксид хрома (VI), азотная или хромовая кислота, а также декарбоксилированием фталевой кислоты.
В промышленных масштабах бензойную кислоту получают окислением толуола кислородом на катализаторе (нафтената марганца или кобальта).
Лабораторный синтез и очистка
Химический продукт — бензойная кислота — дешёв и легкодоступен. Поэтому к лабораторному синтезу профессиональные химики прибегают редко.
Демонстрационный синтез осуществляется в учебных целях.
Очистку бензойной кислоты удобно проводить перекристаллизацией из растворителя, обычно, из воды. Другие растворители пригодные для перекристаллизации: уксусная кислота (ледяная и водный раствор), бензол, ацетон, петролейный эфир и смесь этанола с водой.
Гидролиз
Бензамид и бензонитрил гидролизуются в воде в присутствии кислоты или основания до бензойной кислоты.
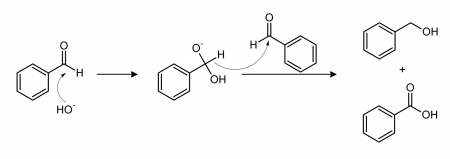
Реакция Канниццаро
Бензальдегид в основной среде претерпевает преобразование по реакции Канниццаро. В итоге получается бензойная кислота и бензиловый спирт.
Реакция Гриньяра
Из бромбензола по реакции карбоксилирования фенилмагнийбромида.
Окисление
Толуол или бензиловый спирт могут быть окислены подкисленным раствором перманганата калия до бензойной кислоты:
История получения
Первый производственный процесс включал в себя гидролиз бензолтрихлорида под действием гидроксида кальция в воде в присутствии железа или его солей в качестве катализатора. Образующийся бензоат кальция переводили в бензойную кислоту обработкой соляной кислотой. Продукт содержал значительное количество хлорпроизводных бензойной кислоты, поэтому не использовался в качестве пищевой добавки. В настоящее время в пищу используется бензойная кислота, получаемая синтетически.
Применение
Калориметрия
Бензойная кислота используется как вещество в качестве теплового стандарта для калибровки калориметров по температуре и теплоёмкости, так как теплота кристаллизации и плавления хорошо известны и воспроизводимы.
Сырьё
Бензойная кислота служит для получения многих реактивов, наиболее значимые из них:
- Бензоилхлорид, C6H5C(O)Cl, получается обработкой бензойной кислоты тионилхлоридом, фосгеном или хлоридами фосфора PCl3 и PCl5. C6H5C(O)Cl — важное исходное вещество для некоторых производных бензойной кислоты, таких как бензилбензоат, используемый как искусственный ароматизатор и репеллент.
- Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаемые переэтерефикацией метилбензоата с соответствующим диолом. Альтернативно эти вещества получаются действием бензоилхлорида на соответствующий диол. Эти пластификаторы используются с соответствующими эфирами терефталевой кислоты.
- Фенол, C6H5OH, получаемый окислительным декарбоксилированием при 300—400 °C. Необходимая температура, может быть понижена до 200 °C добавлением каталитических количеств солей меди (II). Далее фенол может быть конвертирован в циклогексанол, который служит исходным веществом в синтезе нейлона.
Консервант
Бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213).
Бензойная кислота, блокируя ферменты, замедляет обмен веществ во многих одноклеточных микроорганизмах и грибках. Она подавляет рост плесени, дрожжей и некоторых бактерий.
В пищевые продукты её добавляют в чистом виде или в виде натриевой, калиевой или кальциевой соли.
Губительное действие на микрофлору начинается с абсорбции бензойной кислоты липидной стенкой клетки.
Поскольку через стенку клетки может проникнуть только недиссоциированная кислота, бензойная кислота проявляет антимикробное действие только в кислых пищевых продуктах.
Если внутриклеточный pH 5 или меньше, анаэробная ферментация глюкозы через фосфорфруктокиназу уменьшается на 95 %. Эффективность бензойной кислоты и бензоатов зависит от кислотности (pH) пищи.
Кислая пища, напитки, такие, как фруктовые соки, (содержащие лимонную кислоту), газированные напитки, содержащие в растворе (углекислый газ), безалкогольные напитки с (фосфорной кислотой), соленья (молочная кислота) и другие кислые пищевые продукты консервируются бензойной кислотой и её солями.
Принятые и оптимальные концентрации бензойной кислоты при консервации пищи 0,05—0,1 %.
Медицина
Бензойную кислоту применяют в медицине при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, при трихофитиях и микозах, а её натриевую соль, — бензоат натрия — как отхаркивающее средство.
Другие применения
Эфиры бензойной кислоты (со спиртами от метилового до амилового) обладают сильным и приятным запахом и применяются в парфюмерной промышленности.
Некоторые другие производные бензойной кислоты, такие как, например, хлор- и нитробензойные кислоты, широко применяются для синтеза красителей.
Биологическое действие и влияние на здоровье человека
Бензойная кислота в свободном виде и виде сложных эфиров встречается в составе многих растений и животных. Значительное количество бензойной кислоты находится в ягодах (около 0,05 %). Зрелые плоды некоторых видов вакциниума содержат большое количество свободной бензойной кислоты. Например, в бруснике — до 0,20 % в спелых ягодах, и в клюкве — до 0,063 %. Бензойная кислота также образуется в яблоках после заражения грибком Nectria galligena. Среди животных, бензойная кислота обнаружена в основном во всеядных или фитофагных видах, например, во внутренних органах и мускулах тундряной куропатки (Lagopus muta), также как и в выделениях самцов овцебыка или азиатского слона.
Бензойная смола содержит до 20 % бензойной кислоты и 40 % бензойных эфиров.
Бензойная кислота присутствует, как часть гиппуровой кислоты (N-бензоилглицин) в моче млекопитающих, особенно травоядных животных. Бензойная кислота хорошо всасывается, через коэнзим А связывается с аминокислотой глицином в гиппуровую кислоту и в таком виде выводится через почки. Человек выделяет около 0,44 г/л гиппуровой кислоты в день в моче и больше, если находится в контакте с толуолом или бензойной кислотой. Для человека считается безопасным потребление 5 мг/кг массы тела в день. Кошки имеют гораздо более низкую толерантность к бензойной кислоте, чем мыши и крысы. Летальная доза для кошек — 300 мг/кг массы тела. Оральная ЛД50 для крыс 3040 мг/кг, для мышей 1940—2260 мг/кг.
Бензольное кольцо
Электрофильное ароматическое присоединение происходит по 3-му положению из-за электроноакцепторных свойств карбоксильной группы. Второе замещение происходит сложнее (правая часть) благодаря деактивации нитрогруппой. Наоборот, при введении электронодонорного заместителя (например, алкила), второе замещение происходит легче.
Карбоксильная группа
Все реакции, характерные для карбоксильной группы, возможны с бензойной кислотой:
- Эфиры бензойной кислоты — продукты кислотнокатализируемой реакции со спиртами
- Амиды бензойной кислоты легко доступны, используя для их синтеза активированные производные(такие как бензоилхлорид), или сочетающие реагенты используемые в пептидном синтезе такие как ДЦГК и ДМАП.
- Более активный бензойный ангидрид образуется при дегидратации уксусным ангидридом или оксидом фосфора
- Высокоактивные галогенангидриды легко получаются действием хлоридом фосфора(V) или тионилхлорида
- Ортоэфиры могут быть получены в сухих условиях реакцией бензонитрила в кислой среде со спиртами
- Восстановление до бензальдегида или бензилового спирта возможно при использовании LiAlH4 или борогидрида натрия
- Декарбоксилирование серебряной соли может быть проведено при нагревании, бензойная кислота может быть декарбоксилирована при нагревании с сухими щёлочами или гидроксидом кальция.
- Бензойная кислота образует соли
Производные
- 2,3-дигидроксибензойная кислота (пирокатехиновая кислота)
- 2,4-дигидроксибензойная кислота (бета-резорциловая кислота)
- 2,5-дигидроксибензойная кислота (гентизиновая кислота)
- 2,6-дигидроксибензойная кислота (гамма-резорциловая кислота)
- 3,4-дигидроксибензойная кислота (протокатехиновая кислота)
- 3,5-дигидроксибензойная кислота (альфа-резорциловая кислота)
- 3-нитробензойная кислота
- 3,5-динитробензойная кислота
- Толуиловые кислоты
Соли бензойной кислоты называются бензоатами, например:
- Бензоат аммония
- Бензоат лития
- Бензоат натрия
- Бензоат магния
- Бензоат марганца
- Бензоат меди(II)
- Бензоат ртути(II)
- Бензоат свинца(II)
- Бензоат серебра
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://chem.ru/benzojnaja-kislota.html http://acetyl.ru/o/a11k1r1ff2.php |