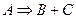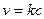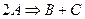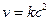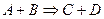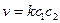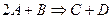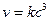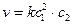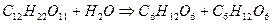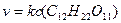Бимолекулярная реакция
БИМОЛЕКУЛЯРНАЯ РЕАКЦИЯ, химический процесс, протекающий между двумя молекулами — одинаковыми или отличными между собой. Скорость течения химического процесса в каждый момент пропорциональна наличной концентрации реагирующих молекул; поэтому в каждый данный момент скорость v бимолекулярной реакции выражается уравнением:
где А — концентрация, выраженная в молях первого реагирующего вещества в начале реакции, В — такая же концентрация второго вещества, х — число молекул, прореагировавших к моменту истечения t единиц времени от начала реакции, К — постоянный для данных условий коэффициент пропорциональности. Если обе участвовавшие в реакции молекулы одинаковы, то уравнение принимает следующий вид:
Интегрируя уравнение (2), получим
Но в начале реакции t = 0 и х = 0; поэтому
или, в случае неодинаковых молекул, интегрируя уравнение (1), имеем:
Величина К, характеризующая скорость реакции между данными веществами, м. б. определена экспериментально путем анализа концентрации продуктов реакции в разные моменты после ее начала. Для данной реакции, при данных условиях температуры, давления и данной концентрации присутствующего катализатора, коэффициент К постоянен для любых концентраций участвующих в реакции веществ (конечно, при сохранении соотношения концентраций между обоими реагирующими веществами). Поэтому экспериментальное констатирование постоянства К является одним из методов подтверждения бимолекулярного характера изучаемого процесса. Путем такого изучения кинетики химического процесса исследуются, например, реакции омыления сложных эфиров при действии щелочей, взаимодействие между йодистым метилом и гипосульфитом и др.
Иногда, например, при изучении протекающего в водном растворе такого процесса, в котором молекулы воды участвуют не только в качестве растворителя, но также и в самом процессе, — реакция, будучи по существу бимолекулярной, выражается при подавляющем избытке воды уравнением мономолекулярной реакции (вследствие кажущегося постоянства в продолжение всего процесса концентрации молекул воды).
Источник: Мартенс. Техническая энциклопедия. Том 2 — 1928 г.
Кинетическая классификация химических реакций
По числу молекул, принимающих участие в элементарном акте, реакции классифицируют на моно-, би- и тримолекулярные.
Мономолекулярныминазываются такие реакции, в которых химическому превращению подвергается одна молекула:
Кинетическое уравнение скорости для этого типа реакции имеет вид:
Бимолекулярные – такие реакции, в которых в элементарном акте встречаются две молекулы:
Тримолекулярные – реакции, в элементарном акте которых участвуют три молекулы (такие реакции встречаются редко):
В кинетике различают реакции нулевого, первого, второго, третьего и дробного порядков. Порядок реакции– это число, равное сумме показателей степеней концентраций реагирующих веществ в основном кинетическом уравнении. Для процесса, описываемого уравнением:
сумма показателей степеней равна 2 + 1 = 3, то есть это реакция третьего порядка.
Для простых по механизму реакций величины молекулярности и порядка совпадают, но для сложных реакций порядок не соответствует молекулярности. Такое несоответствие может быть вызвано большим избытком одного из реагентов. Например, при гидролизе сахарозы:
изменение концентрации воды так незначительно, что его можно не учитывать. Тогда основное кинетическое уравнение реакции можно записать:
Следовательно, реакция гидролиза сахарозы является бимолекулярной реакцией первого порядка.
Бимолекулярные и мономолекулярные реакции
Вы будете перенаправлены на Автор24
По аналогии реакциям нуклеофильного замещения $S_N$ можно предположить, что реакции электрофильного замещения осуществляются или одностадийно (механизм $S_E2$), или двухстадийно (механизму $S_El$).
Различия между бимолекулярными и мономолекулярными реакциями
Механизмы реакций электрофильного замещения можна записать при помощи следующих упращенных уравнений:
На первой, лимитирующей стадии механизма $S_El$ происходит процесс ионизации с образованием карбанионов $R^-$. Следовательно, проблема $S_El$-механизма связана с вопросом строения и стабильности карбанионов, которая уже рассматривалась ранее. Напомним, эта проблема заключается в кислотности $CH$-связей в органических соединениях. Очевидно, что скорости $S_E1$-реакций возрастают с увеличением стабильности карбанионов.
По $S_E2$ механизму осуществляется широкий круг реакций с участием металлоорганических реагентов (рассмотренных в отдельных главах), а также для электрофильных реакций алканов в суперкислых средах (также рассмотренных в отдельных главах). В этих случаях скорости реакций зависят не только от природы субстратов, но и от природы электрофильных реагентов, в частности, от их электрофильной силы реагентов. Следует указать, что указанные выше уравнения представляют собой только очень упрощенные схемы $S_E1$- и $S_E2$-реакций, и в действительности схемы этих механизмов также должны включать не только субстраты и электрофилы, но и участвующие в этих процессах нуклеофильные частицы, роль которых в реакциях электрофильного замещения чрезвычайно велика. Такое участие нуклеофилов реакциях электрофильного замещения получило общее название «нуклеофильного содействия». И тем не менее, при общем рассмотрении закономерностей протекания реакций алифатического электрофильного замещения эти приведенные упрощенные схемы механизмов представляются более удобными, и по ним, в частности, можно провести первичный анализ стереохимии таких реакций.
Готовые работы на аналогичную тему
Механизм $S_El$
Механизм $S_El$ аналогичен механизму $S_N1$ и включает две стадии: медленную ионизацию и быструю рекомбинацию:
Такому механизму должна соответствовать кинетика первого порядка, что подтверждается многими примерами. Доводы в пользу механизма $S_El$ получены также при изучении таутомерии, которая катализируется основаниями. Так, обмен дейтерия в реакции проходит с той же скоростью, что и рацемизация, и наблюдается изотопный эффект.
Реакции $S_N1$ не проходят при атомах углерода в голове моста мостиковых бициклических систем, состоящих из малых циклов, так как при этом невозможно образование плоских карбокатионов. Но карбоанионы, которые нестабилизированные резонансом, необязательно должны быть плоскими, так субстраты такого типа могут легко вступать в реакции $S_El$, что и наблюдается в действительности.
Вопросы строения карбоанионов тесно связаны с проблемой стереохимии реакций $S_El$. Если карбанионы плоские, в ходе реакции должно иметь место рацемизация; если они пирамидальные и способны удерживать такую форму, реакция должна проходить с сохранением конфигурации. Но, если пирамидальный карбанион меняет свою форму, например подвергается инверсии, как амины, реакция также будет сопровождаться рацемизации. К сожалению, изучению подлежат только те карбанионы, которые стабилизированы резонансом и поэтому являются плоскими. Так, главный подход к определению структуры простых алкильных карбанионов заключается в изучении стереохимии реакции $S_El$. Найдено, что в этих случаях реакции почти всегда сопровождаются рацемизацией, но неизвестно, связано это с тем, что карбанионы плоские, или пирамидальные карбанионы испытывают скорой инверсии. Во всяком случае рацемизация проходит независимо от того, является свободными симметрично сольватированными карбанионами.
Бимолекулярные механизмы реакций
Бимолекулярные механизмы реакций электрофильного алифатического замещения аналогичны механизму $S_N2$ в том отношении, что новая связь образуется, когда разрывается старый. Но в механизме $S_N2$ группа, которая входит, несет с собой пару электронов и эта орбиталь может перекрываться с орбиталью центрального атома углерода только в той мере, при которой группа, отрывается отделяется со своими электронами, в противном случае у углерода было бы больше восьми электронов на внешней оболочке. Поскольку электронные облака отталкиваются, новая группа атакует молекулу субстрата сзади под углом 180 $^\circ$ к группе, и отрывается так, что при этом наблюдается вращение конфигурации. Если атакующей частицей является электрофил, который привнесит в субстрат только вакантную орбиталь, такое рассмотрение непригодно и невозможно заранее предсказать, с какой стороны будет проходить атака. Теоретически можно представить два главных направления атак и соответственно два механизма: $S_E2$ (с фронта) и $S_E2$ (с тыла). Тогда при протекании реакции по первому механизму конфигурация должна сохраняться, по второму — вращаться. При атаке электрофилом с фронта существует и третья возможность. Часть молекулы электрофила способствует отделению группы, уходит, и образует с ней связь в тот же момент, когда образуется новая связь $C-Y$
При таком механизме, который называют $Sei$, также наблюдается сохранение конфигурации. Очевидно, что при такой бимолекулярного взаимодействия с внутренним содействием, атака с тыла невозможно. Такие три механизма различить довольно трудно; всем им соответствует кинетика второго порядка, и два из них осуществляются с сохранением конфигурации. Известная ограниченное количество реакций где можно однозначно указать на механизм реакции. С помощью стереохимии достаточно легко отличить реакцию механизма $S_E2$ (с тыла). Но большинство реакций электрофильного замещения проходят с сохранением конфигурации, указывает на фронтальную атаку. Например, при обработке цис-формы соединения 1 меченым хлоридом ртути конечный циклический продукт на 100% представляет собой цис-изомер. Поскольку в обоих продуктах реакции содержание меченого атома ртути примерно одинаковый, это означает, что должен разрываться связь между ртутью и циклом (а также второй связь $Hg-C$).
Еще одним указанием на фронтальную атаку является то, что электрофильного замещения второго порядка очень легко проходит в атомов углерода в голове моста мостиковых систем (например, 2,2,2 системы, 3,3,1 системы), тогда как реакции нуклеофильного замещения с такими системами проходят очень трудно, так как в таком случае реакция должна проходить при атаке с тыла. Примером служит также неопентил (2,2-диметилпропил) в качестве субстрата: поскольку атака с тыла здесь блокирована, реакции по механизму $S_N2$ проходят исключительно медленно. Тот факт, что реакции электрофильного замещения в неопентильной системе только несколько медленнее чем в этильную, также свидетельствует в пользу фронтальной атаки.
http://helpiks.org/4-53653.html
http://spravochnick.ru/himiya/elektrofilnoe_alifaticheskoe_zameschenie/bimolekulyarnye_i_monomolekulyarnye_reakcii/