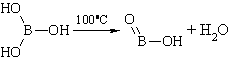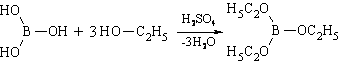Борная кислота
| Борная кислота | |
|---|---|
 | |
 | |
| Систематическое наименование | Ортоборная кислота |
| Хим. формула | H3BO3 |
| Состояние | твёрдое |
| Молярная масса | 61,83 г/моль |
| Плотность | 1,435 (15 °C) |
| Т. плав. | 170.9 °C, 444 K, 340 °F |
| Т. кип. | 300 °C, 573 K, 572 °F °C |
| pKa | 9,24 (I), 12,74 (II), 13,80 (III) |
| Растворимость в воде | |
| ГОСТ | ГОСТ 9656-75 ГОСТ 18704-78 |
| Рег. номер CAS | 10043-35-3 |
| PubChem | 7628 |
| Рег. номер EINECS | 233-139-2 |
| SMILES | |
| Кодекс Алиментариус | E284 |
| RTECS | ED4550000 |
| ChEBI | 33118 |
| ChemSpider | 7346 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
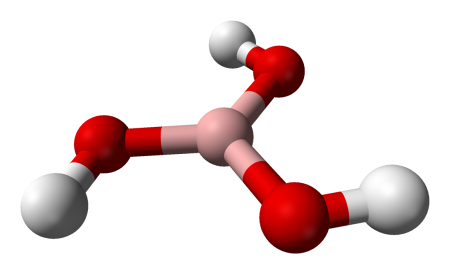
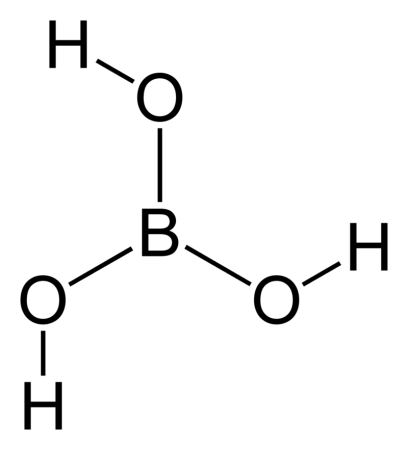
Борная кислота (ортоборная кислота или лат. acidum Boricum ) — слабая, одноосновная кислота Льюиса, часто используемая в качестве инсектицида, антисептика, огнезащитного состава, поглотителя нейтронов или предшественника для получения иных химических составов. Имеет химическую формулу H3BO3 (или B(OH)3).
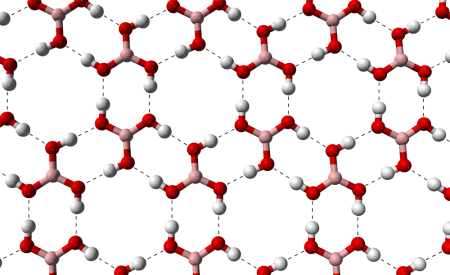
Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решётку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями, длина которых составляет 272 пм. Расстояние между соседними слоями — 318 пм.
Метаборная кислота (HBO2) также представляет собой бесцветные кристаллы. Она существует в трёх модификациях — наиболее устойчивой γ-HBO2 с кубической решёткой, β-HBO2 с моноклинной решёткой и α-HBO2 с ромбической решёткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы H3m-2nВmO3m-n. В природе встречается в виде минерала сассолина.
Содержание
- 1 Нахождение в природе
- 2 Получение
- 3 Свойства
- 4 Борная кислота в медицине
- 5 Применение
Нахождение в природе
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Получение
Борная кислота может быть получена путём смешения буры (Тетрабората натрия) с минеральной кислотой, например, соляной:
Также является продуктом гидролиза диборана или тригалогенидов бора:
B2H6 + 6H2O → 2H3BO3 + 6H2 BCl3 + 3H2O → H3BO3 + 3HCl 
Борная кислота ОСЧ
Свойства
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Её кислотные свойства обусловлены не отщеплением протона H + , а присоединением гидроксильного аниона:
Она легко вытесняется из растворов своих солей большинством других кислот. Соли её, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной H2B4O7, которая является значительно более сильной кислотой, чем ортоборная.
Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (BO3) 3− , поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4] − . В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведённым).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
При нагревании борная кислота растворяет оксиды металлов, образуя соли.
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
Образование борнометилового эфира В(OCH3)3 является качественной реакцией на H3BO3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зеленым пламенем.
Борная кислота в медицине
Борный спирт (лат. Solutio Acidi borici spirituosa ) — раствор борной кислоты в этиловом спирте (как правило, в 70 % этаноле).
Спиртовые растворы борной кислоты в концентрации 0,5 %, 1 %, 2 %, 3 %, 5 % готовятся на 70 % этиловом спирте и применяются в качестве антисептика и как противозудное средство при обтирании здоровых участков кожи вокруг очагов пиодермии, а также в качестве ушных капель.
Борная кислота может быть опасна только при бесконтрольном приёме внутрь. Опасная концентрация в организме человека (а особенно ребёнка) может возникнуть при регулярном применении. Смертельная доза при отравлении через рот для взрослого человека составляет 15-20 г, для детей — 4-5 г.
Борная кислота применяется в медицине с 60-х годов XIX века как антисептическое средство, не раздражающее ран и не имеющее вкуса, запаха и цвета. В современной медицине противомикробная эффективность борной кислоты считается низкой.
Использование борной кислоты в качестве антисептического средства для детей, а также беременных и кормящих женщин было запрещено 2 февраля 1987 года Министерством здравоохранения СССР по рекомендации Фармакологического комитета с формулировкой: «…запретить использование борной кислоты в качестве антисептического средства у детей грудного возраста, а также у женщин в период беременности и лактации в связи с её низкой активностью и высокой токсичностью».
Борная кислота (ФС.2.2.0002.15). Acidum boricum
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Борная кислота (ФС.2.2.0002.15)
ФАРМАКОПЕЙНАЯ СТАТЬЯ
ФС.2.2.0002.15 Борная кислота – Acidum boricum
Взамен ФС 42-3683-98
М. м. 61,83
Содержит не менее 99,0 % борной кислоты H3BO3.
Описание. Белый или почти белый кристаллический порошок, бесцветные блестящие жирные на ощупь пластинки или белые или почти белые кристаллы.
Растворимость. Легко растворим в кипящей воде и глицерине 85 %, растворим в воде и спирте 96 %.
Подлинность. 1. Качественная реакция. К 10 мл раствора, приготовленного в испытании на «Прозрачность» водного раствора, прибавляют 0,1 мл 0,05 % раствора метилового красного; должно появиться красно-оранжевое окрашивание.
2. Качественная реакция. 1,0 г субстанции растворяют в 10 мл кипящего спирта 96 %. К 3 мл полученного раствора прибавляют 1 мл серной кислоты концентрированной и перемешивают. При зажигании смесь должна гореть пламенем, окаймленным зеленым цветом.
рН. От 3,8 до 4,8 (3,3 % раствор, ОФС «Ионометрия», метод 3).
Сульфаты. Не более 0,045 % (ОФС «Сульфаты», метод 1). Определение проводят с использованием эталонного раствора, содержащего 9 мл стандартного раствора сульфат-иона (10 мкг/мл) и 1 мл воды. 5,0 г субстанции растворяют в 20 мл кипящей воды. Раствор охлаждают, доводят объем раствора водой до 25 мл и фильтруют. 1 мл фильтрата разбавляют водой до 10 мл.
Тяжелые металлы. Не более 0,0015 % (ОФС «Тяжёлые металлы»). Определение проводят с эталонным раствором, содержащим 3 мл стандартного раствора свинец-иона (5 мкг/мл) и 7 мл воды. 5 мл фильтрата, полученного в испытании на «Сульфаты», разбавляют водой до 10 мл.
Органические примеси. Субстанция не должна темнеть при прокаливании при красном калении.
Микробиологическая чистота. В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. К около 1 г (точная навеска) субстанции прибавляют 100 мл 20 % раствора маннита, предварительно нейтрализованного по фенолфталеину 0,1 М раствором натрия гидроксида, нагревают до полного растворения, охлаждают и титруют 1 М раствором натрия гидроксида с тем же индикатором до появления неисчезающего розового окрашивания.
Параллельно проводят контрольный опыт.
1 мл 1 М раствора натрия гидроксида соответствует 61,83 мг борной кислоты H3BO3 .
Хранение. В хорошо укупоренной упаковке.
Борная кислота с гидроксидом натрия уравнение
ЛП неорганической природы
SHAPE \* MERGEFORMAT
Acidum boricum – Кислота борная
Описание. Белые блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха. Летуч с парами воды и спирта. При продолжительном нагревании (до 100°С) теряет часть воды, переходя в метаборную кислоту ( HBO 2 ), при более сильном нагревании образуется стекловидная масса ( H 2 B 4 O 7 ), которая при дальнейшем нагревании, вспучиваясь, теряет всю воду и переходит в борный ангидрид ( B 2 O 3 ) бурого цвета. Водный раствор имеет слабокислую реакцию.
Растворимость. Растворим в 25 ч. воды, в 4 ч. кипящей воды, в 25ч. спирта, медленно в 7 частях глицерина.
Получение. Из природных минералов: ашарит ( Mg 2 B 2 O 5 ∙ H 2 O ), сассолин ( H 3 BO 3 ), бура ( Na 2 B 4 O 7 ∙10 H 2 O ), борокальций ( CaB 4 O 7 ∙10 H 2 O ):
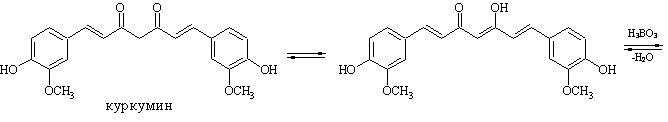
1. Реакция с куркумином (ГФ Х). Куркумовая бумага, смоченная раствором препарата и раствором соляной кислоты, окрашивается при высушивании в розовый или буровато-красный цвет, переходящий от смачивания раствором аммиака в зеленовато-черный:
SHAPE \* MERGEFORMAT
SHAPE \* MERGEFORMAT
Недопустимо присутствие Fe , Mo , W (образуют комплексы подобного цвета).
2. Образование борноэтилового эфира (ГФ Х) , горящего пламенем с зеленой каймой:
Примеси. Допустимые: мышьяк, хлориды, сульфаты, железо, тяжелые металлы, кальций.
Количественное определение (ГФ Х). Прямая алкалиметрия.
Титрант – NaOH , индикатор – фенолфталеин, среда – глицерин.
f экв ( H 3 BO 3 )=1, 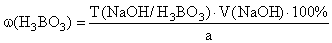
http://farmf.ru/prochee/bornaya-kislota-fs-2-2-0002-15-acidum-boricum/
http://nesterovdmitriy.narod.ru/03-Nauchnaya_Deyat/pharm_chem/Ac_boricum.htm