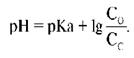Буферные системы, их классификация и механизм действия. Буферные растворы. Уравнение Гендерсона-Гассельбаха.
Буферными системами (буферами) называют растворы, обладающие свойством достаточно, стойко, сохранять постоянство — концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
На практике часто применяют следующие буферные смеси: ацетатный буфер CH3COOH + CH3COONa, бикарбонатный буфер H2CO3+NaHCO3, аммиачный буфер NH4OH +NH4Cl, белковый буфер белок кислота + белок соль, фосфатный буфер NaH2PO4 + Na2 HPO4
Фосфатная буферная смесь состоит из двух солей, одна из которых является однометаллической, а вторая — двухметаллической солью фосфорной кислоты.
Рассмотрим механизм буферного действия. При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СНзСООН); Из уравнения (а), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае НСl заменяется СН3СООН). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н + в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера, (СН3СООН) по реакции нейтрализации. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды. Анионы СНзСОО
, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
Примером кислотного буфера может служить ацетатный буферный раствор, содержащий смесь уксусной кислоты и ацетата натрия (СНзСООН + СНзСООNа). При добавлении к такому раствору кислоты она взаимодействует с солью и вытесняет эквивалентное количество слабой кислоты: СНзСООNа + НСl ó СН3СООН + NaСl. В растворе вместо сильной кислоты образуется слабая, и поэтому величина рН уменьшается незначительно. Если к этому буферному раствору добавить щелочь, она нейтрализуется слабой кислотой, и в растворе образуется эквивалентное количество соли: СНзСООН + NaОН ó СНзСООNа + Н2О. В результате рН почти не увеличивается. Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга. Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты: СНзСООNа -> Na + + СН3СОО
СНзСОО — + НОН ó СНзСООН + ОН — . Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени: СНзСООН ó СН3СОО+H — Слабая диссоциация СНзСООН еще более подавляется в при-сутствии СНзСООNа, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:[СНзСООН] = сr. C другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты: [СНзСОО] = сс. Это уравнение называют уравнением буферного раствора (уравнением Гендерсона Гассельбаха). Его анализ для буферного раствора, образованного слабой кислотой и ее солью, показывает, что концентрация водородных ионов в буферном растворе определяется константой диссоциации слабой кислоты и соотношением концентраций кислоты и соли. Уравнение Гендерсона-Хассельбаха для буферных систем основного типа:
31.Емкость буферных растворов и факторы, определяющие её. Буферные системы крови. Водородкарбонатный буфер. Фосфатный буфер.
Буферной емкостью (В) называется количество сильной кислоты или сильного основания, которое нужно прибавить к одному литру буферного раствора, чтобы изменить его рН на единицу. Она выражается в моль/л или чаще в ммоль/л и определяется по формуле: В = (c V) / д pH Vб , где В — буферная емкость; с — концентрация сильной кислоты или основания (моль/л); V — объем добавленного сильного электролита (л); Vб — объем буферного раствора (л); д рН — изменение рН.
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
Буферное действие уравнение гендерсона гассельбаха
а) Уравнение Гендерсона-Хассельбаха. Как уже обсуждалось ранее, концентрацию ионов Н+ принято выражать не в абсолютных величинах, а в единицах рН. Напомним, что значение рН представляет собой значение -lg ионов Н+.
Аналогичным способом может быть выражена константа диссоциации: рК = -log К.
Следовательно, концентрацию ионов Н+ в уравнении 4 можно выразить в единицах pH через отрицательный логарифм:
Чтобы не производить вычисления с отрицательным логарифмом, можно изменить его знак, поменяв местами числитель и знаменатель дроби согласно правилам логарифмирования. В результате получим:
Для бикарбонатной буферной системы рК равно 6,1, и уравнение выше может быть преобразовано следующим образом:
Последнее уравнение называют уравнением Гендерсона-Хасселъбаха. С его помощью можно рассчитать рН раствора при условии, если известны значения молярной концентрации HCO3 — и PCO2. Из этого уравнения становится очевидным, что увеличение содержания HCO3 — вызывает повышение рН, приводя к алкалозу.
Увеличение PCO2 снижает рН, смещая кислотно-щелочное равновесие в сторону ацидоза. Уравнение Гендерсона-Хассельбаха, дополнительно определяющее признаки нормального состояния рН и кислотно-щелочного равновесия во внеклеточной жидкости, позволяет понять механизмы физиологической регуляции содержания кислот и оснований во внеклеточной жидкости.
Как будет рассмотрено далее, концентрация бикарбонатов регулируется главным образом почками, тогда как PCO2 во внеклеточной жидкости зависит от вентиляции легких. Усиление легочной вентиляции способствует выведению CO2 из плазмы, при снижении показателей вентиляции легких значение PCO2 возрастает. Гомеостаз кислотно-щелочного состояния поддерживается согласованными действиями обеих систем: выделительной и дыхательной. Повреждение одного или обоих регулирующих механизмов приводит к нарушениям, вследствие которых содержание бикарбонатов или PCO2 во внеклеточной жидкости изменяется.
Нарушения, смещающие кислотно-щелочное равновесие путем изменения содержания бикарбонатов во внеклеточной жидкости, называют метаболическими, поэтому ацидоз, вызванный таким изменением, носит название метаболического ацидоза, а алкалоз, первичной причиной которого является увеличение концентрации ионов бикарбоната, называют метаболическим алкалозом. При увеличении PCO2 возникает дыхательный ацидоз, а при снижении — дыхательный алкалоз.
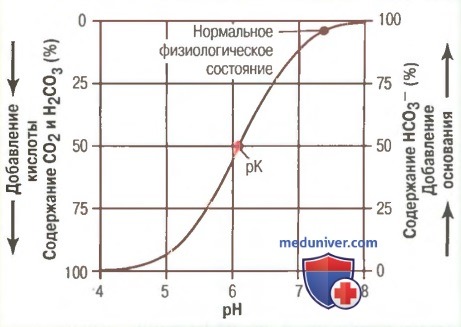
б) Кривая титрования бикарбонатной буферной системы. На рисунке выше показаны сдвиги рН во внеклеточной жидкости в ответ на изменения содержания HCO3 — и CO2 во внеклеточной жидкости. Когда концентрации двух этих компонентов равны, правая часть уравнения Гендерсона-Хасселъбаха становится логарифмом 1, который равен нулю, поэтому величина рН раствора такая же, как и рК (6,1) бикарбонатной буферной системы. При добавлении к ней основания часть растворенного CO2 преобразуется в HCO3 — , увеличивая значение соотношения HCO3 — к CO2 и, соответственно, рН, что становится очевидным из уравнения Гендерсона-Хассельбаха. Добавленная в раствор кислота связывается HCO3 — , который затем преобразуется в растворенный CO2, что уменьшает соотношение между HCO3 — к CO2 и рН внеклеточной жидкости.
в) Буферная емкость раствора определяется суммарной и относительной концентрацией компонентов буферной системы. Особенность расположения ряда точек, изображенных на кривой титрования рисунке, является вполне объяснимой. Во-первых, при условии, когда доля каждого компонента буферного раствора (HCO3 — и CO2) составляет по 50%, рН и рК равны. Во-вторых, буферная система наиболее эффективно действует в центральной части кривой, где рН приближен к рК системы. Это означает, что изменения рН, возникающие в результате добавления к раствору кислот или оснований, в этом диапазоне значений наименьшие. Деятельность буферной системы остается эффективной при отклонениях значений рН в любую сторону в пределах 1, что расширяет границы деятельности буфера от 5,1 до 7,1 единиц. Вне указанных границ буферная емкость быстро снижается. Когда весь CO2 преобразуется в HCO3 — или, наоборот, когда весь HCO3 — преобразуется в CO2, система полностью теряет емкость.
Абсолютная концентрация компонентов буферной системы также является важным показателем, определяющим буферную емкость. При низкой концентрации компонентов буферной системы добавленные даже в небольшом количестве кислоты и щелочи приводят к значительным изменениям рН.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха
Буферные системы
буферные системы образованы буферными растворами
буферные – растворы, рН которых почти не меняется
при разбавлении или добавлении небольших количеств к-ты или основания
ПР: ацетатный СН3СООН + СН3СООNa
согласно протонной теории буферные системы — сопряженные кислотно-основные пары B/BH + и НА/А —

основание сопряженная к-та к-та сопряженное основание
в живых организмах буферные системы поддерживают кислотно-основный гомеостаз
кислотно-основный гомеостаз — кислотно-основное равновесие внутренней среды организма
рН внутренней среды организма должен быть оптимальным для биохимических реакций
для человека физиологическое значение pH=7,4
кислотно-основное равновесие поддерживают буферные свойства крови и механизмы коррекции
62)Классификация буферных систем.
буферные системы различают по компонентам:
— слабая кислота и ее соль, образованная сильным основанием – буферная система кислотного типа
ПР: ацетатный буфер СН3СООН + СН3СООNa
по теории Берстреда буферная система кислотного типа — сопряженная кислотно-основная пара НА/А —
ПР: ацетатный буфер СН3СООН/СН3СОО —
— слабое основание и его соль, образованная сильной кислотой – буферная система основного типа
ПР: аммиачный буфер NН4ОН + NH4Cl
по теории Берстреда буферная система основного типа — сопряженная кислотно-основная пара B/BH +
— соли слабых многоосновных кислот – буферная система кислотного типа
по теории Берстреда буферная система кислотного типа — сопряженная кислотно-основная пара НА/А —
ПР: фосфатный буфер H2PO — /HPO4 2-
— амфолиты – буферная система кислотного типа
ПР: аминокислотный буфер
63)Механизм действия ацетатного буфера.
ацетатный буфер состоит из уксусной кислоты СН3СООН и ацетата натрия СН3СООNa
— уксусная кислота – слабый электролит
 | |
 |  |
где Ка=1,85×10 -5 — коэффициент диссоциации уксусной кислоты
— ацетат натрия – сильный электролит
ацетат натрия увеличивает концентрацию аниона СН3СОО —
равновесие реакции СН3СООН Û СН3СОО — + Н + смещается влево
диссоциация уксусной кислоты тормозится
практически, анион СН3СОО — образуется только путем диссоциации ацетата натрия СН3СООNa
молярная концентрация аниона СН3СОО — равна молярной концентрации соли [СН3СОО — ]=[СН3СООNa]

 |
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности уксусной кислоты
— при разбавлении ацетатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН ацетатного буфера сохранится
— при добавлении кислоты идет реакция кислоты и ацетата натрия
СН3СОО — + Na + + H + + Cl — ® СН3СООH + Na + + Cl —
катионы водорода H + связываются анионами уксусной кислоты СН3СОО — + H + ® СН3СООH
рН ацетатного буфера изменится за счет увеличения концентрации уксусной кислоты и уменьшения соли
механизм изменения рН:
*хотя образуется избыток уксусной кислоты СН3СООH и равновесие реакции СН3СООН Û СН3СОО — + Н + смещается вправо,
но по закону Освальда повышение концентрации СН3СООH снижает степень ее диссоциации,
и концентрация катионов водорода H + увеличивается незначительно,
поэтому при добавлении кислоты рН ацетатного буфера, практически, не изменится
— при добавлении основания идет реакция основания и уксусной кислоты
СН3СООH + Na + + ОН — ® СН3СОО — + Na + + Н2О
гидроксид-ионы ОH — связываются катионами водорода уксусной кислоты ОН — + H + ® Н2О
рН ацетатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона уксусной кислоты СН3СОО — и
равновесие реакции СН3СООН Û СН3СОО — + Н + смещается влево,
но по закону Освальда снижение концентрации СН3СООH повышает степень ее диссоциации,
и концентрация катионов водорода H + уменьшается незначительно,
*хотя уксусная кислота расходуется,
но диссоциируют на катионы водорода H + только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН ацетатного буфера, практически, не изменится
— при добавлении небольших количеств кислот-щелочей изменение рН ацетатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН ацетатного буфера значительно
Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха.
фосфатный буфер состоит из солей ортофосфорной кислоты: однозамещенной NaH2PO4 и двузамещенной Na2HPO4
— соли ортофосфорной кислоты – сильные электролиты
Na2HPO4® NaHPO4 — + Na + NaHPO4 — ® HPO4 2- + Na + HPO4 2- Û PO4 3- + Н + (эта стадия практически, не идет)
важно, что H2PO4 — — слабая кислота и слабый электролит, NaHPO4 — — сильный электролит



где Ка — коэффициент диссоциации кислоты H2PO4 —
— NaHPO4 — — сильный электролит
NaHPO4 — увеличивает концентрацию аниона HPO4 2-
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается влево
диссоциация H2PO4 — тормозится
практически, анион HPO4 2- образуется только путем диссоциации NaHPO4 —
молярная концентрация аниона HPO4 2- равна молярной концентрации соли [HPO4 2- ]=[NaHPO4 — ]
— рН фосфатного буфера определяет Ка и соотношение концентрации H2PO4 — и NaHPO4 —
 |
 |
 |
 |
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности кислоты H2PO4 —
— при разбавлении фосфатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН фосфатного буфера сохранится
— при добавлении кислоты идет реакция кислоты и NaHPO4 —
HPO4 2- + Na + + H + + Cl — ® H2PO4 — + Na + + Cl —
катионы водорода H + связываются анионами HPO4 2- + H + ® H2PO4 —
рН фосфатного буфера изменится за счет увеличения концентрации H2PO4 — и уменьшения HPO4 2-
механизм изменения рН:
*хотя образуется избыток H2PO4 — и
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается вправо,
но по закону Освальда повышение концентрации H2PO4 — снижает степень ее диссоциации,
и концентрация катионов водорода H + увеличивается незначительно,
поэтому при добавлении кислоты рН фосфатного буфера, практически, не изменится
— при добавлении основания идет реакция основания и H2PO4 —
гидроксид-ионы ОH — связываются катионами водорода ОН — + H + ® Н2О
рН фосфатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона HPO4 2- и
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается влево,
но по закону Освальда снижение концентрации HPO4 2- повышает степень ее диссоциации,
и концентрация катионов водорода H + уменьшается незначительно,
*хотя HPO4 2- расходуется,
но диссоциируют на катионы водорода H + только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН фосфатного буфера, практически, не изменится
— при добавлении небольших количеств кислот-щелочей изменение рН фосфатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН фосфатного буфера значительно
http://meduniver.com/Medical/Physiology/764.html
http://megaobuchalka.ru/1/4818.html