Бутилацетат – химическая формула, свойства и область применения.
Бутилацетат представляет собой химически активную жидкость, которая характеризуется приятным запах, но только в небольших концентрациях. Если же концентрация вещества будет довольно высокой, тогда запах становится резким и раздражительным для слизистой и глаз. Химическая формула бутилацетата — C6H12O2.
Если производитель придерживается гост 8981 78 в ходе производства бутилацетата, тогда вещество должно иметь следующие характеристики:
- Жидкость должна быть прозрачность и не иметь примесей.
- Концентрация основного вещества не меньше чем 99,0%.
- Плотность 0,878-0,881кг/дм3 при температуре окружающей среды 20 градусов по Цельсию.
- Содержание води не больше чем 0,02%.
- Малярная масса бутилацетата — 116.16 г/моль.
- Температура кипения составляет 126°C.
Другими словами бутилацетата называют бутиловым эфиром уксусной кислоты. Бутилацетат слаборастворим в воде, смешивается с растительными маслами и органическими растворителями. Структурная формула вещества представлена ниже:
Как же происходит получение бутилацетата? В промышленности его получают путем этерификации уксусной кислоты бутанолом в присутствии кислоты H2SO4 при температуре 100-110°С по непрерывной технологии.
Область применения бутилового эфира уксусной кислоты.
Бутилацетат считается наиболее распространённым растворителям для эффективного получения лакокрасочных материалов, а также их разбавления. Однако это далеко не единственное его применение:
- Он способен растворить жиры, эфиры целлюлозы, масла, виниловые полмеры, хлоркаучуки, карбиольные смоли и другие.
- Если добавить бутилацетат вместе с незначительным количеством бутилового спирта, то снижается риск возникновения белых лаковых пленок.
- Это душистое вещество, которое входит в состав парфюмерных композиций и фруктовых эссенций.
- Бутилацетат высокого качества используется в качестве дубильного вещества в кожевенной промышленности.
- Широко применяется в фармацевтической промышленности для отделения большинства первичных субстанций в ходе производства антибиотиков.
Дмитриевский химический завод — это ведущий производитель растворителей в России. Производство многокомпонентных растворителей, бутилацетата и уксусной кислоты реализуется уже более чем 100 лет. Поставляем растворители на ведущие автоконцерны России. Есть опция изготовления растворителя по рецептуре заказчика. Растворитель 646 от Дмитриевского химического завода — это продукт эталонного качества по доступной цене.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
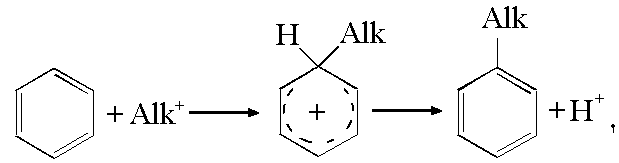
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Синтез бутилацетата (уксусно-бутилового эфира)Цель:получение бутилацетата Реактивы: уксусная кислота (ледяная) – 21 г (20 мл); н-бутиловый спирт – 25 г (31 мл); серная кислота (ρ = 1,84 г/см 3 ) – 3,7 г (2 мл); хлорид кальция безводный; гидрокарбонат натрия, 5%-ный раствор. Посуда и оборудование: колба круглодонная вместимостью 100 мл; капельная воронка; делительная воронка; холодильник водяной; насадка Дина-Старка; колба Вюрца; термометр; двурогий форштос; баня песчаная. Теоретические основы Замена атома водорода амино- или гидроксигруппы остатком кислородсодержащей минеральной, карбоновой или сульфокислоты называется ацилированием. Метод ацилирования применяется для двух различных целей. В одних случаях введённая ацильная группа сохраняется до образования конечного продукта, в других – ацилирование осуществляется для защиты амино- или гидроксигруппы с освобождением ацила после использования ацилированного продукта в каких-либо реакциях. Ацилирование спиртов (фенолов) и аминов протекает по механизму нуклеофильного замещения. Строго установлено, что в этой реакции роль субстратов выполняют ацилирующие агенты, а их взаимодействие с нуклеофилами протекает через стадию образования тетраэдрического промежуточного соединения (I): (здесь В = OR’, NHR’; X = OH, Hal, OCOR, OR). Реакции, катализируемые кислотами, протекают с образованием аналогичных промежуточных продуктов. Например, в процессе этерификации реакционноспособной частицей является соединение (II): которое, присоединяя молекулу спирта, образу2ет комплекс (III) с последующим отщеплением воды: В практике ацилирования широкое применение получили уксусная и муравьиная кислоты, уксусный и фталевый ангидриды, а также хлорангидриды кислот: хлористый ацетил CH3COCl, хлористый бензоил С6H5COCl. Порядок выполнения работы В круглодонную колбу, соединённую посредством двурогого форштоса с капельной воронкой и обратным холодильником через насадку Дина-Старка, помещают 20 мл ледяной уксусной кислоты, 31 мл н-бутилового спирта и 2 мл концентрированной серной кислоты. Содержимое нагревают до кипения на песчаной бане. Выделяющаяся при реакции вода отгоняется с бутиловым спиртом в виде азеотропной смеси и попадает в насадку Дина-Старка. По мере накопления жидкость из насадки сливают в небольшой мерный цилиндр, верхний слой (бутиловый спирт) через капельную воронку возвращают в реакционную колбу. Реакция считается законченной, когда выделится всё количество воды, рассчитанное по уравнению реакции, или когда слой воды в насадке перестанет изменяться. Полученный эфир промывают в делительной воронке сначала водой, затем раствором гидрокарбоната натрия до нейтральной реакции по индикаторной бумажке и вновь водой. Отделив эфир от водного слоя, его высушивают прокалённым хлоридом кальция и перегоняют, собирая фракцию, кипящую при 124-126°С. Выход 27 г (70% от теоретического). Уксуснобутиловый эфир (бутиловый эфир уксусной кислоты, бутилацетат) – бесцветная жидкость с эфирным запахом, смешивается с этиловым спиртом и диэтиловым эфиром, в воде растворяется слабо (1 г в 100 мл при 25°С). Температура кипения 124. 126°С, ИК-спектр: νС=О=1735 см –1 . Контрольные вопросы: 1. Что такое ацитилирование ? 2. По какому процессу происходит ацитилирование ? 3. Опишите физико-химические свойства бутилацетата ? 4. В какие реакции вступает дибутилацетат ? 5. Какие сферы применения бутилацетата вы знаете ? Лабораторная работа №5 Получение α-нитронафталина Цель:получить α-нитронафталин Реактивы: нафталин – 5 г; азотная кислота (ρ = 1,4 г/см 3 ) – 3,9 г; серная кислота (ρ = 1,84 г/см 3 ) – 5,0 мл; этиловый спирт. Посуда и оборудование:фарфоровый стакан вместимостью 50 мл; термометр; мешалка. Теоретические основы Введение в молекулу органического соединения нитрогруппы называется реакцией нитрования. В зависимости от природы субстрата и характера нитрующего агента механизм реакции может быть различным. Так, введение нитрогруппы в ароматическое ядро протекает по электрофильному механизму. Для наиболее распространённого случая нитрования смесью концентрированных азотной и серной кислот на примере бензола его можно представить следующей схемой: Электрофильный характер реакции определяется атакой на молекулу бензола нитроний-катиона NO2 + с образованием промежуточного σ-комплекса и последующим отщеплением прoтона. Порядок выполнения работы В фарфоровом стакане, снабжённом мешалкой и термометром, смешивают 5,0 мл серной кислоты с 2,7 мл воды и приливают 3,9 г (2,8 мл) азотной кислоты. К нитрующей смеси, нагретой до 50°С (термометр в смеси), вносят 5,0 г хорошо измельчённого нафталина. Перемешивание с помощью механической мешалки ведут в течение 1 ч при 50°С. Затем температуру повышают до 60°С и перемешивают ещё 1 ч. После охлаждения реакционной массы полученный нитронафталин всплывает на поверхность кислоты в виде пористой лепёшки. Продукт отделяют и промывают в фарфоровой чашке кипящей водой несколько раз. При этом с парами воды отгоняются остатки нафталина. Расплавленный нитронафталин выливают тонкой струёй в холодную воду при сильном перемешивании. Застывший в виде мелких шариков продукт фильтруют и сушат на воздухе. Выход 5,8 г (86 % от теоретического). Очистку α-нитронафталина производят перекристаллизацией из изопропилового спирта. α-Нитронафталин – жёлтый кристаллический продукт с ттемпературой плавления 59-60°С. Растворяется в этаноле, эфире, хлороформе, ацетоне. Контрольные вопросы: 1. Что такое нитрование ? 2. По какому процессу происходит нитрование ? 3. Опишите физико-химические свойства α-нитронафталина? 4. В какие реакции вступает α-нитронафталин? 5. В какой сфере применяется α-нитронафталин ? 6. Чем объясняется токсичность α-нитронафталина ? Лабораторная работа №6 Синтез n – толуолсульфокислоты Цель:получение n – толуолсульфокислоты Реактивы: толуол – 16 мл, серная кислота – 9,5 мл ( ρ =1,835 г/см 3 ), карбонат натрия – 8 г, хлорид натрия – 12 г. Посуда и оборудование:колба круглодонная длинногорлая (100 мл), холодильник Либиха, стакан химический, воронка Бюхнера, колба Бунзена, прибор для отсасывания. Теоретические основы Механизм С-алкилирования ароматического ядра включает участие катализаторов, способствующих образованию карбокатионов: Alk – Cl + AlCl3 → Alk — Cl … AlCl3 → Alk + + AlCl4–, В синтезе алкилпроизводных ароматического ряда в качестве алкилирующих агентов используются галогеналкилы, спирты и алкены. Во время взаимодействия ароматического соединения с первичными галогеналкилами, имеющими неразветвлённую цепь углеродных атомов, могут получаться производные с разветвлённой боковой цепью. Например, из бензола и пропилхлорида получается изопропилбензол, из бутилбромида и бензола – втор-бутилбензол. Экспериментальная часть Порядок выполнения работы В круглодонную колбу прибора помещают 16 мл толуола и осторожно вносят 9,5 мл концентрированной серной кислоты. Реакционную жидкость в течение 1 ч слабо кипятят, время от времени встряхивая колбу (для перемешивания слоев). Реакция считается законченной, когда слой толуола почти исчезает и из холодильника изредка стекают капли конденсата. Затем теплую реакционную смесь выливают в стакан с 70 мл воды (если смесь начинает кристаллизоваться, то ее надо подогреть) и колбу ополаскивают из промывалки. Кислый раствор осторожно нейтрализуют 8 г карбоната натрия, прибавляя его небольшими порциями, добавляют в раствор 20 г хлорида натрия и нагревают смесь до кипения (если хлорид натрия не растворяется, добавляют еще немного воды). Раствор охлаждают водой со льдом. Выпавшие кристаллы натриевой соли n-толуолсульфокислоты отсасывают на воронке Бюхнера и отжимают между листами фильтровальной бумаги. Выход – 8 г. Контрольные вопросы: 1. Что такое С-алкилирования? 2. В чем отличие С-алкилирования, N-алкилирования, S-алкилирования? 3. Опишите физико-химические свойства n-толуолсульфокислоты ? 4. В какие реакции вступает n-толуолсульфокислоты? 5. Какие сферы применения n-толуолсульфокислоты вы знаете ? источники: http://acetyl.ru/o/a29ka4.php http://lektsii.org/8-19773.html |




 Экспериментальная часть
Экспериментальная часть = 0,8820,
= 0,8820, 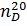 = 1,3941.
= 1,3941.
 HNO3 + 2H2SO4 NO2 + + 2HSO4 – + Н3О + ,
HNO3 + 2H2SO4 NO2 + + 2HSO4 – + Н3О + , Экспериментальная часть
Экспериментальная часть