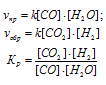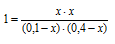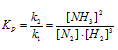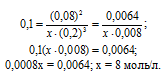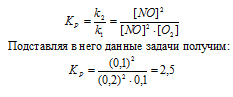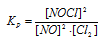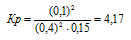Вычисление константы равновесия системы
Константа равновесия для гомогенной реакции
Задание 135.
Вычислите константу равновесия для гомогенной системы:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
если равновесные концентрации реагирующих веществ (молы/л):
[СО]р = 0,004; [Н2О]р = 0,064; [СО2]р = 0,016; [Н2]р = 0,016,
Чему равны исходные концентрации воды и СО? Ответ: Кр = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
Kp = [CO2] . [H2]/ [CO] . [H2O]
Подставляя в выражение данные задачи получим:
Кр = (0,016 . 0,016)/(0,004 . 0,064) = 1.
Для нахождения исходных концентраций веществ Н2О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н2О образуется 1 моль СО2 и 1 моль Н2. Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО2 и 0,016 моль Н2, то при этом было израсходовано по 0,016 моль СО и Н2О. Таким образом, искомые исходные концентрации равны:
Ответ: Кp = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
при некоторой температуре равна 1,00. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО]исх = 0,10; [Н2О]исх = 0,40.
Ответ: [СО2]Р = [Н2]Р = 0,08; [СO]P= 0,02; [Н2O]P = 0,32.
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Обозначаем за «х» моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 0,10 – х моль/л; [Н2О]исх = 0,40 — х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л): [СО2]Р = [Н2]Р = х; [СO]P= 0,10 — х; [Н2O]P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
Решая уравнение, находим х = 0,08. Отсюда равновесные концентрации (моль/л):
Задание 137.
Константа равновесия гомогенной системы N2 + ЗН2 = 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:
Подставим в выражение константы равновесия данные задачи и найдём концентрацию N2
Для нахождения исходной концентрации N2, учтём, что, согласно уравнению реакции на образование 1 моль NH3 затрачивается ½ моль N2. Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH3, то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N2. Таким образом, искомая исходная концентрация N2 равна:
Задание 138.
При некоторой температуре равновесие гомогенной системы
2NО + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ (молы/л): [NО]p = 0,2; [О2]р = 0,1; [NO2]р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O2. Ответ: К = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Решение:
Уравнение реакции:
Для нахождения исходных концентраций NO и O2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2, то при этом было затрачено 0,1 моль NO и 0,05 моль О2. Таким образом, исходные концентрации NO и О2 равны:
Ответ: Кp = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Смещение равновесия схимической системы
Задание 139.
Почему при изменении давления смещается равновесие системы:
N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:




Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:

б) Уравнение реакции:
Из уравнения реакции следует, что при протекании реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:




Задание 140.
Исходные концентрации [NО]исх и [С12]исх в гомогенной системе
2NO + Сl2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl2 ↔ 2NOС1
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 . 0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
Подставляя в данное выражение равновесные концентрации веществ, получим:
Ответ: Кр = 4,17.
Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия
Темы кодификатора: обратимые и необратимые реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
По возможности протекания обратной реакции химические реакции делят на обратимые и необратимые.
Обратимые химические реакции – это реакции, продукты которых при данных условиях могут взаимодействовать друг с другом.
Например , синтез аммиака — реакция обратимая:
Процесс протекает при высокой температуре, под давлением и в присутствии катализатора (железо). Такие процессы, как правило, обратимые.
Необратимые реакции – это реакции, продукты которых при данных условиях взаимодействовать друг с другом не могут.
Например , реакции горения или реакции, протекающие со взрывом — чаще всего, необратимые. Горение углерода протекает необратимо:
Более подробно про классификацию химических реакций можно прочитать здесь.
Вероятность взаимодействия продуктов зависит от условий проведения процесса.
Так, если система открытая , т.е. обменивается с окружающей средой и веществом, и энергией, то химические реакции, в которых, например, образуются газы, будут необратимыми.
Например , при прокаливании твердого гидрокарбоната натрия:
выделяется газообразный углекислый газ и улетучиватся из зоны проведения реакции. Следовательно, такая реакция будет необратимой при данных условиях.
Если же рассмотреть замкнутую систему , которая не может обмениваться веществом с окружающей средой (например, закрытый ящик, в котором происходит реакция), то углекислый газ не сможет улететь из зоны проведения реакции, и будет взаимодействовать с водой и карбонатом натрия, то реакция будет обратимой при данных условиях:
Рассмотрим обратимые реакции. Пусть обратимая реакция протекает по схеме:
aA + bB ⇔ cC + dD
Скорость прямой реакции по закону действующих масс определяется выражением:
Скорость обратной реакции:
Здесь k1 и k2 – константы скорости прямой и обратной реакции соответственно, СA, CB, CC, CD – концентрации веществ А, В, С и D соответственно.
Если в начальный момент реакции в системе нет веществ C и D, то сталкиваются и взаимодействуют преимущественно частицы A и B, и протекает преимущественно прямая реакция.
Постепенно концентрация частиц C и D также начнет повышаться, следовательно, скорость обратной реакции будет увеличиваться. В какой-то момент скорость прямой реакции станет равна скорости обратной реакции. Это состояние и называют химическим равновесием .
Таким образом, химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реакции равны .
Так как скорости прямой и обратной реакции равны, скорость образования реагентов равна скорости их расходования, и текущие концентрации веществ не изменяются . Такие концентрации называют равновесными .
Обратите внимание, при равновесии протекает и прямая, и обратная реакции, то есть реагенты взаимодействуют друг с другом, но и продукты взаимодействуют друг с другом с такой же скоростью. При этом внешние факторы могут воздействовать и смещать химическое равновесие в ту или иную сторону. Поэтому химическое равновесие называют подвижным , или динамическим .
Исследования в области подвижного равновесия начались еще в XIX веке. В трудах Анри Ле-Шателье были заложены основы теории, которые позже обобщил ученый Карл Браун. Принцип подвижного равновесия, или принцип Ле-Шателье-Брауна, гласит:
Если на систему, находящуюся в состоянии равновесия, воздействовать внешним фактором, который изменяет какое-либо из условий равновесия, то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Иными словами: при внешнем воздействии на систему равновесие сместится так, чтобы компенсировать это внешнее воздействие.
Этот принцип, что очень важно, работает для любых равновесных явлений (не только химических реакций). Однако мы сейчас рассмотрим его применительно к химическим взаимодействиям. В случае химических реакций внешнее воздействие приводит к изменению равновесных концентраций веществ.
На химические реакции в состоянии равновесия могут воздействовать три основных фактора – температура, давление и концентрации реагентов или продуктов.
1. Как известно, химические реакции сопровождаются тепловым эффектом. Если прямая реакция идет с выделением теплоты (экзотермическая, или +Q), то обратная — с поглощением теплоты (эндотермическая, или -Q), и наоборот. Если повышать температуру в системе, равновесие сместится так, чтобы это повышение компенсировать. Логично, что при экзотермической реакции повышение температуры компенсировать не получится. Таким образом, при повышении температуры равновесие в системе смещается в сторону поглощения теплоты, т.е. в сторону эндотермических реакций (-Q); при понижении температуры — в сторону экзотермической реакции (+Q).
2. В случае равновесных реакций, когда хотя бы одно из веществ находится в газовой фазе, на равновесие также существенно влияет изменение давления в системе. При повышении давления химическая система пытается компенсировать это воздействие, и увеличивает скорость реакции, в которой количество газообразных веществ уменьшается. При понижении давления система увеличивает скорость реакции, в которой образуется больше молекул газообразных веществ. Таким образом: при увеличении давления равновесие смещается в сторону уменьшения числа молекул газов, при уменьшении давления — в сторону увеличения числа молекул газов.
Обратите внимание! На системы, где число молекул газов-реагентов и продуктов одинаково, давление не оказывает воздействие! Также изменение давления практически не влияет на равновесие в растворах, т.е. на реакции, где газов нет.
3. Также на равновесие в химических системах влияет изменение концентрации реагирующих веществ и продуктов. При повышении концентрации реагентов система пытается их израсходовать, и увеличивает скорость прямой реакции. При понижении концентрации реагентов система пытается их наработать, и увеличивается скорость обратной реакции. При повышении концентрации продуктов система пытается их также израсходовать, и увеличивает скорость обратной реакции. При понижении концентрации продуктов химическая система увеличивает скорость их образования, т.е. скорость прямой реакции.
Если в химической системе увеличивается скорость прямой реакции, мы говорим, что равновесие сместилось вправо , в сторону образования продуктов и расходования реагентов . Если увеличивается скорость обратной реакции, мы говорим, что равновесие сместилось влево , в сторону расходования продуктов и увеличения концентрации реагентов .
Например , в реакции синтеза аммиака:
повышение давления приводит к увеличению скорости реакции, в которой образуется меньшее число молекул газов, т.е. прямой реакции (число молекул газов-реагентов равно 4, число молекул газов в продуктах равно 2). При повышении давления равновесие смещается вправо, в сторону продуктов. При повышении температуры равновесие сместится в сторону эндотермической реакции, т.е. влево, в сторону реагентов. Увеличение концентрации азота или водорода сместит равновесие в сторону их расходования, т.е. вправо, в сторону продуктов.
Катализатор не влияет на равновесие, т.к. ускоряет и прямую, и обратную реакции.
Необратимые и обратимые реакции
Все химические реакции делятся на два типа: обратимые и необратимые.
Необратимыми называются реакции, которые протекают только в одном направлении, т. е. продукты этих реакций не взаимодействуют друг с другом с образованием исходных веществ.
Необратимая реакция заканчивается тогда, когда полностью расходуется хотя бы одно из исходных веществ. Необратимыми являются реакции горения; многие реакции термического разложения сложных веществ; большинство реакций, в результате которых образуются осадки или выделяются газообразные вещества, и др. Например:
Обратимыми называются реакции, которые одновременно протекают в прямом и в обратом направлениях:
В уравнениях обратимых реакций используется знак обратимости 
Примером обратимой реакции является синтез йодоводорода из водорода и йода:
Через некоторое время после начала химической реакции в газовой смеси можно обнаружить не только конечный продукт реакции НI, но и исходные вещества —H2 и I2. Как бы долго ни продолжалась реакция, в реакционной смеси при 350 o С всегда будет содержаться приблизительно 80% HI,10% Н2 и 10% I2. Если в качестве исходного вещества взять НI и нагреть его до той же температуры, то можно обнаружить, что через некоторое время соотношение между количествами всех трех веществ будет таким же. Таким образом, при образовании йодоводорода из водорода и йода одновременно осуществляются прямая и обратная реакции.
Если в качестве исходных веществ взяты водород и йод в концентрациях [H2] и [I2], то скорость прямой реакции в начальный момент времени была равна: vпр = kпр[H2] ∙ [I2]. Скорость обратной реакции vобр = kобр[HI] 2 в начальный момент времени равна нулю, так как йодоводород в реакционной смеси отсутствует ([HI] = 0). Постепенно скорость прямой реакции уменьшается, так как водород и йод вступают в реакцию и их концентрации понижаются. При этом скорость обратной реакции увеличивается, потому что концентрация образующегося йодоводорода постепенно возрастает. Когда скорости прямой и обратной реакций станут одинаковыми, наступает химическое равновесие. В состоянии равновесия за определенный промежуток времени образуется столько же молекул НI, сколько их распадается на Н2 и I2.
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но так как скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются равновесными концентрациями.
Смещение химического равновесия
Принцип Ле-Шателье
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если скорость обратной реакции становится больше скорости прямой реакции, то говорят о смещении равновесия влево (в сторону обратной реакции). Результатом смещения равновесия является переход системы в новое равновесное состояние с другим соотношением концентраций реагирующих веществ.
Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884 г):
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются:
а) концентрации реагирующих веществ;
б) температура;
в) давление.
Влияние концентрации реагирующих веществ
Если в равновесную систему вводится какое-либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое-либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
Например, рассмотрим, какие вещества следует вводить и какие вещества выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо:
Для смещения равновесия вправо (в сторону прямой реакции образования аммиака) необходимо в равновесную смесь вводить азот и водород (т. е. увеличивать их концентрации) и выводить из равновесной смеси аммиак (т. е. уменьшать его концентрацию).
Влияние температуры
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермическая, то обратная реакция эндотермическая (и наоборот). При нагревании системы (т. е. повышении ее температуры) равновесие смещается в сторону эндотермической реакции; при охлаждении (понижении температуры) равновесие смещается в сторону экзотермической реакции.
Например, реакция синтеза аммиака является экзотермической: N2(г) + 3H2(г) → 2NH3(г) + 92кДж, а реакция разложения аммиака (обратная реакция) является эндотермической: 2NH3(г)→ N2(г) + 3H2(г) — 92кДж. Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Влияние давления
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
Например, для увеличения выхода аммиака (смещение вправо) необходимо повышать давление в системе обратимой реакции 
http://chemege.ru/termodynamics/
http://al-himik.ru/neobratimye-i-obratimye-reakcii/