C6h1206 cu oh 2 уравнение
Вопрос по химии:
C6H12O6+Cu(OH)2 = ? (при обычных условиях)
C6H12O6+Cu(OH)2 = ?(при нагревании)
C6H12O6+CuO = ?
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕВОДОВ
1 Реакции моносахаридов с открытой углеродной цепью
Химические свойства моносахаридов обусловлены наличием в их молекулах различных функциональных групп.
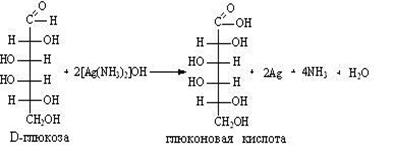
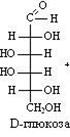
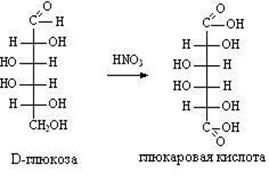
Глюкоза легко окисляется. В зависимости от характера окислителей получаются различные продукты.
1) Окисление под действием слабых (мягких) окислителей с образованием глюконовой кислоты.
К числу таких реакций относятся качественные реакции на глюкозу как альдегид:
а) реакция с аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Реакции моносахаридов с открытой углеродной цепью
1 Окисление моносахаридов мягкими окислителями дает альдоновые кислоты:
а)взаимодействие гидроксид иона с диамином серебра:
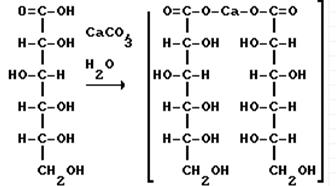
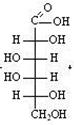
В результате получается глюконовая кислота, при взаимодействии которой с углекислым кальцием получается глюконат кальция – известное лекарственное средство.
Глюконовая кислота Глюконат кальция
б) реакция с гидроксидом меди (II) в щелочной среде при нагревании. Происходит восстановлении иона двухвалентной меди до одновалентной за счёт окисления альдегидных групп.
|
|
|
|
|
|
|


Реакция Троммера
При этом на холоде выпадает оранжево-жёлтый осадок гидрата закиси меди СuОН, а при нагревании – красный осадок закиси меди Сu2O.
2. Реакция спиртовых гидроксидов:
а) Взаимодействие с гидроксидом меди (II) с образованием алкоголята меди (II):


В ходе этой реакции альдегидная – СНО и первичная спиртовая группа –СН2ОН окисляются до карбоксильных групп – СООН.

Взаимодействие углеводов с карбоновыми кислотами идет с образованием сложных эфиров.
5) реакция этерификации:

Гидролиз сахарозы — уравнение реакции, формула и свойства
Сахароза — природный углевод, являющийся химическим органическим соединением. Его относят к дисахаридам, так как в его структуре содержится два моносахаридных звена: остатки молекул глюкозы и фруктозы, соединенных через гидроксильную группу. В быту сахарозу называют тростниковым (иногда свекловичным) сахаром.
Общие свойства
Внешне сахароза выглядит как бесцветные мелкие кристаллы. Ее физические свойства:
- в воде, этаноле растворима, однако практически не растворяется в метаноле и диэтиловом эфире;
- температура плавления равна 186 градусов по Цельсию. При застывании расплавленной массы получается аморфное прозрачное вещество, называемое карамелью;
- в природе находится в овощах, фруктах и ягодах.
Получение сахарозы
Получение — довольно сложный и тонкий процесс. Для этого сахарный тростник или свеклу измельчают до мелких опилок и переносят в громадные диффузоры.
В них происходит процесс вымывания сахарозы под действием горячей воды.
Так как совместно с С12Н22О11 в раствор попадают примеси, для отделения данных продуктов через раствор пропускают гидроксид кальция Ca (OH2). После такой процедуры происходит образование почти нерастворимых солей, выпадающих в осадок (CaCO3), и растворимого сахарата кальция С12Н22О11*СаО*2Н2О.
Следующим шагом углекислый газ (СО2) добавляют к получившемуся раствору с целью разделения сахарата кальция.
В результате в осадок выпадает карбонат кальция, который отфильтровывается, а оставшийся раствор выпаривают в специальных вакуумных аппаратах. Далее образующиеся кристаллики разделяются при помощи центрифуги. Оставшийся раствор называется меласса. Он широко применяется для получения лимонной кислоты.
Полученная сахароза подвергается дополнительным очисткам, кристаллизации и упариванию.
Сферы применения
Сахароза применяется во многих областях:
Химические свойства
Формула — C12H22O11. Она не проявляет восстановительных свойств, а реакции идут обычно по гидроксильным группам:
Гидролиз дисахаридов — химическая реакция, при которой вода вступает в реакцию с другими веществами.
Для дисахаридов характерна данная реакция (среда должна быть кислой либо необходимо присутствие фермента) с образованием моносахаридов, то есть происходит диссоциация. Чтобы гидролизоваться, нужна кислота.
Гидролизация происходит при высокой температуре и в присутствии ионов водорода. В результате она расщепляется до молекулы глюкозы и молекулы фруктозы.
Уравнение реакции гидролиза сахарозы можно написать следующим образом: C12H22O11+H2O=C6H12O6 (глюкоза)+C6H12O6 (фруктоза).
Из моносахаридов можно получить дисахариды обратной реакцией. А также в живых существах данная реакция происходит при участии различных ферментов. Скорость протекания реакции зависит от количества С12Н22О11 в растворе.
http://helpiks.org/3-69945.html
http://kupuk.net/uroki/himiya/gidroliz-saharozy-yravnenie-reakcii-formyla-i-svoistva/